en
names in breadcrumbs


Birds of prey and carnivorous mammals, as well as snakes and large lizards may prey on pteropodids. Pteropodids tend to have fewer predators on islands. However, there have been several cases of introductions of non-native, arboreal snakes which have decimated pteropodid populations.
Pteropodids rely heavily on vision and olfaction when navigating and foraging. Intraspecific communication is often vocal. In some species, such as Pteropus poliocephalus, vocal signaling may be associated with specific motor activities which enhance the meaning of the vocal signal. In species such as Eidolon helvum, sexually dimorphic sebaceous glands which are larger in males may provide olfactory behavioral cues.
Communication Channels: visual ; tactile ; acoustic ; chemical
Perception Channels: visual ; tactile ; acoustic ; ultrasound ; chemical
The head and body length of pteropodids varies from 50 mm to 406 mm. Despite size, many characteristics are shared among genera. A relatively long rostrum (pronounced in nectarivores), large eyes, and simple external ears give members of this family a dog or fox-like appearance (hence “flying fox”). The genera Nyctimene and Paranyctimene are exceptions in that they contain tubular nostrils that project from the upper surface of the snout. On the skull, postorbital processes are present over the orbital region. The palatine extends posterior to nearly cover the presphenoid. No more than two upper and two lower incisors are present in adults, otherwise cheek and canine dentition varies between species. The tongue is highly protrusible in nectar feeding bats and often complex with terminal papillae.
The chest is robust, comprised of the down-thrusting pectoralis and serratus muscles. The articulating regions of the humerus never come into contact with the scapula, which differs from a locking mechanism that occurs in the shoulder joint of other bat groups. The second digit is relatively independent from the third digit and contains a vestigial claw that adorns the leading edge of the wing.
Modifications for hanging include a relocation of the hip socket. The acetabulum is shifted upward and dorsally, and articulates with a large headed femur for a wider range of motion. In contrast to most other mammal orders, the legs cannot be positioned in a straight line under the body. In conjunction with large claws on their feet, pteropodids use a tendon-ratchet system that allows them to hang without prolonged muscular contraction. The legs manipulate a primitive uropatagium during flight. Aside from Notopteris, most species are tailless or with just a spicule of a tail.
Several species of Pteropodidae demonstrate sexual dimorphism. Males of Hypsignathus monstrosus have rather outlandish facial features, while females have the conservative fox-like look. Males of the genus Epomops have distinctive white patches in association with a glandular membrane on their shoulders, whereas females do not. Considering the whole family, males are generally larger than females. The penis of all pteropodids is a pendant and freely movable organ, resembling that of Primates. Juveniles are typically naked or have a velvety coat that is darker than adult pelage.
Other Physical Features: endothermic ; homoiothermic; bilateral symmetry
Sexual Dimorphism: sexes alike; male larger; sexes colored or patterned differently; ornamentation
Pteropodids have been known to live at least 30 years, both in captivity and in the wild.
Pteropodids typically occur in primary or maturing secondary forests. A few species inhabit savannah habitats where they roost in bushes and low trees. Over half of the 41 genera are made up of species that roost in trees. Gregarious species roost on the open branches of large, canopy-emergent trees. Pteropodids that roost singly or in small groups can be found in dead palm leaves, aerial roots, and even arboreal termite nests. These bats also tend to have cryptic coloration and wrap themselves with their wings in order to resemble dead leaves. In one species, Cynopterus sphinx, individuals construct tents by chewing folds in palm leaves. Caves, cliff walls, mines, and the eaves of buildings also serve as roosting locations for species in 17 genera. Most cave-dwelling species are limited to the lit areas near the opening, while members of the genus Rousettus are able to navigate the darker regions using crude echolocation.
Flowering plants are essential to the diet of pteropodid species; therefore, flying foxes mostly use woodlands or orchards for food. Canopy emergent fruiting trees, such as fig and baobab trees, are frequently used as a food source. The flowers of baobab trees have a strong fragrance and are located on the crown of the tree, which makes them easily accessible to bats (a flower syndrome known as chiropterophily). Many pteropodid species are found in coastal areas and drink salt water in order to supplement nutrients lacking in their diet.
A few species are migratory. Eidolon helvum individuals gather in large numbers and migrate hundreds of kilometers northward with seasonal rains, only to return to southern Africa at the end of the rainy season. Pteropus scapulatus populations make major, and somewhat erratic movements within Australia, following the flowering periods of Eucalyptus trees. Many species of Pteropus roost on islands and make daily migrations to the mainland for foraging. Some species range from sea level to 2500 m, yet little is known about any significant elevational migrations.
Habitat Regions: tropical ; terrestrial
Terrestrial Biomes: savanna or grassland ; forest ; rainforest
Other Habitat Features: suburban ; agricultural ; riparian ; estuarine
Pteropodidae has a tropical and subtropical distribution in the Old World (eastern hemisphere). Species are found as far north as the eastern Mediterranean, continuing along the southern coast of the Arabian Peninsula and across South Asia. Species are found as far south as South Africa, the islands of the Indian Ocean, and to the northern and western coasts of Australia. The longitudinal range reaches from the Atlantic coast of Africa to the islands of the western Pacific. Pteropodids are absent from northwest Africa, southwest Australia, a majority of the Palearctic region, and all of the Western Hemisphere.
Biogeographic Regions: palearctic (Native ); oriental (Native ); ethiopian (Native ); australian (Native ); oceanic islands (Native )
Pteropodids are frugivorous and nectarivorous. Some species also eat flowers of the plants they visit. Foraging habits are not well documented, though many species of the genus Pteropus rely heavily on figs. Many species rely on broad array of resources, though there may be a functional dichotomy between large species that rely heavily on canopy resources and smaller species that can use understory resources. Some larger species can use the claws on their thumbs and second digits to climb into the understory and seek out fruit that is hidden or inaccessible by flight.
Primary Diet: herbivore (Frugivore , Nectarivore )
Pteropodids provide important pollination and seed dispersal services to a wide range of plants. On islands in the south Pacific, pteropodids are the principle pollinators and dispersers of plants. Many plants have adaptations specifically for seed dispersal and pollination by bats, such as fruiting or flowering at the ends of branches and at bat accessible locations in the canopy. Eidolon dupreanum has been shown to likely be the sole pollinator of the baobab tree Adansonia suarezensis in Madagascar.
Ecosystem Impact: disperses seeds; pollinates
Larger species of pteropodids are hunted for their meat. Both subsistence and commercial hunting of Pteropus species have been reported. Consumer demand for Pteropus species on the island of Guam has been so great that it has resulted in the extinction of at least one species in the Pacific region. Flying foxes are also important in the dispersal and pollination of economically important plants. They attract tourists in some areas and produce accumulations of guano that can be used as fertilizer.
Positive Impacts: food ; ecotourism ; produces fertilizer; pollinates crops
Many crop species are attractive food sources for pteropodids. Because cultivars are often developed from wild species, these commercial crops have the same characteristics that wild plants evolved to attract bats to their fruit. Fruit growers have experimented with visual, audio, and olfactory deterrents as well as electric wire to keep pteropodids from eating their crops. Pteropodids may also be dispersers of invasive plant species, as they consume crops introduced for cultivation and may disperse the seeds into natural habitat. Pteropodids have been indicated as reservoirs for a variety of viruses such as Ebola and other viruses in the family Paramyxoviridae. Hendra virus, Menangle virus, and Nipah virus have all been linked to pteropodids.
Negative Impacts: injures humans (carries human disease); crop pest
Members of Pteropodidae are known colloquially as the flying foxes, or Old World fruit bats. The family is composed of 41 genera and about 170 species. The most species-rich genus in the family is Pteropus with 59 species, many of which are island endemics. Body and wing size ranges from small (37 mm forearm length) to large (220 mm forearm length). The family boasts the largest bats in the world. Pteropus vampyrus individuals have a wingspan of up to 1.7 m. Pteropus giganteus individuals have a comparable wingspan but a greater mass, with males weighing between 1.3 and 1.6 kg. Pteropodids are strictly vegetarian, foraging for fruits, nectar, and pollen using their sight and a sensitive olfactory system. Bats of the genus Rousettus use tongue clicks as a crude form of echolocation while navigating in the dark. Some species are migratory, covering vast distances, while others have more moderate home ranges. Eidolon helvum individuals aggregate in numbers reaching the hundreds of thousands, yet many species roost with only a few conspecifics. Members of Pteropodidae service the ecosystems they inhabit by playing important roles as pollinators and seed dispersers.
Many factors threaten pteropodids throughout their range. Human activities have decimated populations of certain species directly through hunting or indirectly through habitat destruction. In Asia and Australia, deforestation is the most important contributor to pteropodid population decline. Some species are vulnerable to typhoons and hurricanes which may destroy roosting habitat on islands. The IUCN Red List of Threatened Species lists 5 species as recently extinct, 10 species as critically endangered, 19 species as endangered, 15 species as near threatened, and 39 species as vulnerable, suggesting that nearly half of all pteropodid species face significant threats to population viability.
Mating behavior in pteropodids is highly variable, and much is unknown. The males of one genus (Hypsignathus) set up lekking territories twice a year and draw in females with unique vocalizations and wing-flapping displays. Male epauletted fruit bats (genus Epomophorus) often display their concealed epaulets (hair tufts near the shoulder) and emit courting calls to attract females. Many species form harems consisting of 1 dominant male and up to 37 females, while bachelor males roost separately.
Mating System: polygynous ; polygynandrous (promiscuous)
While most bats have one reproduction event per year, many pteropodids are polyestrous, with two seasonal cycles corresponding to the annual wet and dry seasons. Usually one young is born per pregnancy, but twins are not uncommon. Upon fertilization, ova implantation in the uteri can be immediate or delayed, probably in response to the environment. Development of the embryo (once implanted) may also be delayed, probably to ensure birth at a time when fruit is available during the rainy seasons. One species, Macroglossus minimus, exhibits asynchronous breeding and sperm storage, suggesting the importance of birth during an optimal (rainy) season.
Pregnant females usually leave social roosts to form nursery groups with other pregnant females. Females in nursery roosts form their own social network and take care of each other through mutual grooming. Gestation periods usually lasts 4 to 6 months, but can be longer if implantation is delayed. Birth patterns of pteropodids have been widely studied and usually occur during the wet periods both in the northern latitudes (February to April) and the southern latitudes (August to November). Species that are polyestrous will give birth during both of these rainy seasons. It is predicted that birth during these seasons yields high survival rates because lactation occurs when fruit availability is at a maximum. Birth is followed by postpartum estrous and subsequent mating. After weaning, young may stay with their mothers up to 4 months. Sexual maturity in juveniles is reached by 2 years old or earlier. Female sexual maturity is reached earlier than in males.
Key Reproductive Features: iteroparous ; seasonal breeding ; gonochoric/gonochoristic/dioecious (sexes separate); sexual ; viviparous ; delayed implantation ; post-partum estrous
Female pteropodids are primarily responsible for rearing the young. Lactation lasts anywhere from 7 weeks to 4 months, and the mother may care for her young slightly longer. In one genus (Dyacopterus), males with functional mammary glands have been reported lactating, which suggests the sharing of juvenile care among both parents.
Parental Investment: altricial ; pre-fertilization (Provisioning, Protecting: Female); pre-hatching/birth (Provisioning: Female, Protecting: Female); pre-weaning/fledging (Provisioning: Female, Protecting: Female); pre-independence (Provisioning: Female, Protecting: Female)
İriqanadlar (lat. Megachiroptera və ya lat. Pteropodidae) — yarasalar dəstəsinin aid heyvan yarımdəstəsi.
Bu yarımdəstəyə yeğanə iriqanadkimilər (Pteropidae) fəsiləsi daxildir. Fəsilənin Pteropus və Rousettus cinslərini, bəzən isə bütün nümayəndələrini uçan itlər adlandırırlar.
Yarasalardan fərqli olaraq, iriqanadlar böyük ölçülərə malik olurlar. Onların bədənləri 42 sm, qanadlarının ölçüləri 1,7 m-ə (iriqanad) çatır. Buna baxmayaraq, bədənləri 5-6 sm, qanadlarının uzunluğu 24 sm-ə çatan kiçik ölçülü növləri də var. Kütlələri 15-900 q arasında dəyişir. Quyruqları qısa, inkişaf etməmiş olur, yaxud, ümumiyyətlə olmur. Ancaq uzunquyruq iriqanadda (Notopteris) quyruğu nisbətən uzun olur. Qanadın II barmağı uc hissəsi olmaqla, adətən caynaqlı olur.
İriqanadlar (lat. Megachiroptera və ya lat. Pteropodidae) — yarasalar dəstəsinin aid heyvan yarımdəstəsi.
Bu yarımdəstəyə yeğanə iriqanadkimilər (Pteropidae) fəsiləsi daxildir. Fəsilənin Pteropus və Rousettus cinslərini, bəzən isə bütün nümayəndələrini uçan itlər adlandırırlar.
Yarasalardan fərqli olaraq, iriqanadlar böyük ölçülərə malik olurlar. Onların bədənləri 42 sm, qanadlarının ölçüləri 1,7 m-ə (iriqanad) çatır. Buna baxmayaraq, bədənləri 5-6 sm, qanadlarının uzunluğu 24 sm-ə çatan kiçik ölçülü növləri də var. Kütlələri 15-900 q arasında dəyişir. Quyruqları qısa, inkişaf etməmiş olur, yaxud, ümumiyyətlə olmur. Ancaq uzunquyruq iriqanadda (Notopteris) quyruğu nisbətən uzun olur. Qanadın II barmağı uc hissəsi olmaqla, adətən caynaqlı olur.
Pteropodidae zo ur c'herentiad e rummatadur ar bronneged, ennañ eskell-kroc'hen.
Pteropodidae zo ur c'herentiad e rummatadur ar bronneged, ennañ eskell-kroc'hen.
Kaloni (Megachiroptera) jsou jeden ze dvou podřádů letounů, což je skupina savců, kam dále patří například netopýři. Zařazuje se k nim jediná čeleď, kaloňovití (Pteropodidae). Přes své velké rozměry jsou kaloni velmi lehcí a i ti největší kaloni dosahují hmotnosti jen pod dva kilogramy.
Tělo kaloňů je podobné tělu netopýrů, ale jeho hlava se nápadně podobá liščí hlavě.
Kaloni zajišťují u několika stovek rostlin přenos pylu (zoogamie).
Kaloni jsou především býložravci a živí se sladkými plody. Za potravou vyletují ve dne, v hejnech nebo osamoceně, pak se usadí na ovocném stromě a požírají plody. Stonky a semena opatrně vyplivují.
Někteří kaloni dali dokonce přednost požírání nektaru a pylu z tropických květin, které mají k dispozici po celý rok. Tito letouni létají v hejnech asi po dvaceti, poté krouží kolem rostliny a jednotlivě vystřelují dlouhý jazyk, aby ochutnali nektar. Jakmile je potrava vyčerpána, hejno se přemístí k další rostlině. Na rozdíl od jiných kaloňů tito nehibernují, ale létají celý rok a stále se krmí. Pomáhají tak opylovat rostliny a usnadňují tvorbu semen.
Kaloni využívají k orientaci svoje velké oči spolu s echolokací. Ultrazvuk vysílají pomocí jazyku, kterým klikají. Kaloni sekundárně ztratili laryngeální echolokaci.
Některé druhy kaloňů stojí pravděpodobně za původem obávaného ebola viru, způsobující krvácivou horečku (nejsmrtelnější typy viru mají až 90 % smrtnost). K přenosu na primáty došlo možná kontaminovaným ovocem. Také virus Marburg je s nimi spojován.
172 druhů kaloňů žije v tropických a subtropických oblastech Asie, Oceánie a Afriky. Mezi ně patří například:
Kaloni (Megachiroptera) jsou jeden ze dvou podřádů letounů, což je skupina savců, kam dále patří například netopýři. Zařazuje se k nim jediná čeleď, kaloňovití (Pteropodidae). Přes své velké rozměry jsou kaloni velmi lehcí a i ti největší kaloni dosahují hmotnosti jen pod dva kilogramy.
Tělo kaloňů je podobné tělu netopýrů, ale jeho hlava se nápadně podobá liščí hlavě.
Kaloni zajišťují u několika stovek rostlin přenos pylu (zoogamie).
Storflagermus er en underorden af flagermus. Der eksisterer kun en enkelt familie, kaldet flyvende hunde (Pteropodidae). De fleste (men ikke alle) arter er større end småflagermus: De mindste er 6 cm lange, de store bliver 40 cm lange og har et vingefang på 1,5 m. Disse kæmper kan veje mere end et kilogram.
Flyvende hunde lever af frugt og nektar fra blomster, i stedet for insekter som småflagermus. Den flyvende hund har fået sit navn, fordi hovedet ligner en hunds. Småflagermus har et hoved, der mere ligner en lille gnavers hoved. De flyvende hunde bruger fortrinsvis syn og lugtesans til at orientere sig med.
Flyvende hunde tilbringer dagen sovende i kolonier på op til 10.000 individer. I klippehuler eller i frugtbærende træer hænger de i fødderne med hovedet nedad og vingerne slået sammen om kroppen. Når mørket falder på, letter alle de flyvende hunde på én gang og begiver sig i samlet trop ud for at finde modne frugter.
Ungerne sidder de første måneder på maven af hunnen og dier hos hende. Senere bliver de hægtet af i træerne, når hunnen om natten skal ud og lede efter føde. Når ungerne er omkring 6 måneder, følger de med de voksne ud for at finde føde.
Kun en enkelt art, den ægyptiske flyvende hund (Rousettus aegyptiacus), kan benytte sig af ekkolokalisering ligesom småflagermus.[1]
Underordnen Megachiroptera omfatter kun en enkelt familie, Pteropodidae med i alt cirka 186 nulevende arter.
Eksempel på arter:
Storflagermus er en underorden af flagermus. Der eksisterer kun en enkelt familie, kaldet flyvende hunde (Pteropodidae). De fleste (men ikke alle) arter er større end småflagermus: De mindste er 6 cm lange, de store bliver 40 cm lange og har et vingefang på 1,5 m. Disse kæmper kan veje mere end et kilogram.
Die Flughunde (Pteropodidae) sind eine Säugetierfamilie aus der Ordnung der Fledertiere (Chiroptera). Sie sind die einzige Familie der Überfamilie Pteropodoidea und bilden zusammen mit den Hufeisennasenartigen (Rhinolophoidea) die Unterordnung Yinpterochiroptera.[1] Die Familie umfasst rund 40 Gattungen mit knapp 200 Arten.
Flughunde sind in tropischen und subtropischen Regionen in Afrika (einschließlich Madagaskar und den Seychellen), im Indopazifik, dem südlichen Asien, Australien und dem westlichen Ozeanien verbreitet. Am Rande der europäischen Fauna ist lediglich der Nilflughund in der Südtürkei sowie auf der Insel Zypern anzutreffen. Sie gehören geographisch zu Asien.
Flughunde stellen die größten Fledertierarten dar. Der Kalong erreicht eine Flügelspannweite von bis zu 170 Zentimetern und manche Arten haben eine Kopfrumpflänge von bis zu 40 Zentimetern. Allerdings sind viele Arten kleiner und die größten Fledermaus-Arten sind deutlich größer als die kleinsten Flughunde-Arten.
Im Körperbau entsprechen die Flughunde den übrigen Fledertieren, die Flugmembran wird von den verlängerten zweiten bis fünften Fingern gespannt und reicht bis zu den Fußgelenken. Allerdings haben die meisten Flughunde – mit Ausnahme des Langschwanzflughundes (Notopteris) – keinen oder nur einen sehr kurzen Schwanz. Auch das Uropatagium (die Schwanzflughaut) ist nur ein schmaler Streifen entlang der Hinterbeine. Ein weiteres Unterscheidungsmerkmal zu den Fledermäusen ist eine Kralle am zweiten Finger, die bei den meisten Flughundarten vorhanden ist, bei den Fledermäusen jedoch fehlt.
Die Gesichter der Flughunde sind einfach gebaut. Die Nasen besitzen keine Nasenblätter und ihre kleinen, ovalen Ohren keinen Tragus. Die Schnauzen sind oft verlängert, was zu dem hundeartigen Aussehen und ihrem deutschen Namen geführt hat.
Flughunde sind in erster Linie dämmerungs- oder nachtaktiv. Sie legen bei der Nahrungssuche oft weite Strecken zurück, tagsüber schlafen sie kopfüber hängend. Im Gegensatz zu Fledermäusen findet man Flughunde oft auf Bäumen an exponierten Stellen hängend – in tropischen Regenwäldern bevorzugt auf den über das Kronendach ragenden „Urwaldriesen“.
Ein weiterer Unterschied zu den Fledermäusen ist das Fehlen der Echoortung – außer bei den Rosettenflughunden. Flughunde haben gut entwickelte Augen und einen ausgezeichneten Geruchssinn. Aufgrund des warmen Klimas in ihrem Verbreitungsgebiet halten sie keinen Winterschlaf. Während die größeren Arten oft in großen Gruppen zusammenleben, wobei sie große Kolonien mit bis zu 500.000 Tieren bilden können und ein komplexes soziales Verhalten entwickeln, sind die kleineren Arten eher Einzelgänger.
Flughunde ernähren sich pflanzlich, von Nektar, Pollen, Früchten und Blüten. Eine Reihe von Arten ist dadurch für die Vegetation wichtig, da sie beim Verzehr von Früchten Samen transportieren oder auch Blüten bestäuben (Chiropterophilie). Größere Kolonien vermögen so in einer Nacht mehrere hunderttausend Samen zu verbreiten, wie dies etwa bei den afrikanischen Palmenflughunden nachgewiesen wurde, wodurch Pflanzen wieder in bereits entwaldete Regionen gelangen können.[2]
Selbst der Geschlechtsakt wird kopfüber durchgeführt. Meistens bringen die Weibchen nur einmal im Jahr ein einzelnes Jungtier zur Welt. Trächtige Weibchen sondern sich oft von den Männchen ab und bilden Wochenstuben, in denen sie den Nachwuchs großziehen. Flughunde sind relativ langlebige Tiere, sie erreichen ein Alter von bis zu 30 Jahren.
Acht Arten sind laut IUCN ausgestorben, 22 weitere gelten als gefährdet oder stark gefährdet.
Der Hauptgrund für die Bedrohung der Arten ist die Zerstörung ihres Lebensraums durch Rodung der Wälder. Viele Arten sind darüber hinaus auf kleinen Inseln endemisch und daher besonders anfällig für Störungen des Ökosystems. Manche Arten werden vom Menschen als Schädlinge betrachtet, weil sie die Früchte in Obstplantagen fressen, oder sie werden ihres Fleisches wegen gejagt.
Die Regierung von Mauritius hat im Oktober 2015 beschlossen, 20 Prozent der Population von Pteropus niger zu töten, weil die Tiere angeblich die Ernte von Mangos und Litschis schädigen. Tierschützer und die Weltnaturschutzunion IUCN warnten, das könne die Art an den Rand des Aussterbens bringen.[3]
Ob die Fledertiere (Flughunde und Fledermäuse) monophyletisch sind, das heißt, sich aus einem gemeinsamen Vorfahren entwickelt haben, oder sich unabhängig voneinander entwickelten und nur ein Beispiel konvergenter Evolution darstellen, war längere Zeit umstritten. Heute geht man aber meist von der Monophylie der Fledertiere aus. Näheres siehe unter Systematik der Fledertiere.
Traditionell wurden die Flughunde in zwei Unterfamilien unterteilt: Den Eigentlichen Flughunden (Pteropodinae) stand eine Gruppe kleinerer Tiere gegenüber, die sich durch eine lange Zunge auszeichnen und sich vorwiegend von Nektar ernähren, diese wurden als Langzungenflughunde (Macroglossinae) bezeichnet. Jüngere Untersuchungen haben jedoch gezeigt, dass diese Einteilung nicht haltbar ist.
Die interne Systematik der Flughunde ist noch immer umstritten und Gegenstand zahlreicher Untersuchungen. Die folgende Einteilung in Gattungsgruppen basiert weitgehend auf der phylogenetischen Untersuchung von Kate E. Jones u. a.: A Phylogenetic Supertree of Bats.[4] Die Autoren verwenden für die Taxa keinen Rang im klassischen Sinn. Die Bezeichnung aller acht Gruppen als Tribus mit der Endung -ini (hier und in den verlinkten Artikeln) ist daher willkürlich gewählt. Manchmal findet man einzelne Gruppen auch im Rang einer Unterfamilie (-inae) oder einer Subtribus (-ina).
Die Entwicklungsgeschichte der Flughunde kann in folgendem Diagramm zusammengefasst werden:
Flughunde (Pteropodidae) N.N. N.N.Rosettenflughunde (Rousettini)
Epaulettenflughunde (Epomophorini)
Spitzzahnflughunde (Harpyionycterini)
Nacktrückenflughunde (Dobsoniini)
Eigentliche Flughunde (Pteropodini)
Röhrennasenflughunde (Nyctimenini)
Kurznasenflughunde (Cynopterini)
Die Flughunde (Pteropodidae) sind eine Säugetierfamilie aus der Ordnung der Fledertiere (Chiroptera). Sie sind die einzige Familie der Überfamilie Pteropodoidea und bilden zusammen mit den Hufeisennasenartigen (Rhinolophoidea) die Unterordnung Yinpterochiroptera. Die Familie umfasst rund 40 Gattungen mit knapp 200 Arten.
Kalong iku anggota bangsa lawa (Chiroptera) sing kagolong sajeroning familia Pteropodidae, siji-sijiné familia anggota subordo Megachiroptera. Tembaung "kalong" kerep dipigunakake kanggo ngganti tembung lawa sajeroning pacelathon sadina-dina, sanadyan kanthi ilmiah bab iki ora trep, amarga ora kabèh lawa iku kalong. Kalong iku kéwan hèrbivor, lan mung mangan woh-wohan utawa ngisep nektar saka kembang.
Letipsi obuhvataju podred Megachiroptera i jedinu porodicu Pteropodidae iz reda Chiroptera (šišmiši). Također se se označavaju i kao voćnim šišmiši ili šišmiši Starog svijeta, naročito rodovi Acerodon i Pteropus (leteće lisice).
Voćni šišmiši su ograničeni na Stari svijet, u tropskim i suptropskim područjima, u rasponu od istočnog Sredozemlja do ijužne Azije, a nema ih na sjeverozapadu Afrike i jugozapadnoj Australiji . U usporedbi s bubojednim šišmišma, voćni šišmiši su relativno velike i, uz neke iznimke, ne kreću se pomoću eholokacije. Oni su biljojedi, a za pronalaženje hrane, oslanjaju se na osjetljiva čula vida i mirisa.[1]
Većina voćnih šišmiša p su veće od bubojednih šišmiša ili Microchiroptera, ali također postoji i veliki broj malih voćnih šišmiša. Predstavnici najmanje vrste j su dugi oko 6 cm, a time i manji od nekih Microchiroptera, naprimjer, maurisijskog grobarskog šišmiša . Najveći doseže raspon krila od 1,7 m i težinu do 1,6 kg .Većina voćnih šišmiši imaju velike oči, dopuštajući im da se orijentiraju vizualno u sumrak i unutar špilje i šume. Njihov osjećaj za miris je odličan. Za razliku od , voće šišmalih šišmiša, ne koriste eholoukaciju (uz jednu iznimku, a to je je egipatski voćni šišmiš Rousettus egyptiacus, koji koristi piskav zvuk za navigaciju u spiljama).
Tjelesna građa svih šišmiša uglavnom ima sličan plan. Letnu kožicu se zateže produženim drugim do petim prstom doseže do gležnjeva. Međutim, većina ovih šišmiša uopće nema rep ili je veoma kratak (izuzetak su dugorepi šišmiši roda Notopteris). Repna letna kožica im je u vidu samo uske pruge duž unutrašnje strane zadnjih nogu. Od Microchiroptera (sitni šišmiši) razlikuju se po kandži koja se kod većine letipasa nalazi na vrhu drugog prsta, koju sitni šišmiši nemaju.[2][3][4][5]
Letipsi čine jedinu porodica (Pteropodidae) Chiroptera koja nije sposobna larinksa ispuštati zvuke za eholocinanje (na osnovu prijema odbijenog zvuka od tvrdog objekta). Eholokacija i let su evoluirali u ranim lozama šišmiša, ali se kasnije izgubila u porodici Pteropodidae. Šišmiši u rodu Rousettussu sposobni za primitivnu ehololokaciju klikovima pomoću jezika, a neke vrste su pokazale da stvaraju klikove slične onima eholokating šišmiša pomoću krila.[6][7][8][9]
I eholokacija i let su energetski skupi postupci za šišmiše. Priroda leta i eholokacijski mehanizam šišmiša omogućuje stvaranje eholokacijskih impulsa s minimalnim utroškom energije. Za energetska spajanje tih dvaju procesa se mislio da dopuštaju da se kod ovih šišmiša tazviju energetski skupi postupci leta. Gubitak eholokacije može biti i zbog odvajanja od bježanja i eholokacije letipasa. Povećana prosječna veličina tijela odnosu na ehholocirajuće šišmiše, sugerira da je veća veličina tijela ometa let pomoću eholokacije.
Letipsi su aktivni pretežno u sumrak i noću. U potrazi za hranom prelaze velike udaljenosti, a danju spavaju viseći glavom prema dolje. Za razliku od sitnih šišmiša, često ih se sreću na stablima na izloženim mjestima.[10]
U odnosu na Microchyroptera snalaženja u okolišu uznemaju sposobnost orijenracije pomoću ultrazvuka (izuzetak su rozetni velešišmiši (Rousettini), tj eholokacije. Vid im je relativno dobro a njuh i izvanredan. Ne padaju zimski san jer žive u toplim klimatima. Predstavnici krupnijih vrsta često žive u velikim grupama, u velikom kolonijama u kojima bude i do 500.000 jedinki s vrlo kompleksnim društvenim ponašanjem, dok su manje vrste uglavnom samotnjaci.
Unatoč tjelesnoj veličini, letipsi su potpuno bezopasni. Hrane se isključivo biljnom hranom, nektarom, polenom, voćem i cvjetovima. Čitav niz vrsta imaju izniman zčaj za biljni svijet, nakon konzumiranja plodova, raznose sjemenke voćki, a ze neke biljke su isključivi polinatori (oprašivači). To znači, da bi njihov nestanak istovremeno značio i nestanak vezanih vrsta biljaka.
Čak se i spolni odnos se kod letipasa odvija glavom prema dolje. Ženke, jednom godišnje, uglavnom kote po jedno mladunče. Skotne se odvajaju od mužjaka u skupine u kojima podižu podmladak. Veliki šišmiši su relativno dugovječni, a dožive i do 30 godina.
Šišmiši Starog svijeta žive u tropskim i suptropskim područjima Afrike (uključujući Madagaskar), južnoj Aziji, Australiji i zapadnoj Okeaniji. Nema ih u Europi, s izuzetkom egipatskog voćnog šišmiša (Rousettus aegyptiacus) na Kipru, ako se u ovom smislu Kipar može smatrati Europom.[11][12][13][14][15][16][17][18][19][20][21][22][23]
Veliki broj vrsta velikih šišmiša se uključuju u ugrožene. Glavni razlog je uništavanje njihovog okoliša, koje nastaje krčenjem šuma. Pored toga, mnoge malootočne vrste su endemske, pa su osobito osjetljive na smetnje u svom obitavalištu. Neke se smatraju štetočinama jer se hrane voćem s plantaža ili ih love radi mesa. Prema kriterijima Međunarodne unije za zaštitu prirode i prirodnih resursa (IUCN): International Union for Conservation of Nature and Natural Resources), osam vrsta je izumrlo, a još 22 se smatraju ugroženim ili jako ugroženim.
Dugo su nnogi naučnici vodili sporove oko toga, da li su sitni šišmiši i veliki šišmiši monofilijske grupe, što znači da li su se razvili od zajedničkih predaka, ili su primjer konvergentne evolucije. Danas preteže mišljenje da su monofilijske linije evolucije.
Tradicijski se letipsi dijele na dvije potporodice: prave (Pteropodinae) i grupu manjih životinja koje su obilježene dugačkim jezicim i pretežnom ishranom nektarom. Nazvani su velikim šišmišima dugog jezika (potporodica Macroglossinae). Novija istraživanja su pokazala, da takva podjela nije ispravna.[24]. Grupe su prilično proizvoljno svrstane i ne treba ih smatrati općeprihvaćenim naučnim stavom.
Naprimjer, tokom 1980-ih i 1990-ih, neki istraživači su predložili (prvenstveno na temelju vizuelne sličnosti) da su Megachiroptera zapravo u većoj mjeri povezani s primatima nego redom Microchiroptera, s dvije skupine šišmiša, dakle, koje su razviile let putem konvergencije. Međutim, nedavni priliv genetičkih studija više potvrđuje dugogodišnju tvrdnju da su svi šišmiši zaista članovi iste grane, Chiropštera. Druge studije su nedavno predložile da neke porodice Microchiroptera (možda i potkovočast šišmiši, mišorepi šišmiši i lažni vampiri) su pokazale da su evolucijski bliži voćnim šišmišima nego drugim pripadnicima reda Microhiroptera.[25][26]
Porodica Pteropodidae je podijeljena u sedam potporodica, sa 186 ukupnih sačuvanih vrsta, koje zastupa 44-46 rodova.
Letipsi obuhvataju podred Megachiroptera i jedinu porodicu Pteropodidae iz reda Chiroptera (šišmiši). Također se se označavaju i kao voćnim šišmiši ili šišmiši Starog svijeta, naročito rodovi Acerodon i Pteropus (leteće lisice).
Voćni šišmiši su ograničeni na Stari svijet, u tropskim i suptropskim područjima, u rasponu od istočnog Sredozemlja do ijužne Azije, a nema ih na sjeverozapadu Afrike i jugozapadnoj Australiji . U usporedbi s bubojednim šišmišma, voćni šišmiši su relativno velike i, uz neke iznimke, ne kreću se pomoću eholokacije. Oni su biljojedi, a za pronalaženje hrane, oslanjaju se na osjetljiva čula vida i mirisa.
Popo-matunda ni aina za popo wanaokula matunda hasa. Kibiolojia ni mamalia wa familia Pteropodidae, familia pekee ya nusuoda Megachiroptera katika oda Chiroptera, wanaofanana na panya au mbwa mdogo mwenye mabawa. Kwa kawaida spishi hizi ni kubwa kuliko zile za nusuoda Microchiroptera (popo-wadudu) lakini kuna spishi zilizo ndogo kulika spishi fulani za popo-wadudu. Yumkini spishi kubwa kabisa ni popo-bweha wa Uhindi aliye na uzito wa kg 1.6, urefu wa mwili wa sm 40 na urefu wa mabawa wa hadi m 1.5. Mabawa ya popo-bweha mkubwa yana urefu wa hadi m 1.6. Spishi ndogo kabisa ni popo-matunda mabawa-madoa aliye na uzito wa g 15 na urefu wa mwili wa sm 5-6. Popo-matunda hula matunda au mbochi. Wale wanaokula matunda husambaza spishi za miti na wale wanaokula mbochi huchavusha maua. Kama popo wote hata popo-matunda hukiakia usiko na hulala mchana. Wakilala wananing'inia juu chini na kujifunika kwa mabawa. Takriban spishi zote hulala mitini, lakini spishi kadhaa hulala ndani ya mapango.
Popo-matunda ni aina za popo wanaokula matunda hasa. Kibiolojia ni mamalia wa familia Pteropodidae, familia pekee ya nusuoda Megachiroptera katika oda Chiroptera, wanaofanana na panya au mbwa mdogo mwenye mabawa. Kwa kawaida spishi hizi ni kubwa kuliko zile za nusuoda Microchiroptera (popo-wadudu) lakini kuna spishi zilizo ndogo kulika spishi fulani za popo-wadudu. Yumkini spishi kubwa kabisa ni popo-bweha wa Uhindi aliye na uzito wa kg 1.6, urefu wa mwili wa sm 40 na urefu wa mabawa wa hadi m 1.5. Mabawa ya popo-bweha mkubwa yana urefu wa hadi m 1.6. Spishi ndogo kabisa ni popo-matunda mabawa-madoa aliye na uzito wa g 15 na urefu wa mwili wa sm 5-6. Popo-matunda hula matunda au mbochi. Wale wanaokula matunda husambaza spishi za miti na wale wanaokula mbochi huchavusha maua. Kama popo wote hata popo-matunda hukiakia usiko na hulala mchana. Wakilala wananing'inia juu chini na kujifunika kwa mabawa. Takriban spishi zote hulala mitini, lakini spishi kadhaa hulala ndani ya mapango.
Pteropodidae es un familia de Chiroptera.
Ang kalwang ay bumubuo sa subkurya ng Megachiroptera, at ang tanging pamilya nito na Pteropodidae ng order na Chiroptera (paniki). Ang mga ito ay tinatawag ding mga kalwang, o lalo na ang genera na Acerodon at Pteropus, na lumilipad na mga kalwang. Ang mga kalwang ay matatagpuan sa Amerika, Kanlurang Europa, hilagang-kanluran ng Aprika at timog-kanluran ng Australia.
This list is generated from data in Wikidata and is periodically updated by Listeriabot.
Edits made within the list area will be removed on the next update!
![]() Ang lathalaing ito ay isang usbong. Makatutulong ka sa Wikipedia sa nito.
Ang lathalaing ito ay isang usbong. Makatutulong ka sa Wikipedia sa nito.
La familha dels Pteropodidae amassa de ratapenadas generalament frugivòras. Aquesta familha foguèt creada per Gray en 1821.

Do Pteropodidae (Düütsk: Flughunde/Flederhunde "Flädderhuunde") sunt nai früünd mäd do Fläddermuuse, man jo hääbe (buute ju ägyptiske Oard Rousettus aegyptiacus) neen Echolot-Orientierenge. Dät rakt disse Dierte in Afrikoa, Suud-Asien, Australien, Wääst-Ozeanien un Zypern. Me kon do uk in n Zoo hoolde. Jo sunt ju eensichste Familie fon ju Unneroardenge Megachiroptera. In ju Fäksproake kwäd me deeruum, disse Unneroardenge is monotypisk.
Do Pteropodidae (Düütsk: Flughunde/Flederhunde "Flädderhuunde") sunt nai früünd mäd do Fläddermuuse, man jo hääbe (buute ju ägyptiske Oard Rousettus aegyptiacus) neen Echolot-Orientierenge. Dät rakt disse Dierte in Afrikoa, Suud-Asien, Australien, Wääst-Ozeanien un Zypern. Me kon do uk in n Zoo hoolde. Jo sunt ju eensichste Familie fon ju Unneroardenge Megachiroptera. In ju Fäksproake kwäd me deeruum, disse Unneroardenge is monotypisk.
Ang kalwang ay bumubuo sa subkurya ng Megachiroptera, at ang tanging pamilya nito na Pteropodidae ng order na Chiroptera (paniki). Ang mga ito ay tinatawag ding mga kalwang, o lalo na ang genera na Acerodon at Pteropus, na lumilipad na mga kalwang. Ang mga kalwang ay matatagpuan sa Amerika, Kanlurang Europa, hilagang-kanluran ng Aprika at timog-kanluran ng Australia.
La familha dels Pteropodidae amassa de ratapenadas generalament frugivòras. Aquesta familha foguèt creada per Gray en 1821.
Ӏимаьшкаш (эрс: Крыла́ны), Ӏимаьшка (эрс: Крыла́новые, лат: Pteropodidae) — дакхадийнатий дезал ба кулгаткъама (Chiroptera) тоабан Yinpterochiroptera яхача кIалтоаба юкъебоагIаш (хьалхагIа из дезал Megachiroptera яха къаьстта кIалтоаба санна белгалбоаккхар, амма хIанзарча молекулярно-генетическеи кариологическеи дараш бакъдец из).
Pteropodidae яхача дезало чулоац 170 совгIа кеп (40 ваьр).
КIалдезал Pteropodinae
КIалдезал Macroglossinae[2]
Подсемейство Cynopterinae
Подсемейство Eidolinae
Подсемейство Rousettinae (включая Epomophorinae)
Подсемейство Harpyionycterinae
Подсемейство Nyctimeninae
В конце 1980-х — начале 1990-х гг. было высказано предположение о том, что представители Megachiroptera и Microchiroptera выработали способность к машущему полету в результате конвергентной эволюции. Эта точка зрения, впрочем, не получила широкого распространения, позднейшие кариологические и молекулярно-генетические исследования также ни в коей мере ее не подтверждают.
Ӏимаьшкаш (эрс: Крыла́ны), Ӏимаьшка (эрс: Крыла́новые, лат: Pteropodidae) — дакхадийнатий дезал ба кулгаткъама (Chiroptera) тоабан Yinpterochiroptera яхача кIалтоаба юкъебоагIаш (хьалхагIа из дезал Megachiroptera яха къаьстта кIалтоаба санна белгалбоаккхар, амма хIанзарча молекулярно-генетическеи кариологическеи дараш бакъдец из).
Kaluang adalah angguta bangsa kalalawar (Chiroptera) nang tagulung dalam familia Pteropodidae, satu-satunya familia angguta subordo Megachiroptera. Kata "kaluang" rancak diguna'akan gasan manyambat kalalawar dalam pamandiran sahari-hari, walaupun sacara ilmiah hal ini kada sapanuhnya bujur, marga kada samunyaan kalalawar adalah kaluang. Kaluang adalah hérbivora, dan wastu mamakan buah-buahan atawa mahisap néktar matan kambang. Walaupun kaluang pada umumnya labih ganal daripada kalalawar, tagal kada samuanya samintu. Ada jua babarapa spésiés nang panjangnya wastu sakitar 6 séntimitir.
Kaluang baisi mata nang ganal sahingga walaupun kada salandap mata manusia, inya hingkat malihat kala sungsung atawa di dalam guha nang kadap. Indera nang sacara utama diguna'akan gasan navigasi adalah daya panciumannya nang landap. Inya kada mangandalakan diri pada daya pandangaran nangkaya halnya kalalawar, lawan kakacualian satu spésiés kaluang Mesir (Rousettus egyptiacus).
Walaupun kalalawar sacara umum kawa didapatakan di saluruh dunia, kaluang wastu didapatakan di dairah-dairah tropis di Asia, Aprika dan Oséania.
Suku Pteropodidae dibagi manjadi dua anak-suku (subfamilia) nang saluruhnya ba'angguta sakitar 188 spésiés, dalam 43 marga:
Suku PTEROPODIDAE
Kaluang adalah angguta bangsa kalalawar (Chiroptera) nang tagulung dalam familia Pteropodidae, satu-satunya familia angguta subordo Megachiroptera. Kata "kaluang" rancak diguna'akan gasan manyambat kalalawar dalam pamandiran sahari-hari, walaupun sacara ilmiah hal ini kada sapanuhnya bujur, marga kada samunyaan kalalawar adalah kaluang. Kaluang adalah hérbivora, dan wastu mamakan buah-buahan atawa mahisap néktar matan kambang. Walaupun kaluang pada umumnya labih ganal daripada kalalawar, tagal kada samuanya samintu. Ada jua babarapa spésiés nang panjangnya wastu sakitar 6 séntimitir.
Kaluang baisi mata nang ganal sahingga walaupun kada salandap mata manusia, inya hingkat malihat kala sungsung atawa di dalam guha nang kadap. Indera nang sacara utama diguna'akan gasan navigasi adalah daya panciumannya nang landap. Inya kada mangandalakan diri pada daya pandangaran nangkaya halnya kalalawar, lawan kakacualian satu spésiés kaluang Mesir (Rousettus egyptiacus).
Walaupun kalalawar sacara umum kawa didapatakan di saluruh dunia, kaluang wastu didapatakan di dairah-dairah tropis di Asia, Aprika dan Oséania.
Megabats constitute the family Pteropodidae of the order Chiroptera (bats). They are also called fruit bats, Old World fruit bats, or—especially the genera Acerodon and Pteropus—flying foxes. They are the only member of the superfamily Pteropodoidea, which is one of two superfamilies in the suborder Yinpterochiroptera. Internal divisions of Pteropodidae have varied since subfamilies were first proposed in 1917. From three subfamilies in the 1917 classification, six are now recognized, along with various tribes. As of 2018, 197 species of megabat had been described.
The leading theory of the evolution of megabats has been determined primarily by genetic data, as the fossil record for this family is the most fragmented of all bats. They likely evolved in Australasia, with the common ancestor of all living pteropodids existing approximately 31 million years ago. Many of their lineages probably originated in Melanesia, then dispersed over time to mainland Asia, the Mediterranean, and Africa. Today, they are found in tropical and subtropical areas of Eurasia, Africa, and Oceania.
The megabat family contains the largest bat species, with individuals of some species weighing up to 1.45 kg (3.2 lb) and having wingspans up to 1.7 m (5.6 ft). Not all megabats are large-bodied; nearly a third of all species weigh less than 50 g (1.8 oz). They can be differentiated from other bats due to their dog-like faces, clawed second digits, and reduced uropatagium. Only members of one genus, Notopteris, have tails. Megabats have several adaptations for flight, including rapid oxygen consumption, the ability to sustain heart rates of more than 700 beats per minute, and large lung volumes.
Most megabats are nocturnal or crepuscular, although a few species are active during the daytime. During the period of inactivity, they roost in trees or caves. Members of some species roost alone, while others form colonies of up to a million individuals. During the period of activity, they use flight to travel to food resources. With few exceptions, they are unable to echolocate, relying instead on keen senses of sight and smell to navigate and locate food. Most species are primarily frugivorous and several are nectarivorous. Other less common food resources include leaves, pollen, twigs, and bark.
They reach sexual maturity slowly and have a low reproductive output. Most species have one offspring at a time after a pregnancy of four to six months. This low reproductive output means that after a population loss their numbers are slow to rebound. A quarter of all species are listed as threatened, mainly due to habitat destruction and overhunting. Megabats are a popular food source in some areas, leading to population declines and extinction. They are also of interest to those involved in public health as they are natural reservoirs of several viruses that can affect humans.
Epomophorini
Internal relationships of African Pteropodidae based on combined evidence of mitochondrial and nuclear DNA. One species each of Pteropodinae, Nyctimeninae, and Cynopterinae, which are not found in Africa, were included as outgroups.[2]The family Pteropodidae was first described in 1821 by British zoologist John Edward Gray. He named the family "Pteropidae" (after the genus Pteropus) and placed it within the now-defunct order Fructivorae.[3] Fructivorae contained one other family, the now-defunct Cephalotidae, containing one genus, Cephalotes[3] (now recognized as a synonym of Dobsonia).[4] Gray's spelling was possibly based on a misunderstanding of the suffix of "Pteropus".[5] "Pteropus" comes from Ancient Greek "pterón" meaning "wing" and "poús" meaning "foot".[6] The Greek word pous of Pteropus is from the stem word pod-; therefore, Latinizing Pteropus correctly results in the prefix "Pteropod-".[7]: 230 French biologist Charles Lucien Bonaparte was the first to use the corrected spelling Pteropodidae in 1838.[7]: 230
In 1875, the zoologist George Edward Dobson was the first to split the order Chiroptera (bats) into two suborders: Megachiroptera (sometimes listed as Macrochiroptera) and Microchiroptera, which are commonly abbreviated to megabats and microbats.[8] Dobson selected these names to allude to the body size differences of the two groups, with many fruit-eating bats being larger than insect-eating bats. Pteropodidae was the only family he included within Megachiroptera.[5][8]
A 2001 study found that the dichotomy of megabats and microbats did not accurately reflect their evolutionary relationships. Instead of Megachiroptera and Microchiroptera, the study's authors proposed the new suborders Yinpterochiroptera and Yangochiroptera.[9] This classification scheme has been verified several times subsequently and remains widely supported as of 2019.[10][11][12][13] Since 2005, this suborder has alternatively been called "Pteropodiformes".[7]: 520–521 Yinpterochiroptera contained species formerly included in Megachiroptera (all of Pteropodidae), as well as several families formerly included in Microchiroptera: Megadermatidae, Rhinolophidae, Nycteridae, Craseonycteridae, and Rhinopomatidae.[9] Two superfamilies comprise Yinpterochiroptera: Rhinolophoidea—containing the above families formerly in Microchiroptera—and Pteropodoidea, which only contains Pteropodidae.[14]
In 1917, Danish mammalogist Knud Andersen divided Pteropodidae into three subfamilies: Macroglossinae, Pteropinae (corrected to Pteropodinae), and Harpyionycterinae.[15]: 496 A 1995 study found that Macroglossinae as previously defined, containing the genera Eonycteris, Notopteris, Macroglossus, Syconycteris, Melonycteris, and Megaloglossus, was paraphyletic, meaning that the subfamily did not group all the descendants of a common ancestor.[16]: 214 Subsequent publications consider Macroglossini as a tribe within Pteropodinae that contains only Macroglossus and Syconycteris.[17][18] Eonycteris and Melonycteris are within other tribes in Pteropodinae,[2][18] Megaloglossus was placed in the tribe Myonycterini of the subfamily Rousettinae, and Notopteris is of uncertain placement.[18]
Other subfamilies and tribes within Pteropodidae have also undergone changes since Andersen's 1917 publication.[18] In 1997, the pteropodids were classified into six subfamilies and nine tribes based on their morphology, or physical characteristics.[18] A 2011 genetic study concluded that some of these subfamilies were paraphyletic and therefore they did not accurately depict the relationships among megabat species. Three of the subfamilies proposed in 1997 based on morphology received support: Cynopterinae, Harpyionycterinae, and Nyctimeninae. The other three clades recovered in this study consisted of Macroglossini, Epomophorinae + Rousettini, and Pteropodini + Melonycteris.[18] A 2016 genetic study focused only on African pteropodids (Harpyionycterinae, Rousettinae, and Epomophorinae) also challenged the 1997 classification. All species formerly included in Epomophorinae were moved to Rousettinae, which was subdivided into additional tribes. The genus Eidolon, formerly in the tribe Rousettini of Rousettinae, was moved to its own subfamily, Eidolinae.[2]
In 1984, an additional pteropodid subfamily, Propottininae, was proposed, representing one extinct species described from a fossil discovered in Africa, Propotto leakeyi.[19] In 2018 the fossils were reexamined and determined to represent a lemur.[20] As of 2018, there were 197 described species of megabat,[21] around a third of which are flying foxes of the genus Pteropus.[22]
The fossil record for pteropodid bats is the most incomplete of any bat family. Although the poor skeletal record of Chiroptera is probably from how fragile bat skeletons are, Pteropodidae still have the most incomplete despite generally having the biggest and most sturdy skeletons. It is also surprising that Pteropodidae are the least represented because they were the first major group to diverge.[23] Several factors could explain why so few pteropodid fossils have been discovered: tropical regions where their fossils might be found are under-sampled relative to Europe and North America; conditions for fossilization are poor in the tropics, which could lead to fewer fossils overall; and even when fossils are formed, they may be destroyed by subsequent geological activity.[24] It is estimated that more than 98% of pteropodid fossil history is missing.[25] Even without fossils, the age and divergence times of the family can still be estimated by using computational phylogenetics. Pteropodidae split from the superfamily Rhinolophoidea (which contains all the other families of the suborder Yinpterochiroptera) approximately 58 Mya (million years ago).[25] The ancestor of the crown group of Pteropodidae, or all living species, lived approximately 31 Mya.[26]
The family Pteropodidae likely originated in Australasia based on biogeographic reconstructions.[2] Other biogeographic analyses have suggested that the Melanesian Islands, including New Guinea, are a plausible candidate for the origin of most megabat subfamilies, with the exception of Cynopterinae;[18] the cynopterines likely originated on the Sunda Shelf based on results of a Weighted Ancestral Area Analysis of six nuclear and mitochondrial genes.[26] From these regions, pteropodids colonized other areas, including continental Asia and Africa. Megabats reached Africa in at least four distinct events. The four proposed events are represented by (1) Scotonycteris, (2) Rousettus, (3) Scotonycterini, and (4) the "endemic Africa clade", which includes Stenonycterini, Plerotini, Myonycterini, and Epomophorini, according to a 2016 study. It is unknown when megabats reached Africa, but several tribes (Scotonycterini, Stenonycterini, Plerotini, Myonycterini, and Epomophorini) were present by the Late Miocene. How megabats reached Africa is also unknown. It has been proposed that they could have arrived via the Middle East before it became more arid at the end of the Miocene. Conversely, they could have reached the continent via the Gomphotherium land bridge, which connected Africa and the Arabian Peninsula to Eurasia. The genus Pteropus (flying foxes), which is not found on mainland Africa, is proposed to have dispersed from Melanesia via island hopping across the Indian Ocean;[27] this is less likely for other megabat genera, which have smaller body sizes and thus have more limited flight capabilities.[2]
Megabats are the only family of bats incapable of laryngeal echolocation. It is unclear whether the common ancestor of all bats was capable of echolocation, and thus echolocation was lost in the megabat lineage, or multiple bat lineages independently evolved the ability to echolocate (the superfamily Rhinolophoidea and the suborder Yangochiroptera). This unknown element of bat evolution has been called a "grand challenge in biology".[28] A 2017 study of bat ontogeny (embryonic development) found evidence that megabat embryos at first have large, developed cochlea similar to echolocating microbats, though at birth they have small cochlea similar to non-echolocating mammals. This evidence supports that laryngeal echolocation evolved once among bats, and was lost in pteropodids, rather than evolving twice independently.[29] Megabats in the genus Rousettus are capable of primitive echolocation through clicking their tongues.[30] Some species—the cave nectar bat (Eonycteris spelaea), lesser short-nosed fruit bat (Cynopterus brachyotis), and the long-tongued fruit bat (Macroglossus sobrinus)— have been shown to create clicks similar to those of echolocating bats using their wings.[31]
Both echolocation and flight are energetically expensive processes.[32] Echolocating bats couple sound production with the mechanisms engaged for flight, allowing them to reduce the additional energy burden of echolocation. Instead of pressurizing a bolus of air for the production of sound, laryngeally echolocating bats likely use the force of the downbeat of their wings to pressurize the air, cutting energetic costs by synchronizing wingbeats and echolocation.[33] The loss of echolocation (or conversely, the lack of its evolution) may be due to the uncoupling of flight and echolocation in megabats.[34] The larger average body size of megabats compared to echolocating bats[35] suggests a larger body size disrupts the flight-echolocation coupling and made echolocation too energetically expensive to be conserved in megabats.[34]




The family Pteropodidae is divided into six subfamilies represented by 46 genera:[2][18]
Family Pteropodidae

Megabats are so called for their larger weight and size; the largest, the great flying fox (Pteropus neohibernicus) weighs up to 1.6 kg (3.5 lb);[38] some members of Acerodon and Pteropus have wingspans reaching up to 1.7 m (5.6 ft).[39]: 48 Despite the fact that body size was a defining characteristic that Dobson used to separate microbats and megabats, not all species of megabat are larger than microbats; the spotted-winged fruit bat (Balionycteris maculata), a megabat, weighs only 14.2 g (0.50 oz).[35] The flying foxes of Pteropus and Acerodon are often taken as exemplars of the whole family in terms of body size. In reality, these genera are outliers, creating a misconception of the true size of most megabat species.[5] A 2004 review stated that 28% of megabat species weigh less than 50 g (1.8 oz).[35]
Megabats can be distinguished from microbats in appearance by their dog-like faces, by the presence of claws on the second digit (see Megabat#Postcrania), and by their simple ears.[40] The simple appearance of the ear is due in part to the lack of tragi (cartilage flaps projecting in front of the ear canal), which are found in many microbat species. Megabats of the genus Nyctimene appear less dog-like, with shorter faces and tubular nostrils.[41] A 2011 study of 167 megabat species found that while the majority (63%) have fur that is a uniform color, other patterns are seen in this family. These include countershading in four percent of species, a neck band or mantle in five percent of species, stripes in ten percent of species, and spots in nineteen percent of species.[42]
Unlike microbats, megabats have a greatly reduced uropatagium, which is an expanse of flight membrane that runs between the hind limbs.[43] Additionally, the tail is absent or greatly reduced,[41] with the exception of Notopteris species, which have a long tail.[44] Most megabat wings insert laterally (attach to the body directly at the sides). In Dobsonia species, the wings attach nearer the spine, giving them the common name of "bare-backed" or "naked-backed" fruit bats.[43]

Megabats have large orbits, which are bordered by well-developed postorbital processes posteriorly. The postorbital processes sometimes join to form the postorbital bar. The snout is simple in appearance and not highly modified, as is seen in other bat families.[45] The length of the snout varies among genera. The premaxilla is well-developed and usually free,[4] meaning that it is not fused with the maxilla; instead, it articulates with the maxilla via ligaments, making it freely movable.[46][47] The premaxilla always lack a palatal branch.[4] In species with a longer snout, the skull is usually arched. In genera with shorter faces (Penthetor, Nyctimene, Dobsonia, and Myonycteris), the skull has little to no bending.[48]
The number of teeth varies among megabat species; totals for various species range from 24 to 34. All megabats have two or four each of upper and lower incisors, with the exception Bulmer's fruit bat (Aproteles bulmerae), which completely lacks incisors,[49] and the São Tomé collared fruit bat (Myonycteris brachycephala), which has two upper and three lower incisors.[50] This makes it the only mammal species with an asymmetrical dental formula.[50]
All species have two upper and lower canine teeth. The number of premolars is variable, with four or six each of upper and lower premolars. The first upper and lower molars are always present, meaning that all megabats have at least four molars. The remaining molars may be present, present but reduced, or absent.[49] Megabat molars and premolars are simplified, with a reduction in the cusps and ridges resulting in a more flattened crown.[51]
Like most mammals, megabats are diphyodont, meaning that the young have a set of deciduous teeth (milk teeth) that falls out and is replaced by permanent teeth. For most species, there are 20 deciduous teeth. As is typical for mammals,[52] the deciduous set does not include molars.[51]
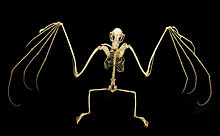
The scapulae (shoulder blades) of megabats have been described as the most primitive of any chiropteran family.[51] The shoulder is overall of simple construction, but has some specialized features. The primitive insertion of the omohyoid muscle from the clavicle (collarbone) to the scapula is laterally displaced (more towards the side of the body)—a feature also seen in the Phyllostomidae. The shoulder also has a well-developed system of muscular slips (narrow bands of muscle that augment larger muscles) that anchor the tendon of the occipitopollicalis muscle (muscle in bats that runs from base of neck to the base of the thumb)[43] to the skin.[41]
While microbats only have claws on the thumbs of their forelimbs, most megabats have a clawed second digit as well;[51] only Eonycteris, Dobsonia, Notopteris, and Neopteryx lack the second claw.[53] The first digit is the shortest, while the third digit is the longest. The second digit is incapable of flexion.[51] Megabats' thumbs are longer relative to their forelimbs than those of microbats.[43]
Megabats' hindlimbs have the same skeletal components as humans. Most megabat species have an additional structure called the calcar, a cartilage spur arising from the calcaneus.[54] Some authors alternately refer to this structure as the uropatagial spur to differentiate it from microbats' calcars, which are structured differently. The structure exists to stabilize the uropatagium, allowing bats to adjust the camber of the membrane during flight. Megabats lacking the calcar or spur include Notopteris, Syconycteris, and Harpyionycteris.[55] The entire leg is rotated at the hip compared to normal mammal orientation, meaning that the knees face posteriorly. All five digits of the foot flex in the direction of the sagittal plane, with no digit capable of flexing in the opposite direction, as in the feet of perching birds.[54]
Flight is very energetically expensive, requiring several adaptations to the cardiovascular system. During flight, bats can raise their oxygen consumption by twenty times or more for sustained periods; human athletes can achieve an increase of a factor of twenty for a few minutes at most.[56] A 1994 study of the straw-coloured fruit bat (Eidolon helvum) and hammer-headed bat (Hypsignathus monstrosus) found a mean respiratory exchange ratio (carbon dioxide produced:oxygen used) of approximately 0.78. Among these two species, the gray-headed flying fox (Pteropus poliocephalus) and the Egyptian fruit bat (Rousettus aegyptiacus), maximum heart rates in flight varied between 476 beats per minute (gray-headed flying fox) and 728 beats per minute (Egyptian fruit bat). The maximum number of breaths per minute ranged from 163 (gray-headed flying fox) to 316 (straw-colored fruit bat).[57] Additionally, megabats have exceptionally large lung volumes relative to their sizes. While terrestrial mammals such as shrews have a lung volume of 0.03 cm3 per gram of body weight (0.05 in3 per ounce of body weight), species such as the Wahlberg's epauletted fruit bat (Epomophorus wahlbergi) have lung volumes 4.3 times greater at 0.13 cm3 per gram (0.22 in3 per ounce).[56]
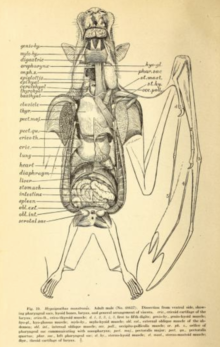
Megabats have rapid digestive systems, with a gut transit time of half an hour or less.[41] The digestive system is structured to a herbivorous diet sometimes restricted to soft fruit or nectar.[58] The length of the digestive system is short for a herbivore (as well as shorter than those of insectivorous microchiropterans),[58] as the fibrous content is mostly separated by the action of the palate, tongue, and teeth, and then discarded.[58] Many megabats have U-shaped stomachs. There is no distinct difference between the small and large intestine, nor a distinct beginning of the rectum. They have very high densities of intestinal microvilli, which creates a large surface area for the absorption of nutrients.[59]
Like all bats, megabats have much smaller genomes than other mammals. A 2009 study of 43 megabat species found that their genomes ranged from 1.86 picograms (pg, 978 Mbp per pg) in the straw-colored fruit bat to 2.51 pg in Lyle's flying fox (Pteropus lylei). All values were much lower than the mammalian average of 3.5 pg. Megabats have even smaller genomes than microbats, with a mean weight of 2.20 pg compared to 2.58 pg. It was speculated that this difference could be related to the fact that the megabat lineage has experienced an extinction of the LINE1—a type of long interspersed nuclear element. LINE1 constitutes 15–20% of the human genome and is considered the most prevalent long interspersed nuclear element among mammals.[60]

With very few exceptions, megabats do not echolocate, and therefore rely on sight and smell to navigate.[61] They have large eyes positioned at the front of their heads.[62] These are larger than those of the common ancestor of all bats, with one study suggesting a trend of increasing eye size among pteropodids. A study that examined the eyes of 18 megabat species determined that the common blossom bat (Syconycteris australis) had the smallest eyes at a diameter of 5.03 mm (0.198 in), while the largest eyes were those of large flying fox (Pteropus vampyrus) at 12.34 mm (0.486 in) in diameter.[63] Megabat irises are usually brown, but they can be red or orange, as in Desmalopex, Mirimiri, Pteralopex, and some Pteropus.[64]
At high brightness levels, megabat visual acuity is poorer than that of humans; at low brightness it is superior.[62] One study that examined the eyes of some Rousettus, Epomophorus, Eidolon, and Pteropus species determined that the first three genera possess a tapetum lucidum, a reflective structure in the eyes that improves vision at low light levels, while the Pteropus species do not.[61] All species examined had retinae with both rod cells and cone cells, but only the Pteropus species had S-cones, which detect the shortest wavelengths of light; because the spectral tuning of the opsins was not discernible, it is unclear whether the S-cones of Pteropus species detect blue or ultraviolet light. Pteropus bats are dichromatic, possessing two kinds of cone cells. The other three genera, with their lack of S-cones, are monochromatic, unable to see color. All genera had very high densities of rod cells, resulting in high sensitivity to light, which corresponds with their nocturnal activity patterns. In Pteropus and Rousettus, measured rod cell densities were 350,000–800,000 per square millimeter, equal to or exceeding other nocturnal or crepuscular animals such as the house mouse, domestic cat, and domestic rabbit.[61]

Megabats use smell to find food sources like fruit and nectar.[65] They have keen senses of smell that rival that of the domestic dog.[66] Tube-nosed fruit bats such as the eastern tube-nosed bat (Nyctimene robinsoni) have stereo olfaction, meaning they are able to map and follow odor plumes three-dimensionally.[66] Along with most (or perhaps all) other bat species, megabats mothers and offspring also use scent to recognize each other, as well as for recognition of individuals.[65] In flying foxes, males have enlarged androgen-sensitive sebaceous glands on their shoulders they use for scent-marking their territories, particularly during the mating season. The secretions of these glands vary by species—of the 65 chemical compounds isolated from the glands of four species, no compound was found in all species.[67] Males also engage in urine washing, or coating themselves in their own urine.[67][68]
Megabats possess the TAS1R2 gene, meaning they have the ability to detect sweetness in foods. This gene is present among all bats except vampire bats. Like all other bats, megabats cannot taste umami, due to the absence of the TAS1R1 gene. Among other mammals, only giant pandas have been shown to lack this gene.[65] Megabats also have multiple TAS2R genes, indicating that they can taste bitterness.[69]

Megabats, like all bats, are long-lived relative to their size for mammals. Some captive megabats have had lifespans exceeding thirty years.[53] Relative to their sizes, megabats have low reproductive outputs and delayed sexual maturity, with females of most species not giving birth until the age of one or two.[70]: 6 Some megabats appear to be able to breed throughout the year, but the majority of species are likely seasonal breeders.[53] Mating occurs at the roost.[71] Gestation length is variable,[72] but is four to six months in most species. Different species of megabats have reproductive adaptations that lengthen the period between copulation and giving birth. Some species such as the straw-colored fruit bat have the reproductive adaptation of delayed implantation, meaning that copulation occurs in June or July, but the zygote does not implant into the uterine wall until months later in November.[70]: 6 The Fischer's pygmy fruit bat (Haplonycteris fischeri), with the adaptation of post-implantation delay, has the longest gestation length of any bat species, at up to 11.5 months.[72] The post-implantation delay means that development of the embryo is suspended for up to eight months after implantation in the uterine wall, which is responsible for its very long pregnancies.[70]: 6 Shorter gestation lengths are found in the greater short-nosed fruit bat (Cynopterus sphinx) with a period of three months.[73]
The litter size of all megabats is usually one.[70]: 6 There are scarce records of twins in the following species: Madagascan flying fox (Pteropus rufus), Dobson's epauletted fruit bat (Epomops dobsoni), the gray-headed flying fox, the black flying fox (Pteropus alecto), the spectacled flying fox (Pteropus conspicillatus),[74] the greater short-nosed fruit bat,[75] Peters's epauletted fruit bat (Epomophorus crypturus), the hammer-headed bat, the straw-colored fruit bat, the little collared fruit bat (Myonycteris torquata), the Egyptian fruit bat, and Leschenault's rousette (Rousettus leschenaultii).[76]: 85–87 In the cases of twins, it is rare that both offspring survive.[74] Because megabats, like all bats, have low reproductive rates, their populations are slow to recover from declines.[77]
At birth, megabat offspring are, on average, 17.5% of their mother's post-partum weight. This is the smallest offspring-to-mother ratio for any bat family; across all bats, newborns are 22.3% of their mother's post-partum weight. Megabat offspring are not easily categorized into the traditional categories of altricial (helpless at birth) or precocial (capable at birth). Species such as the greater short-nosed fruit bat are born with their eyes open (a sign of precocial offspring), whereas the Egyptian fruit bat offspring's eyes do not open until nine days after birth (a sign of altricial offspring).[78]
As with nearly all bat species, males do not assist females in parental care.[79] The young stay with their mothers until they are weaned; how long weaning takes varies throughout the family. Megabats, like all bats, have relatively long nursing periods: offspring will nurse until they are approximately 71% of adult body mass, compared to 40% of adult body mass in non-bat mammals.[80] Species in the genus Micropteropus wean their young by seven to eight weeks of age, whereas the Indian flying fox (Pteropus medius) does not wean its young until five months of age.[76] Very unusually, male individuals of two megabat species, the Bismarck masked flying fox (Pteropus capistratus) and the Dayak fruit bat (Dyacopterus spadiceus), have been observed producing milk, but there has never been an observation of a male nursing young.[81] It is unclear if the lactation is functional and males actually nurse pups or if it is a result of stress or malnutrition.[82]
Many megabat species are highly gregarious or social. Megabats will vocalize to communicate with each other, creating noises described as "trill-like bursts of sound",[83] honking,[84] or loud, bleat-like calls[85] in various genera. At least one species, the Egyptian fruit bat, is capable of a kind of vocal learning called vocal production learning, defined as "the ability to modify vocalizations in response to interactions with conspecifics".[86][87] Young Egyptian fruit bats are capable of acquiring a dialect by listening to their mothers, as well as other individuals in their colonies. It has been postulated that these dialect differences may result in individuals of different colonies communicating at different frequencies, for instance.[88][89]
Megabat social behavior includes using sexual behaviors for more than just reproduction. Evidence suggests that female Egyptian fruit bats take food from males in exchange for sex. Paternity tests confirmed that the males from which each female scrounged food had a greater likelihood of fathering the scrounging female's offspring.[90] Homosexual fellatio has been observed in at least one species, the Bonin flying fox (Pteropus pselaphon).[91][92] This same-sex fellatio is hypothesized to encourage colony formation of otherwise-antagonistic males in colder climates.[91][92]
Megabats are mostly nocturnal and crepuscular, though some have been observed flying during the day.[39] A few island species and subspecies are diurnal, hypothesized as a response to a lack of predators. Diurnal taxa include a subspecies of the black-eared flying fox (Pteropus melanotus natalis), the Mauritian flying fox (Pteropus niger), the Caroline flying fox (Pteropus molossinus), a subspecies of Pteropus pelagicus (P. p. insularis), and the Seychelles fruit bat (Pteropus seychellensis).[93]: 9
A 1992 summary of forty-one megabat genera noted that twenty-nine are tree-roosting genera. A further eleven genera roost in caves, and the remaining six genera roost in other kinds of sites (human structures, mines, and crevices, for example). Tree-roosting species can be solitary or highly colonial, forming aggregations of up to one million individuals. Cave-roosting species form aggregations ranging from ten individuals up to several thousand. Highly colonial species often exhibit roost fidelity, meaning that their trees or caves may be used as roosts for many years. Solitary species or those that aggregate in smaller numbers have less fidelity to their roosts.[70]: 2

Most megabats are primarily frugivorous.[94] Throughout the family, a diverse array of fruit is consumed from nearly 188 plant genera.[95] Some species are also nectarivorous, meaning that they also drink nectar from flowers.[94] In Australia, Eucalyptus flowers are an especially important food source.[41] Other food resources include leaves, shoots, buds, pollen, seed pods, sap, cones, bark, and twigs.[96] They are prodigious eaters and can consume up to 2.5 times their own body weight in fruit per night.[95]
Megabats fly to roosting and foraging resources. They typically fly straight and relatively fast for bats; some species are slower with greater maneuverability. Species can commute 20–50 km (12–31 mi) in a night. Migratory species of the genera Eidolon, Pteropus, Epomophorus, Rousettus, Myonycteris, and Nanonycteris can migrate distances up to 750 km (470 mi). Most megabats have below-average aspect ratios,[97] which is measurement relating wingspan and wing area.[97]: 348 Wing loading, which measures weight relative to wing area,[97]: 348 is average or higher than average in megabats.[97]
Megabats play an important role in seed dispersal. As a result of their long evolutionary history, some plants have evolved characteristics compatible with bat senses, including fruits that are strongly scented, brightly colored, and prominently exposed away from foliage. The bright colors and positioning of the fruit may reflect megabats' reliance on visual cues and inability to navigate through clutter. In a study that examined the fruits of more than forty fig species, only one fig species was consumed by both birds and megabats; most species are consumed by one or the other. Bird-consumed figs are frequently red or orange, while megabat-consumed figs are often yellow or green.[98] Most seeds are excreted shortly after consumption due to a rapid gut transit time, but some seeds can remain in the gut for more than twelve hours. This heightens megabats' capacity to disperse seeds far from parent trees.[99] As highly mobile frugivores, megabats have the capacity to restore forest between isolated forest fragments by dispersing tree seeds to deforested landscapes.[100] This dispersal ability is limited to plants with small seeds that are less than 4 mm (0.16 in) in length, as seeds larger than this are not ingested.[101]
Megabats, especially those living on islands, have few native predators: species like the small flying fox (Pteropus hypomelanus) have no known natural predators.[102] Non-native predators of flying foxes include domestic cats and rats. The mangrove monitor, which is a native predator for some megabat species but an introduced predator for others, opportunistically preys on megabats, as it is a capable tree climber.[103] Another species, the brown tree snake, can seriously impact megabat populations; as a non-native predator in Guam, the snake consumes so many offspring that it reduced the recruitment of the population of the Mariana fruit bat (Pteropus mariannus) to essentially zero. The island is now considered a sink for the Mariana fruit bat, as its population there relies on bats immigrating from the nearby island of Rota to bolster it rather than successful reproduction.[104] Predators that are naturally sympatric with megabats include reptiles such as crocodilians, snakes, and large lizards, as well as birds like falcons, hawks, and owls.[70]: 5 The saltwater crocodile is a known predator of megabats, based on analysis of crocodile stomach contents in northern Australia.[105] During extreme heat events, megabats like the little red flying fox (Pteropus scapulatus) must cool off and rehydrate by drinking from waterways, making them susceptible to opportunistic depredation by freshwater crocodiles.[106]
Megabats are the hosts of several parasite taxa. Known parasites include Nycteribiidae and Streblidae species ("bat flies"),[107][108] as well as mites of the genus Demodex.[109] Blood parasites of the family Haemoproteidae and intestinal nematodes of Toxocaridae also affect megabat species.[41][110]
Megabats are widely distributed in the tropics of the Old World, occurring throughout Africa, Asia, Australia, and throughout the islands of the Indian Ocean and Oceania.[18] As of 2013, fourteen genera of megabat are present in Africa, representing twenty-eight species. Of those twenty-eight species, twenty-four are only found in tropical or subtropical climates. The remaining four species are mostly found in the tropics, but their ranges also encompass temperate climates. In respect to habitat types, eight are exclusively or mostly found in forested habitat; nine are found in both forests and savannas; nine are found exclusively or mostly in savannas; and two are found on islands. Only one African species, the long-haired rousette (Rousettus lanosus), is found mostly in montane ecosystems, but an additional thirteen species' ranges extend into montane habitat.[111]: 226
Outside of Southeast Asia, megabats have relatively low species richness in Asia. The Egyptian fruit bat is the only megabat whose range is mostly in the Palearctic realm;[112] it and the straw-colored fruit bat are the only species found in the Middle East.[112][113] The northernmost extent of the Egyptian fruit bat's range is the northeastern Mediterranean.[112] In East Asia, megabats are found only in China and Japan. In China, only six species of megabat are considered resident, while another seven are present marginally (at the edge of their ranges), questionably (due to possible misidentification), or as accidental migrants.[114] Four megabat species, all Pteropus, are found on Japan, but none on its five main islands.[115][116][117][118] In South Asia, megabat species richness ranges from two species in the Maldives to thirteen species in India.[119] Megabat species richness in Southeast Asia is as few as five species in the small country of Singapore and seventy-six species in Indonesia.[119] Of the ninety-eight species of megabat found in Asia, forest is a habitat for ninety-five of them. Other habitat types include human-modified land (66 species), caves (23 species), savanna (7 species), shrubland (4 species), rocky areas (3 species), grassland (2 species), and desert (1 species).[119]
In Australia, five genera and eight species of megabat are present. These genera are Pteropus, Syconycteris, Dobsonia, Nyctimene, and Macroglossus.[41]: 3 Pteropus species of Australia are found in a variety of habitats, including mangrove-dominated forests, rainforests, and the wet sclerophyll forests of the Australian bush.[41]: 7 Australian Pteropus are often found in association with humans, as they situate their large colonies in urban areas, particularly in May and June when the greatest proportions of Pteropus species populations are found in these urban colonies.[120]
In Oceania, the countries of Palau and Tonga have the fewest megabat species, with one each. Papua New Guinea has the greatest number of species with thirty-six.[121] Of the sixty-five species of Oceania, forest is a habitat for fifty-eight. Other habitat types include human-modified land (42 species), caves (9 species), savanna (5 species), shrubland (3 species), and rocky areas (3 species).[121] An estimated nineteen percent of all megabat species are endemic to a single island; of all bat families, only Myzopodidae—containing two species, both single-island endemics—has a higher rate of single-island endemism.[122]
Megabats are killed and eaten as bushmeat throughout their range. Bats are consumed extensively throughout Asia, as well as in islands of the West Indian Ocean and the Pacific, where Pteropus species are heavily hunted. In continental Africa where no Pteropus species live, the straw-colored fruit bat, the region's largest megabat, is a preferred hunting target.[123]
In Guam, consumption of the Mariana fruit bat exposes locals to the neurotoxin beta-Methylamino-L-alanine (BMAA) which may later lead to neurodegenerative diseases. BMAA may become particularly biomagnified in humans who consume flying foxes; flying foxes are exposed to BMAA by eating cycad fruits.[124][125][126]


Megabats are the reservoirs of several viruses that can affect humans and cause disease. They can carry filoviruses, including the Ebola virus (EBOV) and Marburgvirus.[127] The presence of Marburgvirus, which causes Marburg virus disease, has been confirmed in one species, the Egyptian fruit bat. The disease is rare, but the fatality rate of an outbreak can reach up to 88%.[127][128] The virus was first recognized after simultaneous outbreaks in the German cities of Marburg and Frankfurt as well as Belgrade, Serbia in 1967[128] where 31 people became ill and seven died.[129] The outbreak was traced to laboratory work with vervet monkeys from Uganda.[128] The virus can pass from a bat host to a human (who has usually spent a prolonged period in a mine or cave where Egyptian fruit bats live); from there, it can spread person-to-person through contact with infected bodily fluids, including blood and semen.[128] The United States Centers for Disease Control and Prevention lists a total of 601 confirmed cases of Marburg virus disease from 1967 to 2014, of which 373 people died (62% overall mortality).[129]
Species that have tested positive for the presence of EBOV include Franquet's epauletted fruit bat (Epomops franqueti), the hammer-headed fruit bat, and the little collared fruit bat. Additionally, antibodies against EBOV have been found in the straw-colored fruit bat, Gambian epauletted fruit bat (Epomophorus gambianus), Peters's dwarf epauletted fruit bat (Micropteropus pusillus), Veldkamp's dwarf epauletted fruit bat (Nanonycteris veldkampii), Leschenault's rousette, and the Egyptian fruit bat.[127] Much of how humans contract the Ebola virus is unknown. Scientists hypothesize that humans initially become infected through contact with an infected animal such as a megabat or non-human primate.[130] Megabats are presumed to be a natural reservoir of the Ebola virus, but this has not been firmly established.[131] Microbats are also being investigated as the reservoir of the virus, with the greater long-fingered bat (Miniopterus inflatus) once found to harbor a fifth of the virus's genome (though not testing positive for the actual virus) in 2019.[132] Due to the likely association between Ebola infection and "hunting, butchering and processing meat from infected animals", several West African countries banned bushmeat (including megabats) or issued warnings about it during the 2013–2016 epidemic; many bans have since been lifted.[133]
Other megabats implicated as disease reservoirs are primarily Pteropus species. Notably, flying foxes can transmit Australian bat lyssavirus, which, along with the rabies virus, causes rabies. Australian bat lyssavirus was first identified in 1996; it is very rarely transmitted to humans. Transmission occurs from the bite or scratch of an infected animal but can also occur from getting the infected animal's saliva in a mucous membrane or an open wound. Exposure to flying fox blood, urine, or feces cannot cause infections of Australian bat lyssavirus. Since 1994, there have been three records of people becoming infected with it in Queensland—each case was fatal.[134]
Flying foxes are also reservoirs of henipaviruses such as Hendra virus and Nipah virus. Hendra virus was first identified in 1994; it rarely occurs in humans. From 1994 to 2013, there have been seven reported cases of Hendra virus affecting people, four of which were fatal. The hypothesized primary route of human infection is via contact with horses that have come into contact with flying fox urine.[135] There are no documented instances of direct transmission between flying foxes and humans.[136] As of 2012, there is a vaccine available for horses to decrease the likelihood of infection and transmission.[137]
Nipah virus was first identified in 1998 in Malaysia. Since 1998, there have been several Nipah outbreaks in Malaysia, Singapore, India, and Bangladesh, resulting in over 100 casualties. A 2018 outbreak in Kerala, India resulted in 19 humans becoming infected—17 died.[138] The overall fatality rate is 40–75%. Humans can contract Nipah virus from direct contact with flying foxes or their fluids, through exposure to an intermediate host such as domestic pigs, or from contact with an infected person.[139] A 2014 study of the Indian flying fox and Nipah virus found that while Nipah virus outbreaks are more likely in areas preferred by flying foxes, "the presence of bats in and of itself is not considered a risk factor for Nipah virus infection." Rather, the consumption of date palm sap is a significant route of transmission. The practice of date palm sap collection involves placing collecting pots at date palm trees. Indian flying foxes have been observed licking the sap as it flows into the pots, as well as defecating and urinating in proximity to the pots. In this way, humans who drink palm wine can be exposed to henipaviruses. The use of bamboo skirts on collecting pots lowers the risk of contamination from bat urine.[140]
Flying foxes can transmit several non-lethal diseases as well, such as Menangle virus[141] and Nelson Bay virus.[142] These viruses rarely affect humans, and few cases have been reported.[141][142] Megabats are not suspected to be vectors of coronaviruses.[143]

Megabats, particularly flying foxes, are featured in indigenous cultures and traditions. Folk stories from Australia and Papua New Guinea feature them.[144][145] They were also included in Indigenous Australian cave art, as evinced by several surviving examples.[146]
Indigenous societies in Oceania used parts of flying foxes for functional and ceremonial weapons. In the Solomon Islands, people created barbs out of their bones for use in spears.[147] In New Caledonia, ceremonial axes made of jade were decorated with braids of flying fox fur.[148] Flying fox wings were depicted on the war shields of the Asmat people of Indonesia; they believed that the wings offered protection to their warriors.[149]
There are modern and historical references to flying fox byproducts used as currency. In New Caledonia, braided flying fox fur was once used as currency.[147] On the island of Makira, which is part of the Solomon Islands, indigenous peoples still hunt flying foxes for their teeth as well as for bushmeat. The canine teeth are strung together on necklaces that are used as currency.[150] Teeth of the insular flying fox (Pteropus tonganus) are particularly prized, as they are usually large enough to drill holes in. The Makira flying fox (Pteropus cognatus) is also hunted, despite its smaller teeth. Deterring people from using flying fox teeth as currency may be detrimental to the species, with Lavery and Fasi noting, "Species that provide an important cultural resource can be highly treasured." Emphasizing sustainable hunting of flying foxes to preserve cultural currency may be more effective than encouraging the abandonment of cultural currency. Even if flying foxes were no longer hunted for their teeth, they would still be killed for bushmeat; therefore, retaining their cultural value may encourage sustainable hunting practices.[151] Lavery stated, "It's a positive, not a negative, that their teeth are so culturally valuable. The practice of hunting bats shouldn't necessarily be stopped, it needs to be managed sustainably."[150]

As of 2014, the International Union for Conservation of Nature (IUCN) evaluated a quarter of all megabat species as threatened, which includes species listed as critically endangered, endangered, and vulnerable. Megabats are substantially threatened by humans, as they are hunted for food and medicinal uses. Additionally, they are culled for actual or perceived damage to agriculture, especially to fruit production.[152] As of 2019, the IUCN had evaluations for 187 megabat species. The status breakdown is as follows:[153]
Megabats are threatened by habitat destruction by humans. Deforestation of their habitats has resulted in the loss of critical roosting habitat. Deforestation also results in the loss of food resource, as native fruit-bearing trees are felled. Habitat loss and resulting urbanization leads to construction of new roadways, making megabat colonies easier to access for overharvesting. Additionally, habitat loss via deforestation compounds natural threats, as fragmented forests are more susceptible to damage from typhoon-force winds.[70]: 7 Cave-roosting megabats are threatened by human disturbance at their roost sites. Guano mining is a livelihood in some countries within their range, bringing people to caves. Caves are also disturbed by mineral mining and cave tourism.[70]: 8
Megabats are also killed by humans, intentionally and unintentionally. Half of all megabat species are hunted for food, in comparison to only eight percent of insectivorous species,[154] while human persecution stemming from perceived damage to crops is also a large source of mortality. Some megabats have been documented to have a preference for native fruit trees over fruit crops, but deforestation can reduce their food supply, causing them to rely on fruit crops.[70]: 8 They are shot, beaten to death, or poisoned to reduce their populations. Mortality also occurs via accidental entanglement in netting used to prevent the bats from eating fruit.[155] Culling campaigns can dramatically reduce megabat populations. In Mauritius, over 40,000 Mauritian flying foxes were culled between 2014 and 2016, reducing the species' population by an estimated 45%.[156] Megabats are also killed by electrocution. In one Australian orchard, it is estimated that over 21,000 bats were electrocuted to death in an eight-week period.[157] Farmers construct electrified grids over their fruit trees to kill megabats before they can consume their crop. The grids are questionably effective at preventing crop loss, with one farmer who operated such a grid estimating they still lost 100–120 tonnes (220,000–260,000 lb) of fruit to flying foxes in a year.[158] Some electrocution deaths are also accidental, such as when bats fly into overhead power lines.[159]
Climate change causes flying fox mortality and is a source of concern for species persistence. Extreme heat waves in Australia have been responsible for the deaths of more than 30,000 flying foxes from 1994 to 2008. Females and young bats are most susceptible to extreme heat, which affects a population's ability to recover.[160] Megabats are threatened by sea level rise associated with climate change, as several species are endemic to low-lying atolls.[103]
Because many species are endemic to a single island, they are vulnerable to random events such as typhoons. A 1979 typhoon halved the remaining population of the Rodrigues flying fox (Pteropus rodricensis). Typhoons result in indirect mortality as well: because typhoons defoliate the trees, they make megabats more visible and thus more easily hunted by humans. Food resources for the bats become scarce after major storms, and megabats resort to riskier foraging strategies such as consuming fallen fruit off the ground. There, they are more vulnerable to depredation by domestic cats, dogs, and pigs.[93] As many megabat species are located in the tectonically active Ring of Fire, they are also threatened by volcanic eruptions. Flying foxes, including the endangered Mariana fruit bat,[118][161] have been nearly exterminated from the island of Anatahan following a series of eruptions beginning in 2003.[162]
Megabats constitute the family Pteropodidae of the order Chiroptera (bats). They are also called fruit bats, Old World fruit bats, or—especially the genera Acerodon and Pteropus—flying foxes. They are the only member of the superfamily Pteropodoidea, which is one of two superfamilies in the suborder Yinpterochiroptera. Internal divisions of Pteropodidae have varied since subfamilies were first proposed in 1917. From three subfamilies in the 1917 classification, six are now recognized, along with various tribes. As of 2018, 197 species of megabat had been described.
The leading theory of the evolution of megabats has been determined primarily by genetic data, as the fossil record for this family is the most fragmented of all bats. They likely evolved in Australasia, with the common ancestor of all living pteropodids existing approximately 31 million years ago. Many of their lineages probably originated in Melanesia, then dispersed over time to mainland Asia, the Mediterranean, and Africa. Today, they are found in tropical and subtropical areas of Eurasia, Africa, and Oceania.
The megabat family contains the largest bat species, with individuals of some species weighing up to 1.45 kg (3.2 lb) and having wingspans up to 1.7 m (5.6 ft). Not all megabats are large-bodied; nearly a third of all species weigh less than 50 g (1.8 oz). They can be differentiated from other bats due to their dog-like faces, clawed second digits, and reduced uropatagium. Only members of one genus, Notopteris, have tails. Megabats have several adaptations for flight, including rapid oxygen consumption, the ability to sustain heart rates of more than 700 beats per minute, and large lung volumes.
Most megabats are nocturnal or crepuscular, although a few species are active during the daytime. During the period of inactivity, they roost in trees or caves. Members of some species roost alone, while others form colonies of up to a million individuals. During the period of activity, they use flight to travel to food resources. With few exceptions, they are unable to echolocate, relying instead on keen senses of sight and smell to navigate and locate food. Most species are primarily frugivorous and several are nectarivorous. Other less common food resources include leaves, pollen, twigs, and bark.
They reach sexual maturity slowly and have a low reproductive output. Most species have one offspring at a time after a pregnancy of four to six months. This low reproductive output means that after a population loss their numbers are slow to rebound. A quarter of all species are listed as threatened, mainly due to habitat destruction and overhunting. Megabats are a popular food source in some areas, leading to population declines and extinction. They are also of interest to those involved in public health as they are natural reservoirs of several viruses that can affect humans.
Los pteropódidos (Pteropodidae), conocidos comúnmente como megamurciélagos, murciélagos frugívoros o (en especial los de los géneros Acerodon y Pteropus) zorros voladores, son una familia de mamíferos quirópteros. Son el único miembro de la superfamilia Pteropodoidea, una de las dos que componen el suborden Yinpterochiroptera.
Las divisiones de Pteropodidae han variado desde que se propusieron por primera vez subfamilias en 1917, pasando de las tres que se clasificaron ese año, a las seis que se reconocen actualmente, junto con varias tribus; hasta 2018 se habían descrito 197 especies de pteropódidos. El conocimiento de la evolución de los megamurciélagos ha estado determinada sobre todo por datos genéticos, ya que el registro fósil de esta familia es el más fragmentado de todos los murciélagos. Es probable que hayan evolucionado en Australasia, con el ancestro común de todos los pteropódidos vivos que apareció hace aproximadamente 31 millones de años. Muchos de sus linajes probablemente se originaron en Melanesia y posteriormente se dispersaron a lo largo del tiempo por el Asia continental, el Mediterráneo y África. En la actualidad se distribuyen por áreas tropicales y subtropicales de Eurasia, África y Oceanía.
Aunque esta familia incluye las especies de murciélagos de mayor tamaño, con individuos de algunas especies que pesan hasta 1,45 kg y tienen una envergadura de hasta 1,7 m, a pesar de su nombre no todos los megamurciélagos tienen un cuerpo de gran tamaño, pues casi un tercio de todas las especies pesan menos de 50 g. Morfológicamente se pueden distinguir de otros murciélagos por sus caras similares a las de los perros, hocico vulpino, la presencia de garras en el segundo dedo de la mano y su reducido uropatagio. Solo los miembros de un género, Notopteris, tienen cola. Como todos los murciélagos, cuentan con varias adaptaciones para el vuelo, como el rápido consumo de oxígeno, la capacidad de mantener una frecuencia cardíaca de más de 700 latidos por minuto y un gran volumen pulmonar.
La mayoría son nocturnos o crepusculares, aunque algunas especies son activas durante el día. Durante los períodos de inactividad se refugian en árboles o cuevas; los miembros de algunas especies descansan solos, mientras que otros forman colonias de hasta un millón de individuos. Durante los períodos de actividad utilizan el vuelo para desplazarse hasta los recursos alimenticios. Con pocas excepciones, los miembros de esta familia carecen de capacidad de ecolocalización, por lo que recurren a sus agudos sentidos de la vista y el olfato para orientarse y buscar los alimentos. La mayoría de las especies son fundamentalmente frugívoras y algunas son nectarívoras; otros recursos alimenticios menos comunes son hojas, polen, ramitas y corteza.
Alcanzan la madurez sexual a un ritmo lento y tienen un bajo rendimiento reproductivo. La mayoría de las especies tienen una sola cría tras una gestación de cuatro a seis meses; este escaso rendimiento reproductivo se traduce en que, tras una pérdida de población, su número tarda en recuperarse. Una cuarta parte de las especies de la familia están catalogadas como amenazadas, principalmente debido a la destrucción de su hábitat y a la caza indiscriminada. En algunas zonas son una fuente de alimento habitual, lo que ha provocado la disminución de la población y su extinción. Como otros murciélagos son objeto de estudios en el ámbito de la salud pública, ya que son reservorios naturales de varios virus que pueden afectar a los seres humanos.
Los megamurciélagos recibieron este nombre porque generalmente son los murciélagos de mayor peso y tamaño; el más grande, Pteropus neohibernicus, pesa hasta 1,6 kg,[2] con una envergadura de hasta 1,7 m.[3] A pesar de que el tamaño corporal fue una característica definitoria que Dobson utilizó para la división de los murciélagos en Microchiroptera y Megachiroptera, no todas las especies de megamurciélagos son de gran tamaño o más grandes que los micromurciélagos: Balionycteris maculata pesa solo 14,2 g.[4] Los géneros Pteropus y Acerodon (zorros voladores) suelen tomarse como referentes de toda la familia en cuanto a tamaño corporal, pero en realidad estos géneros son atípicos, lo que crea un concepto erróneo del verdadero tamaño de la mayoría de las especies de la familia.[5] En un estudio realizado en 2004 se señalaba que el 28 % de las especies de megamurciélagos pesaban menos de 50 g.[4]
Pueden distinguirse de los micromurciélagos por su cara similar a la de un perro y su hocico vulpino, por la presencia de garras en el segundo dedo de la extremidad anterior (ver sección Postcráneo y por sus pequeñas orejas,[6] que se debe en parte a la carencia de trago,[n 1] que sí está presente en muchas especies de micromurciélagos. Los miembros del género Nyctimene tienen un aspecto menos parecido a los perros, con caras más cortas y fosas nasales tubulares.[8] Un estudio de 2011 sobre 167 especies de megamurciélagos concluyó que mientras que la mayoría (63 %) tiene un pelaje de color uniforme, se observan otros patrones en esta familia: contracoloración en el 4 % de las especies, una banda en el cuello o nuca en el 5 %, rayas en el 10 % y manchas en el 19 % de las especies.[9]
A diferencia de los micromurciélagos tienen un uropatagio —extensión de la membrana de vuelo de piel elástica y resistente que se extiende entre las extremidades posteriores— muy reducido.[10] Carecen de cola o es muy pequeña, con la excepción de las especies del género Notopteris, que tienen una larga cola.[11] En la mayoría de las especies de esta familia las alas se insertan lateralmente (se unen al cuerpo directamente en los lados), pero en Dobsonia las alas se unen más cerca de la columna vertebral, lo que les da el nombre común de murciélagos frugívoros «de espalda desnuda».[10]
Los pteropódidos tienen cavidades orbitarias grandes, bordeadas por apófisis postorbitales[n 2] que, en ocasiones, se unen para formar la barra postorbital. El hocico, de longitud variable según los géneros, es de aspecto sencillo y no muy modificado, a diferencia de otras familias de murciélagos.[12] El premaxilar está bien desarrollado y normalmente está libre,[13] esto es, que no se fusiona con el maxilar sino que se articula con él mediante ligamentos, lo que le permite moverse libremente.[14][15] El premaxilar siempre carece de una rama palatal.[13] En las especies con un hocico más largo el cráneo suele ser arqueado. En los géneros con caras más cortas (Penthetor, Nyctimene, Dobsonia y Myonycteris), el cráneo tiene poca o ninguna curvatura.[16]
El número de dientes oscila entre 24 y 34, según las especies; todas tienen dos o cuatro incisivos superiores e inferiores, con la excepción de Aproteles bulmerae, que carece completamente de incisivos,[17] y Myonycteris brachycephala, que tiene dos incisivos superiores y tres inferiores,[18] lo que lo convierte en la única especie de mamífero con una fórmula dentaria asimétrica.[18]
Todas las especies de la familia tienen dos dientes caninos superiores e inferiores. El número de premolares es variable, con cuatro o seis superiores e inferiores. Los primeros molares superiores e inferiores están siempre presentes, lo que significa que todos los megamurciélagos tienen al menos cuatro molares; los molares restantes pueden estar presentes, presentes pero reducidos, o ausentes.[17] La parte superior de los molares y premolares es sencilla, con una reducción de las cúspides y crestas que se traduce en una corona dental más aplanada.[19]
Como la mayoría de los mamíferos, los megamurciélagos son difodontos, lo que significa que los jóvenes tienen un conjunto de dientes deciduos (dientes de leche) que caen y son reemplazados por dientes permanentes; la mayoría de las especies de esta familia tiene 20 dientes de leche. Como el habitual entre los mamíferos,[20] el conjunto de dentición decidua no incluye los molares.[19]
Se ha descrito a los omóplatos de los megamurciélagos como los más primitivos de todas las familias de quirópteros.[19] El hombro es por lo general de construcción simple, pero tiene algunas características especializadas. La primitiva inserción del músculo omohioideo desde la clavícula hasta la escápula está desplazada lateralmente (más hacia el lado del cuerpo), una característica que también se ve en la familia de micromurciélagos Phyllostomidae. El hombro también tiene un sistema muy desarrollado de deslizamientos musculares (bandas estrechas de músculo que potencian los músculos más grandes) que anclan el tendón del músculo occipitopollicalis (músculo en los murciélagos que va desde la base del cuello hasta la base del pulgar)[10] a la piel.[21]
Mientras que los micromurciélagos solo tienen garras en los pulgares de sus extremidades anteriores, la mayoría de los megamurciélagos además tienen un segundo dedo con garras,[19] a excepción de los géneros Eonycteris, Dobsonia, Notopteris y Neopteryx, que carecen de esta segunda garra.[22] El primer dedo es el más corto, mientras que el tercer dedo es el más largo; el segundo dedo no puede ser flexionado.[19] Los pulgares de los megamurciélagos son más largos en relación con sus extremidades delanteras que los de los micromurciélagos.[10]
Las extremidades posteriores tienen los mismos componentes del esqueleto de los humanos. La mayoría de las especies de la familia tienen una estructura adicional denominada calcar, apófisis cartilaginoso que surge del calcáneo.[23] Algunos autores se denominan a esta estructura espolón uropatagial para diferenciarla de los calcares de los micromurciélagos, que tienen una estructura diferente. La estructura permite estabilizar el uropatagio, permitiendo a los murciélagos ajustar la curvatura de la membrana durante el vuelo. Los géneros Notopteris, Syconycteris y Harpyionycteris no disponen de calcar.[24] Toda la pierna rota en la cadera comparada con la orientación normal de los mamíferos, lo que supone que las rodillas están orientadas hacia atrás. Los cinco dedos de las patas se flexionan en la dirección del plano sagital, sin que ningún dedo pueda flexionarse en la dirección opuesta, como en las patas de las aves paseriformes.[23]
El alto coste energético que supone el vuelo requirió que experimentaran varias adaptaciones del sistema cardiovascular. Durante el vuelo, los murciélagos pueden elevar en veinte veces o más su consumo de oxígeno durante períodos prolongados; los atletas humanos pueden lograr un factor de aumento similar, pero durante unos pocos minutos como máximo.[25] Un estudio realizado en 1994 con Eidolon helvum y Hypsignathus monstrosus reveló una relación media de intercambio respiratorio[n 3] de aproximadamente 0,78. En la mediciones realizadas con dos especies, las frecuencia cardíacas máximas en vuelo variaron entre los 476 latidos por minuto en Pteropus poliocephalus y los 476 en Rousettus aegyptiacus. El número máximo de respiraciones por minuto varió entre 163 en Pteropus poliocephalus y 316 en Eidolon helvum[27] Además, los megamurciélagos tienen una capacidad pulmonar excepcionalmente grande en relación con su tamaño; mientras que mamíferos terrestres como las musarañas, tienen un volumen pulmonar de 0,03 cm3 por gramo de peso corporal, especies como Epomophorus wahlbergi tienen volúmenes de 0,13 cm3 por gramo, más de cuatro veces superior.[25]
Tienen un aparato digestivo rápido, con un tiempo de tránsito intestinal de media hora o menos,[8] Está adaptado para una dieta herbívora, en ocasiones restringida a frutas blandas o néctar.[28] La longitud es corta para un herbívoro (también más corta que la de los microquirópteros insectívoros),[28] ya que el contenido fibroso de su alimentación se separa en su mayor parte por la acción del paladar, la lengua y los dientes, y luego se desecha.[28] Muchos megamurciélagos tienen estómagos en forma de U. No hay una diferencia clara entre el intestino delgado y el grueso, ni un comienzo definido del recto. Tienen una densidad muy alta de microvellosidades intestinales, lo que proporciona una gran área para la absorción de nutrientes.[29]
Como en todos los murciélagos, el tamaño del genoma de los pteropódidos es mucho más pequeño que en otros mamíferos. Un estudio realizado en 2009 con 43 especies de megamurciélagos determinó que sus genomas iban desde los 1,86 picogramos[n 4] en Eidolon helvum y 2,51 pg en Pteropus lylei; todos los valores fueron mucho más bajos que el valor medio de los mamíferos de 3,5 pg. Los megamurciélagos tienen genomas más pequeños que los micromurciélagos, con un peso medio de 2,20 pg en comparación con 2,58 pg de estos últimos. Se cree que esta diferencia podría estar relacionada con el hecho de que el linaje de los megamurciélagos ha pasado por una extinción del LINE-1.[n 5] LINE-1 constituye entre el 15 y el 20 % del genoma humano y se considera el elemento nuclear intercalado largo más frecuente entre los mamíferos.[31]
A diferencia de otros murciélagos, con muy pocas excepciones los pteropódidos carecen de la capacidad de ecolocalización, por lo tanto dependen de la vista y el olfato para orientarse.[32] Sus ojos son grandes y están situados en la parte delantera de la cabeza.[33] Son más grandes que los del ancestro común de todos los murciélagos y un estudio evidenció una tendencia al aumento del tamaño de los ojos entre los megamurciélagos; en el mismo estudio, los exámenes realizados sobre los ojos de 18 especies de megamurciélagos determinó que Syconycteris australis tenía los ojos más pequeños, con un diámetro de 5,03 mm, mientras que los más grandes eran los de Pteropus vampyrus, con 12,34 mm de diámetro.[34] El iris suele ser marrón, pero puede ser rojo o naranja, como en Desmalopex, Mirimiri, Pteralopex y algunos Pteropus.[35]
Con altos niveles de brillo su agudeza visual es más pobre que la de los humanos, mientras que con poco brillo es superior.[33] Un estudio que examinó los ojos de algunas especies de Rousettus, Epomophorus, Eidolon y Pteropus concluyó que los tres primeros poseen tapetum lucidum, una estructura reflectante en los ojos que mejora la visión con bajos niveles de luz, mientras que las especies de Pteropus no.[32] Todas las especies examinadas tenían retinas con células fotosensibles tanto conos (responsables de la percepción del color) como bastones, pero solo las especies de Pteropus tenían conos tipo S, que detectan las longitudes de onda más cortas de la luz; debido a que no fue discernible la sintonía espectral de las opsinas, no está claro si los conos S de Pteropus detectan la luz azul o ultravioleta. Las especies de Pteropus son dicromáticas, ya que poseen dos tipos de células cono; los otros tres géneros, que carecen de conos S, son monocromáticos, incapaces de percibir el color. En todos los géneros se encontraron densidades muy altas de células bastón, lo que se traduce en una alta sensibilidad a la luz, que se corresponde con sus patrones de actividad nocturna; en Pteropus y Rousettus las densidades de bastones medidas fueron de 350 000 a 800 000 por milímetro cuadrado, igual o superior a las de otros animales nocturnos o crepusculares como el ratón común (Mus musculus), el gato (Felis silvestris catus) o el conejo doméstico (Oryctolagus cuniculus domesticus).[32]
Cuentan con un agudo sentido del olfato, similar al del perro doméstico (Canis lupus familiaris),[36] que utilizan para encontrar fuentes de alimento como la fruta y el néctar.[37] Los murciélagos frugívoros del género Nyctimene, como N. robinsoni, tienen un olfato estereoscópico, lo que les permite trazar un mapa y seguir rastros de olor en tres dimensiones.[36] Como la mayoría (o probablemente todas) las demás especies de murciélagos, las madres y las crías de los megamurciélagos también utilizan el olfato para reconocerse entre sí o a otros individuos.[37] Los machos de las especies de zorros voladores (Acerodon y Pteropus) tienen en los hombros glándulas sebáceas agrandadas y sensibles a los andrógenos que utilizan para marcar su territorio con olor, especialmente durante la época de apareamiento; las secreciones de estas glándulas varían según la especie.[38] Los machos también se lavan o se cubren con su propia orina.[38][39]
Los miembros de esta familia poseen el gen TAS1R2, lo que significa que tienen la capacidad de percibir el sabor dulce de los alimentos; este gen está presente en todos los murciélagos, excepto en los vampiros. Como todos los demás murciélagos, los pteropódidos no pueden percibir el sabor umami, debido a la ausencia del gen TAS1R1; de entre los otros mamíferos, solo los pandas gigantes han demostrado carecer de este gen.[37] Los pteropódidos también poseen múltiples genes TAS2R, lo que indica que pueden percibir el sabor amargo.[40]
Entre los mamíferos, al igual que todos los murciélagos, son longevos en relación a su tamaño; algunos ejemplares en cautiverio han superado los 30 años.[22] También en relación con su tamaño, tienen un bajo rendimiento reproductivo y una madurez sexual tardía; las hembras de la mayoría de las especies de la familia no dan a luz hasta alcanzar uno o dos años de edad.[41] Sus hábitos de apareamiento son muy variables y en gran medida desconocidos.[42] Algunos megamurciélagos aparentemente pueden reproducirse durante todo el año, pero la mayoría de las especies probablemente se reproducen de forma estacional.[22] El apareamiento se realiza en su lugar de cobijo, en la rama de un árbol.[43] La duración de la gestación es variable,[44] pero en la mayoría de las especies es de cuatro a seis meses. Varias especies muestran adaptaciones reproductivas que prolongan el período entre la cópula y el parto; algunas, como Eidolon helvum, utilizan la implantación diferida y, aunque la cópula se produce en junio o julio, el cigoto no se implanta en la pared uterina hasta meses más tarde, en noviembre.[41] Haplonycteris fischeri, debido a esta adaptación reproductiva del retraso de la implantación, tiene la mayor duración de la gestación de todas las especies de murciélagos, de hasta 11,5 meses.[44] Este retraso implica que el desarrollo del embrión se suspende hasta ocho meses después de la implantación en la pared uterina, de ahí sus larguísimos períodos de gestación.[41] En Cynopterus sphinx la duración de la gestación es más corta, de unos tres meses.[45]
Como norma general todas las especies de la familia paren una única cría,[41] aunque existen escasos registros de dos en Pteropus rufus, Epomops dobsoni, Pteropus poliocephalus, Pteropus alecto, Pteropus conspicillatus[46] Cynopterus sphinx,[47] Epomophorus crypturus, Hypsignathus monstrosus, Eidolon helvum, Myonycteris torquata, Rousettus aegyptiacus o Rousettus leschenaultii,[48] aunque en estos casos es raro que ambas crías sobrevivan.[46] Debido a que los pteropódidos, como todos los murciélagos, tienen bajas tasas de reproducción, en caso de disminución de su número, las poblaciones tardan en recuperarse.[49]
Al nacer, las crías de megamurciélagos tienen un peso, en promedio, del 17,5 % del peso postparto de su madre, la menor relación de peso madre/cría de todas las familias de murciélagos, que es de media del 22,3 %. No es fácil clasificar las crías de los megamurciélagos en las categorías tradicionales de altriciales (indefensos al nacer) o precociales (capaces al nacer); especies como Cynopterus sphinx nacen con los ojos abiertos (un signo de precodidad), mientras que los ojos de las crías de Rousettus aegyptiacus no se abren hasta nueve días después del nacimiento (un signo de altricialidad).[50]
Como en casi todas las especies de murciélagos, los machos no participan con las hembras en el cuidado parental.[51] Las crías permanecen con sus madres hasta que son destetadas; el tiempo que transcurre hasta el destete varía según las especies. Como todos los murciélagos, los pteropódidos tienen períodos de lactancia relativamente largos: las crías se amamantan hasta que alcanzan aproximadamente el 71 % de la masa corporal adulta, a diferencia del 40 % en los demás mamíferos.[52] Las especies del género Micropteropus destetan a sus crías a las siete u ocho semanas de edad, mientras que Pteropus medius lo hace a los cinco meses.[53] Aunque muy inusualmente, hay registros de individuos machos de dos especies de megamurciélagos, Pteropus capistratus y Dyacopterus spadiceus, produciendo leche, pero en estos casos nunca se ha observado un macho lactante;[54] no está claro si esta lactancia es funcional y los machos realmente amamantan a las crías o si es el resultado del estrés o la malnutrición.[55]
Muchas especies de esta familia son altamente gregarias o sociales. Los megamurciélagos vocalizan para comunicarse entre sí, con ruidos descritos como «ráfagas de sonido similares a trinos»,[56] graznidos[57] o llamadas fuertes similares a balidos[58] en varios géneros. Al menos una especie, Rousettus aegyptiacus, es capaz de un tipo aprendizaje de producción vocal, definido como «capacidad de modificar las vocalizaciones en respuesta a interacciones con congéneres».[59][60] Los jóvenes de esta especie son capaces de adquirir un determinado grupo de variaciones vocales escuchando a sus madres, así como a otros individuos de sus colonias; se ha postulado que estas diferencias de variaciones vocales pueden dar lugar, por ejemplo, a que los individuos de distintas colonias se comuniquen a distintas frecuencias.[61][62]
Entre los comportamientos sociales de los megamurciélagos se incluye el uso de conductas sexuales para algo más que la reproducción. Existen estudios que muestran la posibilidad de que las hembras de Rousettus aegyptiacus reciben comida de los machos a cambio de sexo; pruebas de paternidad confirmaron que los machos de los que cada hembra obtenía comida tenían una mayor probabilidad de engendrar la descendencia de la hembra.[63] Se ha observado felación homosexual en al menos una especie, Pteropus pselaphon;[64][65] se ha planteado la hipótesis de que este comportamiento fomenta la formación de colonias de machos antagónicos en climas fríos.[64][65]
La mayoría de pteropódidos son nocturnos o crepusculares, aunque se han observado casos de ejemplares volando durante el día.[3] Algunas especies y subespecies isleñas son diurnas, un comportamiento que se cree que responde a la falta de depredadores; entre las especies diurnas están Pteropus niger, Pteropus molossinus, Pteropus seychellensis, una subespecie de Pteropus melanotus (P. m. natalis) y una de Pteropus pelagicus (P. p. insularis).[66]
En un estudio de 1992 realizado sobre cuarenta y un géneros de megamurciélagos se observó que veintinueve se cuelgan en ramas de árboles, once se resguardaban en cuevas y los seis géneros restantes en otros lugares, como estructuras humanas, minas o grietas. Las especies que se refugian en los árboles pueden ser solitarias o muy coloniales, llegando a formar agrupaciones de hasta un millón de individuos. Las que se refugian en cuevas forman grupos que van desde diez individuos hasta varios miles. Las especies muy coloniales suelen mantener sus dormideros y sus árboles o cuevas pueden ser utilizados durante muchos años. Las especies solitarias o las que se agrupan en menor número tienen menos fidelidad a sus dormideros.[67]
La mayoría de megamurciélagos son fundamentalmente frugívoros.[68] Entre todos los miembros de la familia consumen una gran variedad de frutas que abarca casi 188 géneros de plantas.[69] Algunas especies son también nectarívoras.[68] En Australia las flores de los eucaliptos son una fuente especialmente importante de alimento.[70] Además de sus principales fuentes de alimento pueden aprovechar otros recursos alimenticios como hojas, brotes, capullos, polen, vainas de semillas, savia, conos, corteza y ramitas.[71] Son grandes consumidores y pueden ingerir hasta 2,5 veces su propio peso corporal en fruta por noche.[69]
Utilizan el vuelo para desplazarse hacia los recursos de descanso y forrajeo. Por lo general vuelan recto y relativamente rápido en comparación con otros murciélagos, aunque algunas especies son más lentas y tienen mayor capacidad de maniobra. Algunas especies puede recorrer de 20 a 50 km en una noche. Las especies migratorias de los géneros Eidolon, Pteropus, Epomophorus, Rousettus, Myonycteris y Nanonycteris pueden recorrer distancias de hasta 750 km. La mayoría de los megamurciélagos tienen una relación de aspecto (medida que relaciona la envergadura y la superficie de las alas) inferior a la media de los murciélagos;[72] la carga alar, que mide el peso en relación con la superficie de las alas, es igual o superior a la media.[72]
Juegan un papel importante en la dispersión de semillas. Como consecuencia de la extensa historia evolutiva de los megamurciélagos, algunas plantas han desarrollado características adaptadas a sus sentidos, como frutos muy aromáticos, de colores brillantes y visiblemente expuestos lejos del follaje. Los colores brillantes y la posición del fruto pueden reflejar la dependencia de los murciélagos de las señales visuales y su incapacidad de navegar a través del desorden. En un estudio que examinó los frutos de más de cuarenta especies de higos, la mayoría de las especies eran consumidas por aves o megamurciélagos y solo una especie de higo era consumida por ambos; los higos que consumían las aves eran con frecuencia rojos o anaranjados, mientras que en el caso de los megamurciélagos generalmente fueron amarillos o verdes.[73] La mayoría de las semillas se excretan poco después de su consumo debido al rápido tiempo de tránsito intestinal, aunque algunas pueden permanecer en el intestino durante más de doce horas, lo que aumenta la capacidad de los megamurciélagos de dispersar las semillas lejos de los árboles de origen.[74] Como frugívoros con gran movilidad tienen la capacidad de restaurar el bosque en zonas deforestadas gracias a su dispersión de semillas.[75] Esta capacidad de dispersión se limita a las plantas con semillas pequeñas, de menos de 4 mm de longitud, ya que las semillas más grandes no las ingieren.[76]
Los pteropódidos, especialmente los que viven en islas, tienen pocos depredadores nativos; especies como Pteropus hypomelanus no tienen depredadores naturales conocidos.[77] Entre los depredadores no nativos de los zorros voladores se encuentran en los gatos domésticos y las ratas. El varano de manglar (Varanus indicus), un depredador nativo para algunas especies de pteropódidos pero introducido para otras, se alimenta ocasionalmente de estos murciélagos, ya que es un hábil trepador de árboles.[78] La serpiente arbórea marrón (Boiga irregularis) puede afectar gravemente a las poblaciones de megamurciélagos; como depredador no nativo en Guam, esta serpiente consume tantas crías que redujo el reclutamiento[n 6] de zorros voladores de las Marianas (Pteropus mariannus) a prácticamente cero y la isla se considera ahora un sumidero para este murciélago, ya que su población en ella depende más de los murciélagos que emigran de la cercana isla Rota para reforzarla que para una reproducción adecuada.[80] Entre los depredadores naturalmente simpátricos con los megamurciélagos se encuentra reptiles como cocodrilos, serpientes y grandes lagartos, además de aves como halcones, accipítridos y rapaces nocturnas.[81] El cocodrilo marino (Crocodylus porosus) es uno de sus depredadores conocidos, basándose en el análisis del contenido de su estómago en el norte de Australia.[82]
Son hospedadores de varios taxones de parásitos. Entre sus parásitos conocidos se encuentran las especies de dípteros de las familias Nycteribiidae y Streblidae (conocidas como «moscas de los murciélagos»),[83][84] así como ácaros del género Demodex.[85] Los parásitos de la sangre de la familia Haemoproteidae y los nematodos intestinales de Toxocaridae también afectan a algunas especies de megamurciélagos.[86][87]
Su área de distribución se extiendo por la zona intertropical del Viejo Mundo; están presentes en África, Asia, Australia y en todas las islas del océano Índico y Oceanía.[88] En 2013 había catalogados catorce géneros de pteropódidos en África con un total de veintiocho especies, de las cuales veinticuatro solo se encuentran en climas tropicales o subtropicales y las cuatro restantes se localizan sobre todo en los trópicos, aunque sus área de distribución también incluye climas templados. Por su hábitat, ocho se localizan exclusiva o mayoritariamente en zonas boscosas, nueve se encuentran tanto en bosques como en sabanas, nueve exclusiva o mayoritariamente en sabanas y dos en islas; solo una especie africana, Rousettus lanosus, se encuentra principalmente en los ecosistemas de montaña, aunque el área de distribución de otras trece también puede abarcar hábitats de montañosos.[89]
A excepción del Sudeste Asiático, los megamurciélagos tienen una relativamente baja diversidad de especies en Asia. Rousettus aegyptiacus es el único megamurciélago cuya área de distribución se encuentra principalmente en el paleártico;[90] Rousettus aegyptiacus y Eidolon helvum son las únicas especies que se encuentran en el Oriente Medio.[90][91] La región más septentrional del área de distribución de Rousettus aegyptiacus es la zona nororiental del mar Mediterráneo.[90] En Asia Oriental se encuentran únicamente en China y Japón; en China, solo se consideran residentes seis especies, mientras que otras siete están presentes de manera marginal (en el borde de su área de distribución), de forma dudosa (debido a una posible identificación errónea) o como migrantes accidentales;[92] cuatro especies, todas del género Pteropus, se encuentran en el Japón, pero ninguna en sus cinco islas principales.[93][94][95][96] En Asia Meridional, la diversidad de megamurciélagos varía desde dos especies en las Maldivas hasta trece especies en la India.[97] En el Sudeste Asiático van de cinco especies en el pequeño país de Singapur a setenta y siete en Indonesia.[97] De todas las especies que se encuentran en Asia, los bosques son el hábitat de la gran mayoría ellas; otros tipos de hábitat son sabanas, matorrales o pastizales.[97]
En Australia se encuentran cinco géneros (Pteropus, Syconycteris, Dobsonia, Nyctimene y Macroglossus)[98] y ocho especies. Las especies de Pteropus se distribuyen por diversos hábitats, como los bosques dominados por manglares, las selvas tropicales y los bosques esclerófilos húmedos de los montes australianos;[99] las especies de zorros voladores de Australia se encuentran a menudo en asociación con los seres humanos, ya que emplazan grandes colonias en zonas urbanas, especialmente en mayo y junio.[100]
En Oceanía el mayor número de especies se encuentran en Papúa Nueva Guinea, con treinta y cinco.[97] De las sesenta y una especies de Oceanía, el bosque es el hábitat todas ellas; algunas además se encuentran en otros tipos de hábitat como la sabana (6 especies) o matorrales (3).[97]
Se estima que el 19 % de todas las especies de megamurciélagos son endémicas de una única isla; de todas las familias de murciélagos, solo Myzopodidae tiene una tasa más alta de endemismo de una sola isla.[101]
La mayor fuente de amenaza para los megamurciélagos es por parte de los humanos, ya que son cazados como alimento y para usos medicinales. Además, son sacrificados por daños reales o supuestos a la agricultura, especialmente a la producción de frutas.[103]
En 2020 la Unión Internacional para la Conservación de la Naturaleza (UICN) tenía catalogadas 195 especies de pteropódidos, de las cuales más de un tercio fueron evaluadas como amenazadas, categoría que incluye las especies que figuran en su Lista Roja como en peligro crítico de extinción, en peligro de extinción y vulnerables:[97]
Uno de los procesos que amenazan a los megamurciélagos es la destrucción de su hábitat por los humanos. La deforestación de sus territorios supone la pérdida de hábitats críticos para sus lugares de refugio y también provoca la pérdida de recursos alimentarios, ya que se talan los árboles frutales nativos. La deforestación y la creciente urbanización y construcción de nuevas carreteras facilita el acceso a sus colonias y su explotación excesiva, además de agravar las amenazas naturales, ya que los bosques fragmentados son más vulnerables a los daños causados por los tifones.[104] Las especies que se refugian en cuevas se ven amenazadas por las alteraciones humanas en sus lugares de descanso; la minería del guano y otros minerales en las cuevas es un medio de vida para los habitantes de algunos países dentro de su área de distribución y las cuevas también se ven perturbadas por el acceso de turistas.[105]
La mitad de todas las especies de megamurciélagos se cazan para obtener alimentos, en comparación con solo el 8 % de las especies insectívoras.[106] La persecución humana a causa de los daños aparentes que causan en los cultivos es también una de las principales razones de su caza. Existen registros de que algunos megamurciélagos prefieren los árboles frutales nativos a los cultivos agrícolas, pero la deforestación puede reducir su suministro de alimentos, haciendo que dependan de los cultivos frutales humanos.[105] Para matarlos se les dispara, se les golpea hasta la muerte o se les envenena; también se producen muertes al enredarse en las redes utilizadas para evitar que los murciélagos coman la fruta.[107] Las campañas de eliminación pueden reducir drásticamente las poblaciones de megamurciélagos; en Mauricio entre 2014 y 2016 se sacrificaron más de 40 000 ejemplares de Pteropus niger, lo que se estima que redujo la población de la especie en un 45 %.[108] También mueren por electrocución. Se calcula que en un huerto australiano murieron electrocutados 21 000 murciélagos en un período de ocho semanas.[109] Los agricultores colocan redes electrificadas sobre sus árboles frutales para matar a los murciélagos antes de que puedan consumir su cosecha, aunque son cuestionablemente efectivas para prevenir la pérdida de la cosecha, pues un granjero que operaba una red de este tipo estimó que aun así perdieron de 100 a 120 toneladas de fruta a causa de los zorros voladores en un año.[110] También se producen algunas muertes accidentales por electrocución, como cuando los murciélagos se estrellan contra las líneas eléctricas aéreas.[111]
El cambio climático también ocasiona la mortalidad de los zorros voladores y es motivo de preocupación para la supervivencia de muchas especies. Las olas de calor extremo en Australia han sido responsables de la muerte de más de 30 000 zorros voladores entre 1994 y 2008; las hembras y los murciélagos jóvenes son los más vulnerables al calor extremo, lo que afecta a la capacidad de recuperación de la población.[112] Los murciélagos también se ven amenazados por el aumento del nivel del mar asociado al cambio climático, ya que varias especies son endémicas de atolones de baja altitud.[113]
Debido a que muchas especies son endémicas de una única isla, son vulnerables a fenómenos aleatorios como los tifones. Un tifón en 1979 redujo a la mitad la población de Pteropus rodricensis. Los tifones también provocan una mortalidad indirecta, ya que a causa de la defoliación que provocan en los árboles hacen que los murciélagos sean más visibles y, por lo tanto, más fáciles de cazar por los seres humanos. Tras estas grandes tormentas sus recursos alimentarios se vuelven escasos y tienen que recurrir a estrategias de búsqueda más arriesgadas, como el consumo de los frutos caídos del suelo, donde son más vulnerables a la depredación por parte de los gatos, perros y cerdos domésticos.[114] Como muchas especies de megamurciélagos se encuentran en el tectónicamente activo cinturón de Fuego del Pacífico, también están amenazadas por las erupciones volcánicas; los zorros voladores, como Pteropus mariannus, que está en peligro de extinción,[96][115] han sido casi exterminados de la isla de Anatahan tras una serie de erupciones que comenzaron en 2003.[116]
Epomophorini
Relaciones internas de los pteropódidos africanos basadas en la evidencia combinada de ADN mitocondrial y nuclear. Se incluyeron como grupos externos una especie de Pteropodinae, una de Nyctimeninae y una de Cynopterinae, que no se encuentran en África.[117]La familia Pteropodidae fue descrita por primera vez en 1821 por el zoólogo británico John Edward Gray. La denominó «Pteropidae» (a partir del género Pteropus) y la situó dentro del ahora desaparecido orden Fructivorae.[118] Fructivorae contenía otra familia, la ya desaparecida Cephalotidae, que incluía un género, Cephalotes[118] (ahora reconocido como sinónimo de Dobsonia).[13] La asignación del nombre por parte de Gray se basaba posiblemente en una utilización errónea del sufijo de «Pteropus».[5] Pteropus proviene del griego πτερο ptero 'ala' y πούς poús 'pie';[119][120] la palabra griega poús proviene de la raíz pod-, por lo que al latinizar Pteropus el prefijo correcto sería «Pteropod-».[121] El biólogo francés Charles Lucien Bonaparte fue el primero en utilizar la ortografía corregida de Pteropodidae en 1838.[121]
En 1875 el zoólogo irlandés George Edward Dobson fue el primero en dividir el orden Chiroptera (murciélagos) en dos subórdenes: Megachiroptera (a veces catalogado como Macrochiroptera) y Microchiroptera, que se conocen comúnmente como megamurciélagos y micromurciélagos.[122] Dobson eligió estos nombres para hacer referencia a las diferencias de tamaño corporal de los dos grupos, ya que muchos murciélagos frugívoros son de mayor tamaño que los murciélagos insectívoros. Pteropodidae fue la única familia que incluyó dentro de Megachiroptera.[5][122]
En un estudio realizado en 2001 se comprobó que la dicotomía entre los megamurciélagos y los micromurciélagos no reflejaba con exactitud sus relaciones evolutivas por lo que, en lugar de Megachiroptera y Microchiroptera, los autores del estudio propusieron los nuevos subórdenes Yinpterochiroptera y Yangochiroptera.[123] Este esquema de clasificación se ha revisado posteriormente en varias ocasiones y actualmente (2019) sigue contando con un amplio apoyo.[124][125][126][127] Yinpterochiroptera (desde 2005 este suborden se denomina también Pteropodiformes)[128] contiene especies que antes estaban incluidas en Megachiroptera (todos los pteropódidos), así como varias familias que antes estaban incluidas en Microchiroptera: Megadermatidae, Rhinolophidae, Nycteridae, Craseonycteridae y Rhinopomatidae.[123] Yinpterochiroptera se divide en dos superfamilias: Rhinolophidea, que contiene las familias anteriormente mencionadas en el Microchiroptera y Pteropodoidea, que solo contiene Pteropodidae.[129]
En 1917 el mastozoólogo danés Knud Andersen dividió Pteropodidae en tres subfamilias: Macroglossinae, Pteropinae (modificado a Pteropodinae) y Harpyionycterinae.[130] En un estudio realizado en 1995 se descubrió que tal como se había definido anteriormente Macroglossinae, que contenía los géneros Eonycteris, Notopteris, Macroglossus, Syconycteris, Melonycteris y Megaloglossus, era parafilético, lo que implicaba que la subfamilia no agrupaba a todos los descendientes de un antepasado común.[131] En publicaciones posteriores se considera a Macroglossini como una tribu dentro de Pteropodinae que contiene solo Macroglossus y Syconycteris.[132][88] Eonycteris y Melonycteris están ubicados dentro de otras tribus en Pteropodinae,[117][88] Megaloglossus se situó en la tribu Myonycterini de la subfamilia Rousettinae y Notopteris es de ubicación incierta.[88]
Otras subfamilias y tribus dentro de Pteropodidae también han sufrido cambios desde la publicación de Andersen en 1917.[88] En 1997 los pteropódidos se clasificaron en seis subfamilias y nueve tribus en función de su morfología o características físicas.[88] En un estudio genético de 2011 se llegó a la conclusión de que algunas de esas subfamilias eran parafiléticas y, por lo tanto, no describían con exactitud las relaciones entre las especies de megamurciélagos. Tres de las subfamilias propuestas en 1997 basadas en la morfología recibieron respaldo: Cynopterinae, Harpyionycterinae y Nyctimeninae. Los otros tres clados recuperados en este estudio consistieron en Macroglossini, Epomophorinae + Rousettini y Pteropodini + Melonycteris.[88] Un estudio genético de 2016 centrado únicamente en los pteropódidos africanos (Harpyionycterinae, Rousettinae y Epomophorinae) también cuestionó la clasificación de 1997. Todas las especies anteriormente incluidas en Epomophorinae se trasladaron a Rousettinae, que se subdividió en varias tribus. El género Eidolon, que antes pertenecía a la tribu Rousettini de Rousettinae, fue trasladado a su propia subfamilia, Eidolinae.[117]
En 1984 se propuso una subfamilia adicional de pteropódidos, Propottinininae, que representaba una especie extinta descrita a partir de un fósil descubierto en África, Propotto leakeyi,[133] pero en 2018 se reexaminaron los fósiles y se determinó que correspondían a un lémur.[134] En 2018 había descritas 197 especies de la familia Peteropodidae,[135] de las cuales alrededor de un tercio son zorros voladores del género Pteropus.[136]
El registro fósil de los pteropódidos es el más incompleto de todas las familias de murciélagos. Se estima que más del 98 % de la historia fósil de esta familia ha desaparecido.[127] Entre los posibles factores que podrían explicar el motivo de esta escasez de fósiles están que las regiones tropicales donde podrían encontrarse sus fósiles son menos estudiadas en relación con Europa y América del Norte, que las condiciones para la fosilización son malas en los trópicos, lo que podría dar lugar a un menor número de fósiles en general, o que es posible que se hayan originado, pero que hayan sido destruidos por la actividad geológica posterior.[137] A pesar de esta carencia, la edad y los períodos de divergencia de la familia todavía se pueden estimar utilizando la filogenética computacional. Pteropodidae se separó de la superfamilia Rhinolophoidea (que contiene todas las demás familias del suborden Yinpterochiroptera) hace aproximadamente 58 Ma.[127] El ancestro del grupo terminal de Pteropodidae, o todas las especies existentes, vivió hace aproximadamente 31 Ma.[138]
De acuerdo con reconstrucciones biogeográficas realizadas, la familia Pteropodidae probablemente tiene sus orígenes en Australasia.[117] De otros análisis biogeográficos se desprende que las islas de la Melanesia, incluida Nueva Guinea, son un candidato plausible para el origen de la mayoría de las subfamilias de megamurciélagos, con la excepción de los Cynopterinae,[88] que, según los resultados de un análisis ponderado del área ancestral de seis genes nucleares y mitocondriales, probablemente tiene su origen en la plataforma de la Sonda.[138] Desde estas regiones colonizaron otras áreas, como el Asia continental y África. Según un estudio de 2016, los megamurciélagos llegaron a África en al menos cuatro eventos distintos; estos eventos propuestos están representados por (1) Scotonycteris, (2) Rousettus, (3) Scotonycterini y (4) el «clado endémico de África», que incluye Stenonycterini, Plerotini, Myonycterini y Epomophorini. Se desconoce cuándo llegaron a África, pero varias tribus (Scotonycterini, Stenonycterini, Plerotini, Myonycterini y Epomophorini) ya estaban presentes en el Mioceno tardío. También se desconoce cómo llegaron a África; se ha propuesto que podrían haber llegado a través de Oriente Medio antes de que se volviera más árido al final del Mioceno, o bien podrían haber llegado al continente a través del puente terrestre Gomphotherium, que conectaba la península arábiga con Eurasia. Se plantea que el género Pteropus, que no se encuentra en el continente africano, se ha dispersado desde la Melanesia mediante saltos entre islas a través del océano Índico;[139] algo menos probable para otros géneros de megamurciélagos, que son de menor tamaño y por tanto tienen una capacidad de vuelo más limitada.[117]
Los pteropódidos son la única familia de murciélagos sin capacidad de ecolocalización laríngea. No está claro si el antepasado común de todos los murciélagos poseía la capacidad de ecolocación y, por lo tanto, si esta capacidad se perdió en el linaje de los megamurciélagos o si varios linajes de murciélagos la desarrollaron de forma independiente (la superfamilia Rhinolophoidea y el suborden Yangochiroptera).[n 7]
Un estudio realizado en 2017 sobre la ontogenia (desarrollo embrionario) de los murciélagos encontró pruebas de que los embriones de los megamurciélagos tienen inicialmente una cóclea grande y desarrollada similar a la de los micromurciélagos ecolocalizadores, aunque al nacer tienen una cóclea pequeña similar a la de los mamíferos no ecolocalizadores; esta evidencia apoya que la ecolocalización laríngea evolucionó inicialmente entre los murciélagos y se perdió en los pteropódidos, en lugar de evolucionar de manera independiente.[141] Los miembros del género Rousettus poseen una forma primitiva de ecolocación mediante el chasquido de la lengua.[142] Se ha comprobado que algunas especies —Eonycteris spelaea, Cynopterus brachyotis y Macroglossus sobrinus— crean chasquidos similares a los de los murciélagos ecolocalizadores utilizando las alas.[143]
Tanto la ecolocalización como el vuelo son procesos que conllevan un gran coste energético.[144] Los murciélagos ecolocalizadores combinan la producción de sonido con los mecanismos de vuelo, lo que les permite reducir la carga energética adicional de la ecolocalización; en lugar de presurizar un bolo de aire para la producción de sonido, los murciélagos ecolocalizadores laríngeos probablemente utilizan la fuerza del batido de sus alas para presurizar el aire, reduciendo el coste energético al sincronizar el batido de las alas y la ecolocalización.[145] La pérdida de la capacidad de ecolocalización (o la no evolución) entre los megamurciélagos puede deberse a la disociación del vuelo y la ecolocalización.[146] El mayor tamaño corporal medio de los megamurciélagos en comparación con los murciélagos ecolocalizadores,[4] sugiere que un mayor tamaño corporal interrumpe el vínculo entre el vuelo y la ecolocalización y hace que ésta sea demasiado costosa energéticamente para conservarla.[146]
La familia Pteropodidae se divide en 6 subfamílias y 46 géneros:[117][88]
Familia Pteropodidae
Los pteropódidos son una fuente de carne de animal silvestre y consumidos en toda su área de distribución. Los murciélagos son una fuente de alimento generalizada en toda Asia, así como en las islas del océano Índico occidental y el Pacífico, donde las especies de Pteropus son objeto de caza intensiva. En el África continental, donde no se encuentra ninguna especie de Pteropus, el megamurciélago de mayor tamaño de la región, Eidolon helvum, es un blanco de caza habitual.[148]
En Guam el consumo de Pteropus mariannus expone a los habitantes a la neurotoxina beta-metilamino-L-alanina (BMAA, por sus siglas en inglés), que puede provocar enfermedades neurodegenerativas; la BMAA puede biomagnificarse en los seres humanos que consumen zorros voladores, que están expuestos a esta toxina al comer frutos de cícadas.[149][150][151]
Los megamurciélagos son un reservorio natural de algunos virus que pueden afectar a los humanos y provocarles enfermedades. Pueden portar filovirus, como el virus del Ébola (Ebolavirus) o el virus de Marburgo (Marburgvirus).[152]
La presencia de Marburgvirus, que causa la fiebre hemorrágica de Marburgo, una enfermedad rara pero en la que la tasa de mortalidad de un brote puede llegar hasta el 88 %, ha sido confirmada en Rousettus aegyptiacus.[152][153] Este virus fue reconocido por primera vez tras brotes simultáneos en Marburgo y Fráncfort (Alemania), así como en Belgrado (Serbia) en 1967,[153] donde 31 personas enfermaron y siete murieron.[154] El virus puede pasar de un murciélago huésped a un humano (que por lo general ha pasado un período prolongado en una mina o cueva donde viven Rousettus aegyptiacus) y propagarse de persona a persona mediante el contacto con fluidos corporales infectados como la sangre y el semen.[153] Los Centros para el Control y Prevención de Enfermedades de Estados Unidos registraron un total de 601 casos confirmados de fiebre hemorrágica de Marburgo entre 1967 y 2014, de los cuales 373 personas murieron (tasa de mortalidad del 62 %).[154]
Entre las especies de pteropódidos en las que se ha confirmado la presencia de Ebolavirus se encuentran Epomops franqueti, Hypsignathus monstrosus y Myonycteris torquata. Además se han identificado anticuerpos contra el virus del Ébola en Eidolon helvum, Epomophorus gambianus, Micropteropus pusillus, Nanonycteris veldkampii, Rousettus leschenaultii y Rousettus aegyptiacus.[152] Aunque se desconoce en gran medida la forma en que los humanos contraen el virus del Ébola, los científicos tienen la hipótesis de que los humanos se infectan inicialmente a través del contacto con un animal infectado como un megamurciélago o un primate[155] y posteriormente se transmite entre humanos a través de fluidos o secreciones corporales como heces, orina, saliva o semen.[156] Se supone que los megamurciélagos son un reservorio natural del virus del Ébola, aunque no se ha establecido con certeza.[157] También se está investigando a los micromurciélagos como reservorio del virus, ya que en 2019 se descubrió que Miniopterus inflatus albergaba una quinta parte del genoma del virus, aunque no dio positivo para el virus propiamente dicho (a fecha enero de 2019).[158] Debido a la probable asociación entre la infección por Ebolavirus y «la caza, la matanza y la elaboración de productos cárnicos de animales infectados», varios países de África occidental prohibieron la carne de animales silvestres (incluidos los megamurciélagos) o emitieron advertencias al respecto durante la epidemia de ébola de 2014-2016, aunque desde entonces se han levantado muchas prohibiciones.[159]
Especies del género Pteropus pueden transmitir el lisavirus australiano de murciélago, que, junto con el virus de la rabia, causa la rabia. El lisavirus australiano de murciélago fue identificado por primera vez en un ejemplar de Pteropus alecto. La transmisión se produce por la mordedura o el arañazo de un animal infectado, o por la penetración de la saliva del animal infectado en una membrana mucosa o una herida abierta; la simple exposición a sangre, orina o heces de zorros voladores no puede causar infecciones del virus del murciélago australiano. Es muy raro que se transmita a los humanos pero, aunque solo se han registrado tres casos de personas que se infectaron con él en 1996 en Queensland, en todos los casos resultó mortal.[160]
Los zorros voladores también son reservorios de Henipavirus como el virus Hendra y el Nipah. El virus Hendra fue identificado por primera vez en 1994 y rara vez se desarrolla en los seres humanos; entre 1994 y 2013 se han notificado siete casos de este virus que afectaron a personas, aunque cuatro de ellos fueron mortales. No existen casos documentados de transmisión directa entre los zorros voladores y los seres humanos.[161] Se ha planteado la hipótesis de que la vía principal de infección en humanos es a través del contacto con caballos que han entrado en contacto con orina de zorro volador;[162] desde 2012 se dispone de una vacuna para los caballos con el fin de disminuir la probabilidad de infección y transmisión.[163][164]
El virus Nipah se identificó por primera vez en 1998 en Malasia. Desde 1998 se han producido varios brotes de este virus en Malasia, Singapur, la India y Bangladés, que han causado más de 100 víctimas. Un brote en 2018 en Kerala (India) provocó la enfermedad de 19 personas infectadas, 17 de las cuales murieron.[165] La tasa global de mortalidad es del 40 al 75 %. Los seres humanos pueden contagiarse por contacto directo con zorros voladores o sus fluidos, por exposición a un huésped intermedio como los cerdos domésticos, o por contacto con una persona infectada.[166] En un estudio realizado en 2014 sobre Pteropus medius y el virus Nipah se descubrió que, si bien los brotes del virus son más probables en las zonas frecuentadas por los zorros voladores, «la presencia de murciélagos en sí no se considera un factor de riesgo de infección por el virus Nipah». En cambio el consumo de la savia de la palmera datilera (Phoenix dactylifera) es una importante vía de transmisión. La práctica de la recolección de la savia de las palmeras datileras consiste en colocar macetas de recolección en las palmeras datileras y se han observado Pteropus medius lamiendo la savia cuando fluye hacia las cubetas, así como defecando y orinando en las proximidades de las mismas y, de esta manera, los humanos que beben vino de palma pueden estar expuestos a los henipavirus.[167]
Los zorros voladores también pueden transmitir varias enfermedades no letales, como el virus Menangle y el virus de la bahía de Nelson.[168][169] Estos virus raramente afectan a los humanos y se han reportado pocos casos.[168][169] No se sospecha que los megamurciélagos sean vectores de coronavirus.[170]
Los megamurciélagos, en particular los zorros voladores, están presentes en las culturas y tradiciones indígenas y se encuentran en historias populares de Australia y Papúa Nueva Guinea.[171][172] También se representaron en el arte rupestre indígena australiano, como lo demuestran varios ejemplos que se conservan.[173]
Las sociedades indígenas de Oceanía utilizaban partes de zorros voladores como armas funcionales o ceremoniales. En las Islas Salomón los habitantes elaboraban cuchillas a partir de sus huesos para usarlas en lanzas.[174] En Nueva Caledonia decoraban hachas ceremoniales de jade con trenzas de piel de zorro volador.[175] Los asmat de Indonesia representaban alas de zorro volador sus escudos de guerra, pues creían que las alas ofrecían protección a sus guerreros.[176]
Existen referencias modernas e históricas sobre la utilización de partes de zorros voladores como moneda. En Nueva Caledonia su piel trenzada se usó como moneda.[174] En la isla de Makira, que forma parte de las Islas Salomón, los pueblos indígenas todavía cazan zorros voladores tanto por sus dientes como por su carne. Los dientes caninos los ensartan en collares que se usan como moneda;[177] los dientes de Pteropus tonganus son particularmente apreciados ya que suelen ser lo suficientemente grandes como para hacerles agujeros, aunque también utilizan los de Pteropus cognatus, a pesar de sus dientes más pequeños.[178][177]
|número-autores= (ayuda) |número-editores= (ayuda) |número-autores= (ayuda) Los pteropódidos (Pteropodidae), conocidos comúnmente como megamurciélagos, murciélagos frugívoros o (en especial los de los géneros Acerodon y Pteropus) zorros voladores, son una familia de mamíferos quirópteros. Son el único miembro de la superfamilia Pteropodoidea, una de las dos que componen el suborden Yinpterochiroptera.
Las divisiones de Pteropodidae han variado desde que se propusieron por primera vez subfamilias en 1917, pasando de las tres que se clasificaron ese año, a las seis que se reconocen actualmente, junto con varias tribus; hasta 2018 se habían descrito 197 especies de pteropódidos. El conocimiento de la evolución de los megamurciélagos ha estado determinada sobre todo por datos genéticos, ya que el registro fósil de esta familia es el más fragmentado de todos los murciélagos. Es probable que hayan evolucionado en Australasia, con el ancestro común de todos los pteropódidos vivos que apareció hace aproximadamente 31 millones de años. Muchos de sus linajes probablemente se originaron en Melanesia y posteriormente se dispersaron a lo largo del tiempo por el Asia continental, el Mediterráneo y África. En la actualidad se distribuyen por áreas tropicales y subtropicales de Eurasia, África y Oceanía.
Aunque esta familia incluye las especies de murciélagos de mayor tamaño, con individuos de algunas especies que pesan hasta 1,45 kg y tienen una envergadura de hasta 1,7 m, a pesar de su nombre no todos los megamurciélagos tienen un cuerpo de gran tamaño, pues casi un tercio de todas las especies pesan menos de 50 g. Morfológicamente se pueden distinguir de otros murciélagos por sus caras similares a las de los perros, hocico vulpino, la presencia de garras en el segundo dedo de la mano y su reducido uropatagio. Solo los miembros de un género, Notopteris, tienen cola. Como todos los murciélagos, cuentan con varias adaptaciones para el vuelo, como el rápido consumo de oxígeno, la capacidad de mantener una frecuencia cardíaca de más de 700 latidos por minuto y un gran volumen pulmonar.
La mayoría son nocturnos o crepusculares, aunque algunas especies son activas durante el día. Durante los períodos de inactividad se refugian en árboles o cuevas; los miembros de algunas especies descansan solos, mientras que otros forman colonias de hasta un millón de individuos. Durante los períodos de actividad utilizan el vuelo para desplazarse hasta los recursos alimenticios. Con pocas excepciones, los miembros de esta familia carecen de capacidad de ecolocalización, por lo que recurren a sus agudos sentidos de la vista y el olfato para orientarse y buscar los alimentos. La mayoría de las especies son fundamentalmente frugívoras y algunas son nectarívoras; otros recursos alimenticios menos comunes son hojas, polen, ramitas y corteza.
Alcanzan la madurez sexual a un ritmo lento y tienen un bajo rendimiento reproductivo. La mayoría de las especies tienen una sola cría tras una gestación de cuatro a seis meses; este escaso rendimiento reproductivo se traduce en que, tras una pérdida de población, su número tarda en recuperarse. Una cuarta parte de las especies de la familia están catalogadas como amenazadas, principalmente debido a la destrucción de su hábitat y a la caza indiscriminada. En algunas zonas son una fuente de alimento habitual, lo que ha provocado la disminución de la población y su extinción. Como otros murciélagos son objeto de estudios en el ámbito de la salud pública, ya que son reservorios naturales de varios virus que pueden afectar a los seres humanos.
Pteropodidae Megachiroptera ugaztun hegalari azpiordenaren barruko familia bakarra da. Saguzar handiez osaturik dago, azeri muturra duten espezieekin. Mikrosaguzarrak mundu osoan zehar banaturik badaude ere megasaguzarrak Afrika, Asia eta Ozeanian baino ez dira bizi. Askotan filmeetan agertzen dira, baina gizakientzat ez dira arriskutsuak.
Begi handiak ditu eta fruituak, loreak edo lore hautsa jaten ditu. Rousettus izenekoa izan ezik, gainerako pteropodidoek ikusmen ona dute, eta ez dute hots-uhin sistema erabiltzen oztopoak saihesteko. Zuhaitzetan bizi dira gehienak, eta batzuk leize-zuloetan, harkaitzetan edo hirietako eraikuntzetan. Pteropodido handiena Pteropus izenekoa da, 40 cm inguru neurtzen dituena.[1]
Pteropodidae Megachiroptera ugaztun hegalari azpiordenaren barruko familia bakarra da. Saguzar handiez osaturik dago, azeri muturra duten espezieekin. Mikrosaguzarrak mundu osoan zehar banaturik badaude ere megasaguzarrak Afrika, Asia eta Ozeanian baino ez dira bizi. Askotan filmeetan agertzen dira, baina gizakientzat ez dira arriskutsuak.
Begi handiak ditu eta fruituak, loreak edo lore hautsa jaten ditu. Rousettus izenekoa izan ezik, gainerako pteropodidoek ikusmen ona dute, eta ez dute hots-uhin sistema erabiltzen oztopoak saihesteko. Zuhaitzetan bizi dira gehienak, eta batzuk leize-zuloetan, harkaitzetan edo hirietako eraikuntzetan. Pteropodido handiena Pteropus izenekoa da, 40 cm inguru neurtzen dituena.
Hedelmälepakot (Pteropodidae) on lepakoiden heimo, johon kuuluu vähintään 186 lajia 42 eri suvussa[2]. Perinteisessä luokittelussa, jossa lepakoiden Chiroptera-lahko on jaettu kahteen alalahkoon, hedelmälepakot on ollut suurlepakoiden alalahkon (Megachiroptera) ainoa heimo.[3] Hedelmälepakoiden heimo puolestaan on aiemmin jaettu alaheimoihin, joita on ollut lähteestä riippuen 2–6.[1] Nykyisessä luokittelussa näitä alalahkoja ja alaheimoja ei kuitenkaan yleensä enää käytetä.[1]
Monet hedelmälepakot ovat hyvin suurikokoisia. Yksi kookkaimmista tähän nisäkäsryhmään kuuluvista lajeista on isolentäväkoira (Pteropus vampyrus). Pienimmät "suurlepakot" ovat kuitenkin vain viiden senttimetrin mittaisia[3] eli pienempiä kuin suurimmat pienlepakot. Suurlepakot erottaa pienlepakoista se, että niiden sormien luut ovat paljon pidempiä. Niillä on kynsi myös toisessakin sormessa, mutta niiltä puuttuu häntä tai se on huomattavan pieni.[4]
Hedelmälepakot elävät Vanhan maailman eli Afrikan, Aasian ja Oseanian trooppisilla ja subtrooppisilla alueilla.[3] Muutamaa lajia tavataan myös Tyynenmeren ja Intian valtameren saarilla sekä Lähi-idän, eteläisen Afrikan ja Kaakkois-Australian lauhkeilla vyöhykkeillä.[3] Useat lajit elävät suurissa, jopa miljoonien yksilöiden yhdyskunnissa.[3] Nimensä mukaisesti hedelmälepakot käyttävät ravinnokseen pääasiassa hedelmiä mutta myös kukkia, siitepölyä, lehtiä ja satunnaisesti hyönteisiä.[3]
Nisäkäsnimistötoimikunta on ehdottanut hedelmälepakoiden heimolle uutta suomenkielistä nimeä hekkolepakot.[5]
Rousettus aegyptiacus-koirankuonolepakko ruokailemassa.
Lepääviä harmaapäälentäväkoiria (Pteropus poliocephalus).
Cynopterus minutus lähikuvassa.
Intianlentävänkoiran (Pteropus giganteus) luuranko.
Hedelmälepakot (Pteropodidae) on lepakoiden heimo, johon kuuluu vähintään 186 lajia 42 eri suvussa. Perinteisessä luokittelussa, jossa lepakoiden Chiroptera-lahko on jaettu kahteen alalahkoon, hedelmälepakot on ollut suurlepakoiden alalahkon (Megachiroptera) ainoa heimo. Hedelmälepakoiden heimo puolestaan on aiemmin jaettu alaheimoihin, joita on ollut lähteestä riippuen 2–6. Nykyisessä luokittelussa näitä alalahkoja ja alaheimoja ei kuitenkaan yleensä enää käytetä.
Monet hedelmälepakot ovat hyvin suurikokoisia. Yksi kookkaimmista tähän nisäkäsryhmään kuuluvista lajeista on isolentäväkoira (Pteropus vampyrus). Pienimmät "suurlepakot" ovat kuitenkin vain viiden senttimetrin mittaisia eli pienempiä kuin suurimmat pienlepakot. Suurlepakot erottaa pienlepakoista se, että niiden sormien luut ovat paljon pidempiä. Niillä on kynsi myös toisessakin sormessa, mutta niiltä puuttuu häntä tai se on huomattavan pieni.
Hedelmälepakot elävät Vanhan maailman eli Afrikan, Aasian ja Oseanian trooppisilla ja subtrooppisilla alueilla. Muutamaa lajia tavataan myös Tyynenmeren ja Intian valtameren saarilla sekä Lähi-idän, eteläisen Afrikan ja Kaakkois-Australian lauhkeilla vyöhykkeillä. Useat lajit elävät suurissa, jopa miljoonien yksilöiden yhdyskunnissa. Nimensä mukaisesti hedelmälepakot käyttävät ravinnokseen pääasiassa hedelmiä mutta myös kukkia, siitepölyä, lehtiä ja satunnaisesti hyönteisiä.
Nisäkäsnimistötoimikunta on ehdottanut hedelmälepakoiden heimolle uutta suomenkielistä nimeä hekkolepakot.
Rousettus aegyptiacus-koirankuonolepakko ruokailemassa.
Lepääviä harmaapäälentäväkoiria (Pteropus poliocephalus).
Harmaapäälentäväkoira lennossa.
Cynopterus minutus lähikuvassa.
Intianlentävänkoiran (Pteropus giganteus) luuranko.
La famille des Pteropodidae regroupe des chauves-souris dont le nom vernaculaire utilise le terme de roussette, mais pas uniquement. Jusqu'à récemment, elles formaient la seule famille du sous-ordre des Mégachiroptères (Megachiroptera). Cependant, des études moléculaires ont bouleversé la classification des Chiroptères et les Pteropodidae sont désormais regroupés avec quelques familles de Microchiroptera au sein des Yinpterochiroptera. Cette famille compte près de 170 espèces réparties dans 42 genres[1]. Ces Chiroptères à tête de renard sont en général frugivores, mais les plus petites sont nectarivores. Elles se répartissent dans les zones au climat tropical de l'Afrique à l'Australie. Leur diversité est particulièrement importante en Australasie[1].
Elle dispose d'un long museau et d'oreilles pointues qui rappellent ceux des canidés. Comme les autres chiroptères, leurs membres avant sont équipés d'un patagium qui permet le vol. Cependant les organes et les techniques de vol sont moins développés que chez les microchiroptères, l'autre groupe de chauves-souris. En général, ces animaux nocturnes sont de couleur sombre, du brun au gris, mais au moins une est jaune Cynopterus brachyotis et Pteropus pumilus est presque blanche.
Les plus grandes espèces de ces chauves-souris sont parmi les Pteropus dont la roussette géante des Indes mais surtout le kalong de Malaisie[1]. Celles-ci peuvent atteindre à l'âge adulte 1,7 m d'envergure pour 35 à 40 cm de long et un poids de plus de 1,5 kg. La plus petite est certainement Syconycteris australis avec ses 12 à 15 cm d'envergure pour un poids total de 3 à 5 g.
Beaucoup d'espèces affichent un dimorphisme sexuel et chez la plupart d'entre elles, les mâles sont plus grands que les femelles. Les canines sont plus développées chez un grand nombre d'espèces également. Les mâles de certaines espèces disposent de glandes cutanées. Le dimorphisme sexuel le plus important s'observe chez Hypsignathus monstrosus chez qui les mâles ont un important sac pharyngal qui leur permet de pousser des cris très bruyants.
Ces chiroptères voient très bien, bien mieux que leurs cousines microchiroptères. La Rousettus egyptiacus, qui vit dans les grottes, sait utiliser l'écholocation mais d'une manière générale, ce sens n'est pas aussi développé que chez leurs cousines, d'ailleurs il semble que les mécanismes mis en œuvre chez les macrochiroptères pour la permettre soit légèrement différents de celui des microchiroptères, ce qui permet d'imaginer que ce sens se soit développé indépendamment chez les Pteropodidae. Ces chauves-souris disposent également d'un bon sens de l'odorat, ce qui leur permet de détecter très loin fruits et fleurs.
Beaucoup d'espèces sont grégaires, elles se regroupent dans des arbres. Elles sont souvent bruyantes.
Les plus grandes espèces sont frugivores, leurs dents sont adaptées à percer la peau des fruits et à les broyer afin d'en extraire le jus, qui dans certains cas est la seule partie consommée. Les plus petites espèces sont également ou seulement nectarivores et comme les oiseaux-mouches lèchent le nectar des fleurs. Ces petites espèces peuvent avoir très peu de dents. Les Nyctimene sont eux, partiellement insectivores, et donc atypiques pour plusieurs raisons.
Ces espèces semblent toutes jouer un rôle important pour la préservation des forêts et des savanes boisées. Les espèces nectarivores sont d'excellents pollinisateurs, les pollens se prenant facilement dans les poils. Les autres disséminent les graines, après une digestion rapide. Les déjections sont effectuées en vol. Aussi certaines espèces d'arbres forment une interaction mutualiste avec une espèce, c'est le cas de certaines espèces de baobab (genre Adansonia) et des arbres à saucisses.
L'homme est prédateur des espèces les plus grandes, il les mange. Plusieurs de ces chauves-souris sont réputées être vecteurs potentiels de virus dangereux. Depuis 2007, on a montré que la roussette d'Égypte est un des réservoirs possibles pour le virus Marburg[2]. Entre 2001 et 2003, on a montré que trois espèces de ces chauves-souris, Hypsignathus monstrosus, Epomops franqueti, et Myonycteris torquata sont potentiellement porteuses saines d'un virus proche de celui du Marburg, le virus Ebola[3]. En Malaisie, des roussettes sont porteuses du virus Nipah, hautement pathogène également.
Les espèces frugivores peuvent s'attaquer aux vergers, elles sont alors considérées comme nuisibles.
C'est la seule famille au sein du sous-ordre des Megachiroptera, l'autre sous-ordre des Chiroptères étant les Microchiroptera. Les différences de comportements et de morphologies sont assez notables entre les deux groupes.
L'histoire évolutive des chauves-souris est assez mal connue. Selon la théorie classique, les deux sous-ordres descendent d'un ancêtre commun, déjà capable de vol et d'écholocation. Ces groupes auraient divergé il y a 50 Ma. On a découvert des fossiles de Ptéropodidés datés au moins du milieu de l'Oligocène[1]. Cependant, dans les années 1980 et 1990 naquit une autre hypothèse, considérant que les Megachiroptera étaient en fait un groupe proche des primates, plus précisément des lémuriens : en effet les tarsiers ressemblent beaucoup aux mégachiroptères. Dans cette hypothèse, le vol et l'écholocation seraient une simple convergence évolutive[4]. D'ailleurs, au XVIIIe siècle, Georges-Louis Leclerc de Buffon ne considérait pas ces animaux comme des chauves-souris à part entière[5]. Cette hypothèse est démentie par les analyses phylogénétiques récentes, qui indiquent une plus longue histoire commune avec le clade des microchiroptères que l'hypothèse primate ne le permet[6],[7].
D'autres études ont récemment suggéré que certaines familles de microchiroptères insectivores comme les Rhinolophidae, les Rhinopomatidae et les Megadermatidae pourraient être plus proches de ce groupe que de celui des microchiroptères[6],[8]. L'utilisation des données moléculaires et la multiplication des recherches ont permis de revoir et corriger la systématique de l'Ordre des Chiroptères. Les sous-ordres Microchiroptera et Megachiroptera ont laissé la place aux sous-ordres Yinpterochiroptera (Mégachiroptères + quelques familles de Microchiroptères) et les Yangochiroptera (les familles de Microchiroptères restantes). Cette classification est cependant très récente (les années 2000) et n'est pas encore rentrée dans les mœurs.
Les Ptéropodidés se distinguent assez aisément des autres chauves-souris par principalement sept caractéristiques suivantes :
Le second doigt est relativement indépendant du troisième doigt et, en général, conserve une griffe alors qu'il n'y en a pas pour toutes les autres espèces de chiroptères[1]. Le Processus postorbital du crâne est bien marqué[1]. La denture, très variable selon les espèces, est beaucoup plus réduite en général que chez microchiroptères et il n'y a pas plus de deux incisives, aussi bien en haut et qu'en bas sur la mâchoire[1]. Le prémaxillaire est très développé, ce qui donne cet aspect canin mais il manque les branches palatales[1]. Les oreilles sont moins développées que chez les autres chiroptères, l'écholocation est d'ailleurs moins développée chez ces espèces, voir pratiquement inexistante. Le tragus est minimal et la cochlée est petite[1]. La queue, est petite ou absente et n'est pas prise dans le patagium[1].
Deux sous-familles sont distinguées dans les classifications couramment admises en 2008, les Macroglossinae et les Pteropodinae, elles ont été créées par Gray respectivement en 1866 et 1830. Cependant le groupe formé par les Macroglossinae, bien que toutes ces espèces soient nectarivores, semble être, au vu des analyses morphologiques et génétiques,paraphylétique ou polyphylétique[9]. Leurs ressemblances n'est donc alors qu'une convergence évolutive[9] et ce groupe devrait à terme être revu d'autant que le terme Macroglossinae est identique à une sous famille de lépidoptère, les Macroglossinae. Ce groupe inclut en général, en 2008, douze espèces réparties dans six genres Eonycteris, les Macroglossus, les Megaloglossus, les Melonycteris, les Notopteris, les Syconycteris. Le groupe des Pteropodinae regroupe les genres Acerodon, Aethalops, Alionycteris, Aproteles, Balionycteris, Boneia, Casinycteris, Chironax, Cynopterus, Dobsonia, Dyacopterus, Eidolon, Epomophorus, Epomops, Haplonycteris, Harpyionycteris, Hypsignathus, Latidens, Megaerops, Micropteropus, Myonycteris, Nanonycteris, Neopteryx, Nyctimene, Otopteropus, Paranyctimene, Penthetor, Plerotes, Ptenochirus, Pteralopex, Pteropus, Rousettus, Scotonycteris, Sphaerias, Styloctenium, Thoopterus. Des études sont en cours pour déterminer leur phylogénie précise au sein des Pteropodinae[9].
Selon MSW :
Le terme Megachiroptera est issu de terme grec ancien et peut se traduire par « grande chauve-souris ». Le terme Pteropodidae se traduit de même par « pied volant ». La famille a été proposée par Gray en 1821, tandis que le sous-ordre l'a été par Dobson en 1875.
La plupart des espèces peuvent être appelées roussette ou renard volant. Quelques-unes ont un nom vernaculaire spécifique qui ne contient pas ce terme comme la chauve-souris au nez en tube des Philippines (Nyctimene rabori) ou la chauve-souris de Wœrmann (Megaloglossus woermanni). Bon nombre d'espèces n'ont cependant pas de nom en français, elles peuvent être appelées génériquement « ptérope » ou d'après un nom formé par une transcription en français de leur nom scientifique, comme l'hypsignathe monstrueux terme formé à partir de Hypsignathus monstrosus. Le Pteropus subniger, aujourd'hui disparu, s'appelait aussi rougette.
Selon l'UICN, au moins quatre grandes espèces sont éteintes en 2008, Pteropus brunneus, Pteropus pilosus, Pteropus subniger, Pteropus tokudae. Neuf espèces sont en danger critique, 18 en danger et 38 sont vulnérables.
La famille des Pteropodidae regroupe des chauves-souris dont le nom vernaculaire utilise le terme de roussette, mais pas uniquement. Jusqu'à récemment, elles formaient la seule famille du sous-ordre des Mégachiroptères (Megachiroptera). Cependant, des études moléculaires ont bouleversé la classification des Chiroptères et les Pteropodidae sont désormais regroupés avec quelques familles de Microchiroptera au sein des Yinpterochiroptera. Cette famille compte près de 170 espèces réparties dans 42 genres. Ces Chiroptères à tête de renard sont en général frugivores, mais les plus petites sont nectarivores. Elles se répartissent dans les zones au climat tropical de l'Afrique à l'Australie. Leur diversité est particulièrement importante en Australasie.
Velešišmiši (Pteropodidae) su porodica sisavaca iz reda šišmiša (Chiroptera). Oni su jedina porodica podreda Megachiroptera. Čini ju 40 rodova s nepunih 200 vrsta.
Velešišmiši žive u tropskim i suptropskim područjima Afrike (uključujući Madagaskar), južnoj Aziji, Australiji i zapadnim dijelovima Oceanije. Ne žive u Europi, s izuzetkom egipatskog plodojedog šišmiša (Rousettus aegyptiacus) na Cipru, ako se u ovom smislu Cipar može smatrati Europom.
Velešišmiši su najveći pretstavnici reda šišmiša, tako kalong (Pterpus vampyrus) doseže raspon krila do 170 cm, a neke vrste su dugačke do 40 cm. Međutim, mnoge vrste velešišmiša su manje, tako da su najveće vrste sitnošišmiša prilično veće od najmanjih velešišmiša.
Građom tijela su svi šišmiši uglavnom vrlo slični. Letnu kožicu zatežu produženim drugim do petim prstom koja seže do gležnjeva. Međutim, većina velešišmiša uopće nema (izuzetak su dugorepi šišmiši (Notopteris)) ili ima samo vrlo kratak rep. Repna letna kožica im je samo uska pruga duž unutrašnje strane zadnjih nogu. Još jedna odlika kojom se razlikuju od sitnošišmiša je i kandža kojom kod većine velešišmiša završava drugi prst, koju sitni šišmiši nemaju.
Velešišmiši su aktivni prije svega u sumrak i noću. U potrazi za hranom prelaze velike udaljenosti, a danju spavaju viseći glavom prema dole. Za razliku od sitnošišmiša, često ih se može vidjeti na stablima na izloženim mjestima.
Još jedna razlika u odnosu na sitnošišmiše je nedostatak mogućnosti snalaženja u okolišu uz pomoć ultrazvuka (izuzetak su rozetni velešišmiši (Rousettini)). Imaju dobro razvijen vid i izvanredan njuh. Ne provode zimski san jer žive u toplim klimatskim područjima. Veće vrste često žive u velikim grupama, tvoreći pri tome kolonije u kojima može biti i do 500.000 jedinki s vrlo kompleksnim socijalnim ponašanjem, manje vrste su uglavnom samotnjaci.
Uprkos svojoj veličini, velešišmiši su potpuno bezopasni. Hrane isključivo biljnom hranom, nektarom, polenom, voćem i cvijećem. Čitav niz vrsta imaju iznimnu važnost za vegetaciju jer hraneći se voćem raznose sjemenke voćki, a neke biljke oprašuju isključivo velešišmiši. To znači, da bi njihov nestanak istovremeno značio i nestanak tih vrsta biljki.
Čak i spolni odnos se kod tih životinja odvija glavom prema dole. Ženke kote uglavnom jednom godišnje jedno mladunče. Skotne ženke često se odvajaju od mužjaka i tvore skupine u kojima podižu podmladak. Velešišmiši su relativno dugovječni, doživljavaju i do 30 godina.
Veliki broj vrsta velešišmiša se smatra ugroženim. Glavni je razlog uništavanje njihovog okoliša krčenjem šuma. Pored toga, mnoge su vrste na malim otocima endemske, pa su zbog toga naročito osjetljive na smetnje u svom okolišu. Neke vrste ljudi smatraju štetočinama jer se hrane voćem s plantaža ili ih love radi mesa. Prema IUCN ( International Union for Conservation of Nature and Natural Resources), osam vrsta je izumrlo, a još 22 vrste se smatraju ugroženim ili jako ugroženim.
Dugo vremena su se znanstvenici sporili oko toga, da li su sitnošišmiši i velešišmiši monofilijske grupe, što znači da li su se razvili od zajedničkih predaka, ili su primjer konvergentne evolucije. Danas preteže mišljenje da su monofilijske grupe.
Tradicionalno velešišmiši su se dijelili na dvije potporodice: prave velešišmiše (Pteropodinae) i nasuprot njima grupa manjih životinja koje obilježavaju dugački jezici i hrane se pretežno nektarom. Nazvani su velešišmiši dugog jezika (Macroglossinae). Novija istraživanja su pokazala, da takva podjela nije ispravna.
O unutrašnjoj sistematici još uvijek nije zauzet jedinstveni stav. Podjela na grupe vrsta koja se ovdje navodi zasniva se pretežno na Kate E. Jones među ostalim A Phylogenetic Supertree of Bats [1]. Grupe su prilično proizvoljno sačinjene i ne treba ih smatrati konačnim stavom znanosti.
Povijest razvoja velešišmiša može se sažeti sljedećim dijagramom:
Velešišmiši (Pteropodidae) |--N.N. | |--dugonosi velešišmiši (Nyctimenini) | |--kratkonosi velešišmiši (Cynopterini) | `--N.N. |--N.N. | |--rozetni velešišmiši (Rousettini) | `--epoletirani velešišmiši (Epomophorini) | `--Pteropodinae |--velešišmiši dugog jezika (Macroglossini) `--N.N. |--šiljozubi velešišmiši (Harpyionycterini) `--N.N. |--gololeđi velešišmiši (Dobsoniini) `--pravi velešišmiši (Pteropodini)
Velešišmiši (Pteropodidae) su porodica sisavaca iz reda šišmiša (Chiroptera). Oni su jedina porodica podreda Megachiroptera. Čini ju 40 rodova s nepunih 200 vrsta.
Codot adalah nama umum bagi jenis-jenis kelelawar pemakan buah. Codot, bersama dengan kalong, nyap, paniki dan sebangsanya, membentuk suku Pteropodidae, subordo Megachiroptera (kelelawar besar). Dalam bahasa Inggris, kelompok ini diistilahkan sebagai fruit bats atau old world fruit bats.
Kelompok kelelawar besar (Megachiroptera), tak seperti namanya, tidak selalu bertubuh besar. Kelelawar besar yang terkecil memiliki panjang tubuh sekitar 6 cm; jadi, lebih kecil dari beberapa jenis kelelawar kecil (Microchiroptera) yang berbadan besar.
Sebagian besar kelelawar buah (yakni 24 dari total 42 marga) memang bertubuh relatif kecil, dengan panjang lengan bawah kurang dari 70 mm. Akan tetapi Megachiroptera terbesar, yakni kalong kapauk (Pteropus vampyrus), bisa mencapai berat 1.500 gram, bentangan sayap hingga 1.700 mm, dan lengan bawah sekitar 228 mm[1].
Kebanyakan bangsa codot memiliki mata yang besar, yang memungkinkan hewan tersebut melihat dalam suasana kurang cahaya di hutan, pada saat senja atau dini hari. Indra penciumannya pun bekerja dengan sempurna, membantunya menemukan buah-buah yang telah masak di kejauhan. Dan, berlawanan dengan kelelawar pemakan serangga (Microchiroptera), kelelawar buah tidak menggunakan ekholokasi untuk memandu gerakannya, kecuali anggota marga Rousettus.
Walaupun kelelawar secara umum dapat ditemukan di seluruh dunia, codot hanya ditemukan di daerah-daerah tropis di Asia, Afrika dan Oceania.
Bangsa codot umumnya memakan bagian tumbuh-tumbuhan: buah-buahan, bunga, nektar, serbuk sari, dan juga dedaunan. Ada yang berspesialisasi memakan nektar dan serbuk sari (nektarivora, misalnya Eonycteris, Macroglossus, Syconycteris), namun kebanyakan memakan kombinasi dari buah-buahan dengan bunga, nektar, atau dedaunan (frugivora).[1]
Meskipun kadang-kadang dianggap sebagai hama, codot berperan penting sebagai pemencar biji aneka tetumbuhan, terutama di hutan hujan tropika. Kelelawar ini hanya memakan daging buah yang dikunyah-kunyah untuk diambil cairannya, sementara serabut buah dan bijinya dibuang. Codot biasanya tidak memakan buah di pohonnya, melainkan dibawanya ke pohon lain atau tenggeran yang lain yang dianggap aman dan memakannya di situ. Tenggeran ini bisa berjarak hingga 100–200 m dari pohon buahnya, sehingga secara tidak sengaja codot telah memencarkan biji buah-buahan makanannya itu.[1] Tenggeran semacam itu, yang ditandai oleh banyaknya kotoran kelelawar dan sampah serabut dan biji buah-buahan di bawahnya, acap kali dijumpai pula di bawah atap selasar gedung atau emperan rumah yang agak terasing.
Kelelawar nektarivor diketahui pula bertindak sebagai penyerbuk (polinator) bunga-bunga yang dikunjunginya. Jenis-jenis codot nektar sejauh ini tercatat mengunjungi 141 spesies tumbuhan untuk memakan nektar dan serbuk sari, beberapa di antaranya merupakan pohon-pohon yang ekonomis penting seperti durian (Durio), kapok (Ceiba), petai (Parkia), dan lain-lain.[2].
Hubungan timbal balik yang saling menguntungkan antara kelelawar dan tetumbuhan ini tergolong ke dalam simbiosis mutualisma, yang disebut kiropterofili (chiropterophily).
Suku Pteropodidae dibagi menjadi dua anak-suku (subfamilia) yang seluruhnya beranggota sekitar 188 spesies, dalam 43 marga:
Suku PTEROPODIDAE
|month= yang tidak diketahui akan diabaikan (bantuan); Parameter |coauthors= yang tidak diketahui mengabaikan (|author= yang disarankan) (bantuan)
Codot adalah nama umum bagi jenis-jenis kelelawar pemakan buah. Codot, bersama dengan kalong, nyap, paniki dan sebangsanya, membentuk suku Pteropodidae, subordo Megachiroptera (kelelawar besar). Dalam bahasa Inggris, kelompok ini diistilahkan sebagai fruit bats atau old world fruit bats.
Gli Pteropodidi (Pteropodidae Gray, 1821) sono una famiglia di pipistrelli, l'unica del sottordine dei Megachirotteri. Le specie appartenenti a questa famiglia sono comunemente note come volpi volanti, pipistrelli della frutta e rossetti.
Questa famiglia comprende pipistrelli con la lunghezza dell'avambraccio tra i 45 mm di Balionycteris maculata ed i 220 mm di Pteropus vampyrus, considerato il pipistrello più grande del pianeta. Il peso varia dai 15 g di Balionycteris maculata a oltre 1,6 kg di Pteropus neohibernicus.
Il carattere distintivo della famiglia è l'aspetto semplice del padiglione auricolare, il cui margine esterno forma un anello completo. Non è presente alcuna foglia nasale, né particolari formazioni carnose sulle labbra. Gli occhi sono grandi, con una funzione visiva sviluppata, utile sia per il volo che per cercare il cibo. Il muso è generalmente allungato, e dona a questi chirotteri l'aspetto di una piccola volpe. L'ecolocazione, è presente soltanto in maniera rudimentale nei membri del genere Rousettus e forse anche in Nyctimene e Paranyctimene. L'olfatto è ben sviluppato, utilizzato principalmente per riconoscere le diverse specie di frutti e fiori, fonte principale della loro dieta. In diverse specie le narici hanno una forma tubulare e divergente. Questa caratteristica è estremizzata in Nyctimene e Paranyctimene.
C'è dimorfismo sessuale. I maschi sono spesso più grandi delle femmine, hanno di solito ghiandole odorifere sui lati del collo e canini più sviluppati. In alcune specie africane sono presenti una laringe ingrossata e delle particolari sacche faringee, utilizzate per produrre suoni caratteristici durante le stagioni riproduttive. Le membrane alari sono solitamente attaccate sui fianchi del corpo. In alcune specie l'attaccatura è lungo la spina dorsale, dando l'impressione di una schiena priva di peli. Il secondo dito dell'arto superiore è abbastanza mobile, ha 3 falangi ed è fornito solitamente di un artiglio. Le altre tre dita hanno 2 falangi ciascuna. La membrana interfemorale è poco sviluppata, limitata ad una banda lungo gli arti inferiori, connessa con il piede tramite il calcar. La coda è libera, non inserita nell'uropatagio e in alcune specie è del tutto assente. Soltanto in Notopteris è ben sviluppata e più lunga dell'arto inferiore.
Sono principalmente gregarie. Formano colonie numerose. Alcune specie, limitate a diverse isole remote, vivono solitariamente o in piccoli gruppi. Molte specie vivono sugli alberi nelle foreste primarie e secondarie, oppure vicino ai centri abitati, altre invece sono prevalentemente cavernicole. Solitamente sono attive al crepuscolo, quando abbandonano i siti dove riposano per recarsi nelle foreste o nelle piantagioni per mangiare. Non sono rare però specie prevalentemente diurne.
La dieta consiste principalmente di frutti e fiori di specie tropicali. Alcuni generi sono adattati a succhiare il nettare ed il polline tramite una lingua lunga ed estensibile. Favoriscono, con la dispersione dei semi non ingeriti e con il trasferimento di polline tramite il muso, alla rigenerazione di molte specie vegetali della foresta tropicale, particolarmente i Baobab del genere Adansonia e gli alberi del genere Kigelia.[1] Nello stomaco di alcune specie di Nyctimene sono stati trovati resti di piccoli insetti. Non è chiaro se la loro ingestione sia stata involontaria oppure facciano parte integrante della loro alimentazione.
La maggior parte degli Pteropodidi danno alla luce un piccolo all'anno. È presente una stagione riproduttiva nella maggior parte delle specie. La maturità sessuale viene raggiunta prima dell'anno di vita. Le femmine hanno un solo paio di mammelle, all'altezza del torace, i maschi hanno il pene simile ad alcuni primati. È stato osservato in almeno due specie l'allattamento dei piccoli da parte dei maschi. Individui in cattività sono vissuti fino a 30 anni.
Le specie di questa famiglia vivono nella zona tropicale del Vecchio Mondo. Sono diffusi nell'Africa subsahariana, nel Vicino Oriente, la Penisola Arabica meridionale, il Subcontinente Indiano, diverse isole dell'Oceano indiano, l'Indocina, la Cina meridionale, l'Indonesia, le Filippine fino alle isole Ryūkyū, le coste dell'Australia, la Melanesia fino a raggiungere le isole più remote della Polinesia, dove sono gli unici mammiferi autoctoni. Vivono principalmente nelle foreste primarie e secondarie. Diverse specie sono tolleranti alla presenza umana, popolando giardini, piantagioni ed anche città. Alcune specie sono adattate agli ambienti montani.
La suddivisione della famiglia è stata per molti anni soggetta a revisioni e miglioramenti, considerando anche gli ultimi studi filogenetici.[2] La classificazione di Andersen, con gli adattamenti più evidenti sorretti dalle ultime scoperte, rimane tuttora valida, dividendo la famiglia in otto sottofamiglie:
Non è ancora chiara la linea evolutiva di questa famiglia. Generalmente si considera che tutti i Chirotteri abbiano un unico progenitore. Teorie alternative propongono l'ipotesi che la famiglia si sia evoluta dai primati, e abbia acquisito le capacità di volare per convergenza evolutiva. Il fossile più antico, Archaeopteropus, rinvenuto in Veneto, risale all'Oligocene inferiore. Dai ritrovamenti effettuati, gli Pteropodidi risultano presenti in Africa dal Miocene inferiore, nel Madagascar ed in Indonesia dal Pleistocene, mentre nel resto dell'Areale odierno sono presenti soltanto in epoca recente.[3]
Gli Pteropodidi possono essere veicoli di numerosi agenti patogeni sia per l'uomo che per gli animali domestici. Ricercatori hanno isolato il virus Ebola in almeno tre specie africane.[4] Gli animali infettati risultavano portatori sani, privi di qualsiasi sintomo. Nel 2007, inoltre, il virus Marburg è stato individuato in esemplari di Rousettus aegyptiacus.[5] In Asia alcuni studi eseguiti nel biennio 2009-2010 hanno evidenziato la presenza di Lyssavirus e Henipavirus (in particolare l'Hendra Virus e il Nipah Virus) in alcune specie di Pteropus.[6][7]
Gli Pteropodidi (Pteropodidae Gray, 1821) sono una famiglia di pipistrelli, l'unica del sottordine dei Megachirotteri. Le specie appartenenti a questa famiglia sono comunemente note come volpi volanti, pipistrelli della frutta e rossetti.
Megachiroptera sunt subordo mammalium ordinis Chiropterorum et eius sola familia, Pteropodidae. Quae animalia volantia in regionibus tropicis subtropicisque Eurasiae, Africae, Oceaniae reperiuntur.[1][2][3] Chiropteris insectivoris maiora sunt, atque echolocatione non navigant, nonnullis generibus exceptis. Herbivora sunt, qui ad cibum inveniendum visu odoratuque innituntur.[4]
Familia Pteropodidarum in septem subfamilias digeritur, quibus sunt 186 species exstantes, in 44–46 generibus positae:
Familia Pteropodidae
Megachiroptera sunt subordo mammalium ordinis Chiropterorum et eius sola familia, Pteropodidae. Quae animalia volantia in regionibus tropicis subtropicisque Eurasiae, Africae, Oceaniae reperiuntur. Chiropteris insectivoris maiora sunt, atque echolocatione non navigant, nonnullis generibus exceptis. Herbivora sunt, qui ad cibum inveniendum visu odoratuque innituntur.
Vaisėdžiai šikšnosparniai (lot. Pteropodidae, angl. Old World large fruit bats, Fruit eating bats, Flying foxes, vok. Flughunde) – šikšnosparnių šeima.
Gyvūnų dydis 5-40 cm, svoris 15-900 g.
Šeimoje 42 gentys, apie 170 rūšių.
Pošeimis. Skraidančiosios lapės (Pteropodinae)
Pošeimis. Ilgaliežuviai vaisėdžiai šikšnosparniai (Macroglossinae)
Keluang merujuk kepada haiwan mamalia dalam keluarga haiwan kelawar yang dipanggil Pteropodidae. Di Malaysia, ia lazimnya digunakan bagi merujuk kepada spesies khusus Pteropus vampyrus.
Keluang ialah haiwan berdarah panas, dalam kumpulan kelas mamalia.
Sebagaimana haiwan mamalia lain, Keluang membiak dengan beranak.
Keluang merujuk kepada haiwan mamalia dalam keluarga haiwan kelawar yang dipanggil Pteropodidae. Di Malaysia, ia lazimnya digunakan bagi merujuk kepada spesies khusus Pteropus vampyrus.
Vleerhonden (Pteropodidae), ook wel vliegende honden of grote vleermuizen genoemd, zijn een familie uit de orde van de vleermuizen. De familie telt bijna 200 soorten in ongeveer 45 geslachten.
De spanwijdte van vleerhonden varieert tussen 24 cm en 180 cm, met een gewicht van bijna een kilogram voor de grootste soorten zoals de kalong. De kleinste soorten verschillen qua grootte nauwelijks van de vleermuissoorten die niet tot deze familie behoren; er zijn soorten die tussen de 15 en 20 gram wegen zoals de kleine epaulettenvleerhond.
Vleerhonden danken hun naam aan hun typerende kop, die overeenkomsten vertoont met die van een hond of vos. Ze hebben spitse oren en relatief lange nekharen.
Vleerhonden hebben relatief grote ogen aan de voorkant van hun kop, zodat ze zien met een stereoscopisch beeld. Daardoor kunnen ze de afstand precies inschatten. Omdat ze niet op jacht hoeven, zoals de andere vleermuizen, missen de meeste vliegende honden het orgaan dat echolocatie mogelijk maakt. Het zijn nachtdieren die zich oriënteren middels hun gezichts- en reukvermogen.
Vleerhonden komen voor in Afrika, Azië en Australië. Ze leven in tropische en subtropische gebieden in bosrijke gebieden. Ze komen zeer ver naar het oosten voor in de Grote Oceaan, zo is Pteropus tonganus op de Cookeilanden het oostelijkste zoogdier vanuit Azië.
De meeste vleerhonden zijn frugivoor. Grote vleerhondengroepen kunnen schadelijk zijn voor mango- of bananenplantages. De kleinere soorten uit de onderfamilie Macroglossinae doen zich tegoed aan nectar en stuifmeel.
De voortplantingsperiode is in de maanden februari en maart. Na een zwangerschap van 6 maanden wordt er één of hooguit twee jongen geboren. Bijzonder aan deze familie is dat de zogende vrouwtjes in aparte groepen bij elkaar zitten. Een maand lang blijft het jong bij zijn moeder, maar na deze periode zal ze het jong achterlaten in de verblijfplaats en alleen op zoek gaan naar eten. Na twee maanden kan het jong zelf vliegen, maar het zal nog een maand duren voordat het mee gaat om eten te zoeken. Tussen de 4 en 6 maanden is hij geheel onafhankelijk, maar hij wordt pas na 18 maanden vruchtbaar.
Natuurlijke vijanden van vleerhonden zijn arenden, grote uilen, boomslangen en varanen.
De mens vormt een grotere bedreiging, vooral in fruitteeltgebieden. De boeren doden ze of ze worden vergiftigd. Er wordt ook jacht op ze gemaakt vanwege het vlees.
Er zijn aanwijzingen dat binnen populaties van bepaalde vleerhondsoorten dragers zijn van ziekteveroorzakende bacteriën en virussen die bij mensen en huisdieren dodelijke ziekten veroorzaken. De vleerhonden zelf vertonen dan geen symptomen van die ziekte, maar hebben wel de antistoffen in hun bloed.
Tussen 2001 en 2003 werden vleerhonden onderzocht op de aanwezigheid van het ebolavirus. Er werden drie soorten vleerhonden gevonden die antistoffen tegen dit virus hadden. De soorten die positief scoorden waren: hamerkopvleerhond (Hypsignathus monstrosus), Franquetvleerhond (Epomops franqueti) en de kraagvleerhond (Myonycteris torquata).[1] Het Marburgvirus werd in 2007 gevonden in de nijlroezet (Rousettus aegyptiacus).[2]
In oudere indelingen worden de vleerhonden meestal in een aparte onderorde tegenover de andere vleermuizen (kleine vleermuizen, Microchiroptera) geplaatst. Er is ooit gesuggereerd dat vleerhonden verwant zouden zijn aan de vliegende katten en de primaten. Echter, volgens modern moleculair genetisch onderzoek (DNA-analyses) zijn de vleerhonden nauw verwant aan onder andere de vleermuisfamilies hoefijzerneuzen (Rhinolophidae) en bladneusvleermuizen van de Oude Wereld (Hipposideridae). Zij maken nu deel uit van dezelfde onderorde de Pteropodiformes. De overige vleermuissoorten behoren tot een zogenaamde zustergroep, de Vespertilioniformes.
Ook de indeling binnen de familie is verre van duidelijk. De meest gebruikte indeling was er vanouds een waarin een aantal nectaretende geslachten uit Afrika, Zuidoost-Azië en Australië, zoals Megaloglossus, Notopteris, Melonycteris en Eonycteris, in een aparte onderfamilie Macroglossinae werden geplaatst. De resterende groep werd meestal als één onderfamilie Pteropodinae geizen, maar werd soms ook ingedeeld in verschillende onderfamilies, zoals de Nyctimeninae en de Epomophorinae. Volgens fylogenetische analyses gebaseerd op zowel DNA als morfologie is zowel de Pteropodinae als de Macroglossinae echter geen monofyletische groep, zodat nu een nieuwe indeling, met veel meer onderfamilies, gebruikt wordt. Deze indeling is hieronder gegeven.
De familie omvat de volgende onderfamilies, geslachtengroepen (tribus), geslachten en kenmerkende soorten
(voor volledige soortenlijst klik op link van geslacht)
Vleerhonden (Pteropodidae), ook wel vliegende honden of grote vleermuizen genoemd, zijn een familie uit de orde van de vleermuizen. De familie telt bijna 200 soorten in ongeveer 45 geslachten.
Flygehundar (Pteropodidae), på eng.: fruit bats, old world fruit bats, flying foxes eller megabats, er den eine av dei to gruppene av flaggermus. Den andre gruppa er småflaggermus. Pteropodidae er også ein familie.
Dei fleste (men ikkje alle) artane er større enn småflaggermus. Dei minste er 6 cm lange, dei største blir 40 cm lange og har eit vengespenn på 1,5 m. Slike kjemper kan bli over eitt kilo tunge. Dei fleste flygehundar har store auge som gjer at dei kan orientere seg i halvmørke og i holer. Flygehundar har svært god luktesans. I motsetnad til småflaggermysene, brukar ikkje flygehundane ekkolokalisering. Unntaket er grotteflygehundar (slekta Rousettus), som brukar høgfrekvente klikkelydar til å orientere seg i holer.
Flygehundar er utbreidde i tropiske og subtropiske strøk frå Afrika til Aust-Asia og Australia. Flygehundar lever av frukt og blomenektar. Ofte blir frukta most, og berre fruktsafta blir konsumert. Tennene er tilpassa til å bite gjennom harde fruktskal. Store flygehundar må lande for å ete fruktene, medan dei mindre artane er i stand til å stå stille i lufta framfor ein blom eller frukt. Mange flygehundar hjelper til med å spreie pollen og frø.
Familien Pteropodidae er delt inn i sju underfamiliar med 186 total bevarte artar, representert med 44-46 slekter;
FAMILIEN PTEROPODIDAE
Merk: Engelske tittelar er inkludert.
Flygehundar (Pteropodidae), på eng.: fruit bats, old world fruit bats, flying foxes eller megabats, er den eine av dei to gruppene av flaggermus. Den andre gruppa er småflaggermus. Pteropodidae er også ein familie.
Dei fleste (men ikkje alle) artane er større enn småflaggermus. Dei minste er 6 cm lange, dei største blir 40 cm lange og har eit vengespenn på 1,5 m. Slike kjemper kan bli over eitt kilo tunge. Dei fleste flygehundar har store auge som gjer at dei kan orientere seg i halvmørke og i holer. Flygehundar har svært god luktesans. I motsetnad til småflaggermysene, brukar ikkje flygehundane ekkolokalisering. Unntaket er grotteflygehundar (slekta Rousettus), som brukar høgfrekvente klikkelydar til å orientere seg i holer.
Flygehundar er utbreidde i tropiske og subtropiske strøk frå Afrika til Aust-Asia og Australia. Flygehundar lever av frukt og blomenektar. Ofte blir frukta most, og berre fruktsafta blir konsumert. Tennene er tilpassa til å bite gjennom harde fruktskal. Store flygehundar må lande for å ete fruktene, medan dei mindre artane er i stand til å stå stille i lufta framfor ein blom eller frukt. Mange flygehundar hjelper til med å spreie pollen og frø.
Flygehunder (Pteropodidae) er den ene av de to gruppene av flaggermus, den andre er småflaggermus,. De fleste (men ikke alle) artene er større enn småflaggermus: De minste er 6 cm lange, de største blir 40 cm lange og har et vingespenn på 1,5 m. Disse kjempene kan bli over et kilo tunge. De fleste flygehunder har store øyne som gjør at de kan orientere seg i halvmørke og i huler. Luktesansen er utmerket. I motsetning til småflaggermusene, bruker flygehundene ikke ekkolokalisering. Unntaket er grotteflygehunder (slekten Rousettus), som bruker høyfrekvente klikkelyder for å orientere seg i huler.
Flygehunder er utbredd i tropiske og subtropiske strøk fra Afrika til Øst-Asia og Australia. Rosettflaggermus (Rousettus aegyptiacus) finnes nordover til Kypros og Sør-Tyrkia.
Flygehunder lever av frukt og nektar fra blomster. Ofte blir frukten most, og bare fruktsaften blir konsumert. Tennene er tilpasset til å bite gjennom harde fruktskall. Store flygehunder må lande for å ete fruktene, mens de mindre artene er i stand til å stå stille i luften foran en blomst eller frukt.
Mange flygehunder hjelper til med å spre pollen og frø.
Flygehunder (Pteropodidae) er den ene av de to gruppene av flaggermus, den andre er småflaggermus,. De fleste (men ikke alle) artene er større enn småflaggermus: De minste er 6 cm lange, de største blir 40 cm lange og har et vingespenn på 1,5 m. Disse kjempene kan bli over et kilo tunge. De fleste flygehunder har store øyne som gjør at de kan orientere seg i halvmørke og i huler. Luktesansen er utmerket. I motsetning til småflaggermusene, bruker flygehundene ikke ekkolokalisering. Unntaket er grotteflygehunder (slekten Rousettus), som bruker høyfrekvente klikkelyder for å orientere seg i huler.
Flygehunder er utbredd i tropiske og subtropiske strøk fra Afrika til Øst-Asia og Australia. Rosettflaggermus (Rousettus aegyptiacus) finnes nordover til Kypros og Sør-Tyrkia.
Flygehunder lever av frukt og nektar fra blomster. Ofte blir frukten most, og bare fruktsaften blir konsumert. Tennene er tilpasset til å bite gjennom harde fruktskall. Store flygehunder må lande for å ete fruktene, mens de mindre artene er i stand til å stå stille i luften foran en blomst eller frukt.
Rudawkowate[2] (Pteropodidae) – rodzina ssaków z rzędu nietoperzy (Chiroptera), obejmująca ok. 170 gatunków. Mają świetny wzrok i dobry węch. Żywią się owocami, kwiatami, liśćmi, także owadami; żyją pojedynczo lub w bardzo licznych koloniach.
Do rodziny należą następujące rodzaje[2][3]:
Rudawkowate (Pteropodidae) – rodzina ssaków z rzędu nietoperzy (Chiroptera), obejmująca ok. 170 gatunków. Mają świetny wzrok i dobry węch. Żywią się owocami, kwiatami, liśćmi, także owadami; żyją pojedynczo lub w bardzo licznych koloniach.
Pteropodidae é uma família de morcegos. O grupo inclui 143 espécies de morcegos de grandes dimensões e hábitos alimentares frugívoros e nectarívoros. São conhecidos pelo nome genérico de morcego-da-fruta ou raposa-voadora, e são nativos das regiões tropicais da Ásia, África e Oceania. A família Pteropodidae é a única da subordem Megachiroptera.
Tradicionalmente a família Pteropodidae é dividida em duas subfamílias: Pteropodinae e Macroglossinae.
Pteropodidae é uma família de morcegos. O grupo inclui 143 espécies de morcegos de grandes dimensões e hábitos alimentares frugívoros e nectarívoros. São conhecidos pelo nome genérico de morcego-da-fruta ou raposa-voadora, e são nativos das regiões tropicais da Ásia, África e Oceania. A família Pteropodidae é a única da subordem Megachiroptera.
Cephalotidae Gray, 1821
Harpyidae H. Smith, 1842
Leteče lisice ali leteči psi (znanstveno ime Pteropodidae) so družina netopirjev, ki jo tradicionalno pojmujemo kot edino družino podreda velikih oz. orjaških netopirjev (Megachiroptera). V to družino spada največja vrsta netopirjev na svetu, kalong ali leteči pes, ki prek prhuti meri skoraj 2 m, in nekaj drugih velikih vrst, najmanjši predstavniki pa dosegajo le nekajcentimetrske velikosti. V nasprotju z malimi netopirji so rastlinojedi in, razen izjem, ne uporabljajo eholokacije. Imajo glavo, podobno pasji, po čemer so dobili tudi ime.[2][3]
Obsegajo velik razpon velikosti, od nekajcentimetrskih do metrskih. Največja vrsta, kalong, ima razpon prhuti 1,7 m,[4] na drugi strani pa je vrsta Balionycteris maculata, ki je z razponom prhuti 28 cm in telesno težo okrog 13 g[5] manjša od nekaterih vrst malih netopirjev. Večinoma imajo glavo z dolgim gobcem in velikimi očesi ter uhlji, s čemer spominjajo na pse, za vrste, ki se prehranjujejo z nektarjem, pa je značilen tudi dolg in zapleteno grajen jezik.[2]
Trup ima močno oprsje z letalnimi mišicami, rep je pri večini vrst zakrnel. Prekriva ga kratka dlaka, največkrat v rjavih ali sivih odtenkih, pri čemer imajo samci mnogih vrst za razliko od samic kontrastne vzorce po obrazih. Samci so običajno tudi večji od samic. Posebnost letečih lisic je dodaten krempelj na sprednji okončini, zadnji par okončin pa ima kot pri ostalih netopirjih prste z dolgimi kremplji, prilagojene za visenje z glavo navzdol.[2]
Za razliko od ostalih netopirjev ne uporabljajo eholokacije, namesto tega se zanašajo na dobro razvita vid in voh. Le predstavniki rodu Rousettus uporabljajo primitivnejšo obliko eholokacije, s tleskanjem z jezikom namreč ustvarjajo kratke zvoke in se orientirajo po odmevih pri iskanju počivališč v jamah.[6]
Predstavniki so razširjeni po tropskih in subtropskih predelih Afrike, Evrazije in severne Avstralije ter otokih Indijskega in Tihega oceana. Mnogo je otoških endemitov.[2]
Večinoma živijo v primarnih gozdovih, le nekaj vrst je prisotnih v savani, kjer za počivališča uporabljajo grme in nizka drevesa. Vezani so predvsem na prisotnost hranilnih rastlin, so namreč skoraj izključno rastlinojedi, posamezne vrste pa so se specializirale na prehranjevanje s plodovi, nektarjem ali cvetovi.[2] Le izjeme so tudi delno žužkojede.[7]
Obiskujejo različne vrste rastlin in so sposobni letenja na daljše razdalje, zato imajo pomembno ekološko vlogo pri opraševanju in raznašanju semen. Ljudje jih lovijo za meso in odganjajo iz nasadov sadnih dreves, kjer lahko delajo škodo; lov in izguba habitata sta med najpomembnejšimi dejavniki ogroženosti. V naravi prežijo nanje večji sesalci, ptiči in plazilci.[2]
Tradicionalna sistematika, ki temelji predvsem na anatomskih značilnosti, deli netopirje na velike oz. orjaške netopirje, kamor uvršča izključno leteče lisice, in male netopirje z vsemi ostalimi družinami. Vendar pa sodobne filogenetske raziskave, ki upoštevajo tudi molekularne znake, kažejo, da so nekatere družine malih netopirjev, kot so podkovnjaki, bolj sorodne letečim lisicam kot drugim malim netopirjem. Zato novejša sistematika predlaga delitev na jinopirje (Yinpterochiroptera, kamor bi spadale leteče lisice) in jangopirje (Yangochiroptera).[8]
Glede na to, da so leteče lisice očitno bližnje sorodne podkovnjakom, ki imajo zelo zapleteno eholokacijo, domnevajo, da je pri njih skozi evolucijo sekundarno prišlo do izgube te sposobnosti, nato pa neodvisno znova do pridobitve pri rodu Rousettus, a z drugačnim mehanizmom (tleskanje z jezikom namesto uporabe glasilk). Druga možnost je, da so jinopirji razen letečih lisic in jangopirji razvili eholokacijo ločeno, vendar so tudi fosilni netopirji iz eocena imeli ustrezne strukture za eholokacijo, tako da sklepajo, da je bila razvita pri skupini enotno skozi vso njeno evolucijsko zgodovino.[9]
V družino uvrščamo 186 danes živečih vrst, ki so združene v 42 rodov. Različni avtorji nadalje združujejo rodove v dve do pet poddružin, ki pa jih sodobni podatki (predvsem molekularni) ne podpirajo v zadostni meri, zato čakajo na revizijo.[1]
Slovensko ime se, podobno kot imena v drugih jezikih, nanaša na obliko glave teh živali. Prvi ga je zanje uporabil že Fran Erjavec. Drugi avtorji so predlagali tudi ime »plodojedi prhutarji«, ki pa se ni uveljavilo.[8]
|url= (pomoč) Leteče lisice ali leteči psi (znanstveno ime Pteropodidae) so družina netopirjev, ki jo tradicionalno pojmujemo kot edino družino podreda velikih oz. orjaških netopirjev (Megachiroptera). V to družino spada največja vrsta netopirjev na svetu, kalong ali leteči pes, ki prek prhuti meri skoraj 2 m, in nekaj drugih velikih vrst, najmanjši predstavniki pa dosegajo le nekajcentimetrske velikosti. V nasprotju z malimi netopirji so rastlinojedi in, razen izjem, ne uporabljajo eholokacije. Imajo glavo, podobno pasji, po čemer so dobili tudi ime.
Flyghundar (Pteropodidae) är en familj i ordningen fladdermöss (Chiroptera) och den enda familjen i underordningen fruktfladdermöss. Familjen består av omkring 40 släkten med cirka 200 arter.
Flyghundar lever i varma regioner av Afrika, Asien, Australien och Oceanien men saknas i Amerika och Europa med undantag för halsbandsflyghund. Flyghundar livnär sig av frukter, nektar och pollen. I familjen finns de största fladdermössen men inte alla arter blir större än de största småfladdermössen. På grund av skogsavverkningar och jakt är flera arter hotade.
Arterna i denna familj lever i tropiska och subtropiska områden. De förekommer i stora delar av Afrika (inklusive Madagaskar och Seychellerna), i södra Asien, Australien och västra Oceanien. Räknas Cypern till Europa, så är den där förekommande halsbandsflyghunden (Rousettus aegyptiacus) den enda europeiska arten. Flyghundar saknas i Amerika, i nästan hela palearktiska regionen, i Afrikas nordvästra del och i sydvästra Australien.[1]
I familjen flyghundar finns de största fladdermössen. Den största vingbredden har arter i släktena Pteropus och Acerodon med upp till 170 centimeter. Några arter har en kroppslängd (huvud och bål) på upp till 40 centimeter.[2] Det finns dock arter som inte är större än de i andra fladdermössfamiljer med en kroppslängd omkring 5 centimeter.[1] Vikten varierar därför mellan 15 och 1500 gram.[2] Hos de flesta flyghundar, med undantag av släktet Notopteris, är svansen väldigt kort eller saknas helt.[2] Pälsens färg varierar mellan arterna men är oftast brunaktig. Hos flera arter har hannarna körtlar vid halsen som är täckta av hår i annan färg. Större storleksskillnader mellan hannar och honor förekommer hos vissa släkten.[2]
Till kroppsbyggnaden liknar flyghundar andra fladdermöss. Vinghuden täcker fyra av fingrarna och räcker nästan fram till fötterna. Många flyghundar har, i motsats till småfladdermöss, en förlängd klo vid pekfingret. Klon vid tummen som är typisk för de flesta fladdermössen finns likaså.[2] Öronen är små och ofta ovala. Nosen är kraftigt utsträckt och hundlik, något som givit upphov till familjens namn på svenska. De har bra synförmåga med sina stora väl utvecklade ögon och utmärkt luktsinne. Bara släktet Rousettus använder dessutom ekolokalisering för att orientera sig.[2]
De flesta flyghundar vilar och söker sin föda i städsegröna skogar. Bara några arter vilar i buskar eller träd som finns i savanner. Flera flyghundar uppsöker havsområden där de dricker saltvatten. I saltvattnet finns vissa nödvändiga ämnen som saknas i födan.[1]
Flyghundar är huvudsakligen aktiva under gryningen och natten. När de letar efter föda flyger de ofta långa sträckor, större arter cirka 15 kilometer.[2] Dagtid uppsöker de träd eller andra skyddade platser och sover. De hänger då med huvudet nedåt och griper tag i en trädgren eller liknande med tårna. Stora flyghundar bildar vanligen kolonier vid viloplatsen medan små flyghundar oftast vilar ensamma.[2] Flyghundar går inte i ide på grund av det varma klimat de lever i.
Naturliga fiender utgörs av rovfåglar, rovdjur eller större kräldjur.[1]
Alla flyghundar, även de största, lever bara av växtämnen som nektar, pollen, frukt och blommor. Några arter är viktiga för vegetationens utveckling. Utöver att sprida frön av uppätna frukter pollinerar vissa arter även vissa växter. Det enda släktet som i sällsynta fall äter insekter är Nyctimene.[2]
De flesta honor föder bara en unge per år men hos vissa släkten sträcker sig parningstiden över hela året. Honor som är dräktiga lämnar hannarna. Efter födelsen lever de ihop med andra honor med ungar.[2] En fördröjd inplantering av det befruktade ägget eller en långsam utveckling av embryot förekommer hos många flyghundar så att födelsen sker under tider med bra utbud av föda (främst regntiden). Ungarna föds vanligen nakna eller de har en sammetslen päls som är mörkare än hos vuxna individer.[1] Efter att honan slutar med digivningen stannar ungarna oftast fyra månader till. De blir könsmogna efter två år eller något tidigare.[1] Flyghundar kan bli upp till 30 år gamla.[2]
På många platser används flyghundarnas avföring som gödsel (guano).[1] I södra Polynesien och i Mikronesien anses flyghundar vara en delikatess.[3] På andra håll anses de istället vara skadedjur.
Ett stort antal arter kategoriseras som hotade. Huvudsakliga orsaken är förstöringen av deras levnadsområde. Det finns även många arter som är endemiska på mindre öar och på detta sätt mycket känsliga för störningar i sin miljö. Ett stort hot mot dessa öpopulationer utgör introducerade arter, exempelvis ormar som avsevärt har decimerat bestånd på ett antal småöar.[1] Några arter betraktas som skadedjur eller jagas för köttets skull.[2] Fem arter kategoriserades 2008 av IUCN som utdöda, medan 68 fick en hotstatus mellan sårbar (VU) och akut hotad (CR).[1]
Flyghundar kan fungera som reservoar för ett antal sjukdomar som kan vara dödliga för människor och husdjur,[4] utan att uppvisa några symtom. Mellan åren 2001 och 2003 testades flyghundar för Ebolavirus och de tre arterna Hypsignathus monstrosus, Epomops franqueti och Myonycteris torquata testades positiva utan att uppvisa några symtom.[4] I en studie 2007 fann man det epidemiska Marburgviruset hos halsbandsflyghund.[5]
I områden där flyghundar jagas för köttets skull kan detta utgöra en smittorisk. På Guam har konsumtionen av flyghundar föreslagits vara en möjlig orsak till sjukdomen Lytico-Bodig disease.[3]
Andra sjukdomar som flyghundar kan sprida är bland annat Australian bat lyssavirus (ABLV), Menanglevirus[6] och Henipavirus, speciellt Hendravirus och Nipahvirus, vilka båda kan vara dödliga för människan. Vissa arter av flyghundar i Australien kan smitta andra arter, såsom hästar och grisar, med Hendravirus respektive Menanglevirus. Människor kan sedan smittas av Hendravirus via kroppsvätskor från hästen,[7] och av Menanglevirus via kroppsvätskor från grisen[6].
Tidigare delades familjen upp i två underfamiljer: Pteropodinae med de egentliga flyghundarna och underfamiljen Macroglossinae med små nektardrickande arter med långsträckt tunga. Nyare studier visade att denna indelning inte stämmer.
Följande lista med åtta undergrupper följer en fylogenetisk studie av Jones et al., 2002[8]. Den saknar de klassiska systematiska indelningsbegreppen för de taxa som ligger mellan familj och släkte. Antalet arter följer Wilson & Reeder, 2005[9]:
Studien av Kate E. Jones undersökte även släktskapet mellan dessa grupper som visas i följande kladogram[8]:
Flyghundar (Pteropodidae) +--N.N. | +--Grupp A | +--Grupp B | +--N.N. +--N.N. | +--Grupp C | +--Grupp D | +--Pteropodinae +--Grupp E +--N.N. +--Grupp F +--N.N. +--Grupp G +--Grupp H
En teori om att flyghundar inte tillhör ordningen fladdermöss, utan istället är flygande primater, lanserades 1986 av den australiensiske forskaren Jack Pettigrew.[10] Med andra ord skulle de vara mer släkt med människor, apor och halvapor. Likheten med fladdermöss skulle istället bero på konvergent evolution. Grunden för teorin var hans forskningar av hjärnan och nervsystem, liksom olikheterna i levnadssätt, såsom kost och flygteknik. Teorin har mött mycket motstånd, men andra neurologiska forskningar har stött teorin.[11] Dock har senare studier av DNA stärkt uppfattningen att flyghundarna tillhör ordningen fladdermöss.[12]
Flyghundar (Pteropodidae) är en familj i ordningen fladdermöss (Chiroptera) och den enda familjen i underordningen fruktfladdermöss. Familjen består av omkring 40 släkten med cirka 200 arter.
Flyghundar lever i varma regioner av Afrika, Asien, Australien och Oceanien men saknas i Amerika och Europa med undantag för halsbandsflyghund. Flyghundar livnär sig av frukter, nektar och pollen. I familjen finns de största fladdermössen men inte alla arter blir större än de största småfladdermössen. På grund av skogsavverkningar och jakt är flera arter hotade.
Büyük yarasalar (Megachiroptera) Yarasalar takımının bir alt takımıdır ve kanat ayaklıgiller (Pteropodidae) familyasını içerir.
Büyük yarasalar alt takımında sınıflandırılan yarasaların hepsi adlandırmanın aksine büyük değildirler. En küçük türünün boyu 6 cm civarındadır ve birçok küçük yarasalar alt takımında bulunan yarasadan küçüktür.[1] En büyük türlerin ise kanat genişliği 1,7 metreye ve ağırlıkları da 1,6 kg'a ulaşır[2]. Bu yarasaların çoğunun gözleri büyüktür ve dolayısıyla alacakaranlıkta ve mağaralarla ormanların içinde görerek de yollarını bulabilirler.
Koku duyuları mükemmeldir. Küçük yarasalar alt takımında bulunan yarasaların aksine büyük yarasalar ekolokasyon kullanmazlar. Tek istisna, yüksek perdeli çıtırtı sesleriyle mağaralarda yolunu bulan Rousettus egyptiacus türüdür.
Büyük yarasalar meyve yiyerek ve çiçeklerden nektar emerek beslenirler. Genellikle meyveleri ezerek yalnızca sularını tüketirler. Dişleri sert meyvelerin kabuklarını ısırabilecek şekilde uyum sağlamıştır.
Meyve yiyen yarasalar yedikleri meyvelerin tohumlarını dışarı tükürdüklerinden bitkilerin üremesine yardımcı olurlar. Nektar emen yarasalar da taşıdıkları polenlerle çiçeklerin üremesinde yardımcıdırlar. Uzun dilleriyle çiçeklerden aldıkları polenleri bir sonraki çiçeğe taşırlar. Bitkiler ile yarasalar arasındaki bu ilişki bir mutualizm örneğidir. Bu ilişkiden yararlanan bitkiler arasında Adansonia cinsinden baobablar ve Kigelia cinsi bitkiler sayılabilir.
Yarasaların tek bir soydan geldiği görüşü büyük yarasalar ve küçük yarasalar olarak iki alt takım hâlinde sınıflandırılmalarında görülmektedir. Bu varsayıma göre yaşayan tüm büyük ve küçük yarasalar uçabilen tek bir atadan evrimleşmişlerdir.
Ancak başka görüşler de bulunmaktadır ve günümüzde de bu konu tartışmalıdır. Örneğin 1980'lerde ve 1990'larda bazı araştırmacılar görsel yolların benzerliğine dayanarak büyük yarasaların primatlara küçük yarasalardan daha yakın akraba olduklarını ve iki grup yarasanın yakınsak evrim yoluyla uçuş yeteneğini kazandıklarını öne sürdüler.[3] Buna karşın son dönemde yapılan genetik araştırmalar, uzun zamandan beri süregelen görüşü, yani tüm yarasaların aynı klâd içinde yer aldığını desteklemektedir.[4][5] Diğer çalışmalar da küçük yarasaların bazı familyalarının (nal burunlu yarasagiller, Rhinopomatidae ve Megadermatidae gibi) evrimsel açıdan diğer küçük yarasalardan çok, büyük yarasalara yakın olduklarını göstermiştir.[4][6]
Kanat ayaklıgiller familyası 186 türü kapsayan 44-46 arası cinsi içeren yedi alt familyaya ayrılmıştır:
FAMILYE PTEROPODIDAE
|tarih= (yardım)KB1 bakım: Birden fazla ad: yazar listesi (link) Büyük yarasalar (Megachiroptera) Yarasalar takımının bir alt takımıdır ve kanat ayaklıgiller (Pteropodidae) familyasını içerir.
Криланові живуть в тропічних і субтропічних регіонах Африки (включаючи Мадагаскар), на Кіпрі (Rousettus aegyptiacus) в Південній та Південно-Східній Азії, Австралії і західній частині Океанії.
Голова і тіло довжиною від 50 до приблизно 400 мм. Хвіст короткий, рудиментарний або відсутній, за винятком Notopteris, в якому він має 10 хребців. Вага дорослих особин варіює від приблизно 15 грам для найменших нектаро- і пилкоїдів до більше 1500 грамів для найбільших їдців фруктів. Ця родина містить найбільших живучих рукокрилих, деякі види Pteropus і Acerodon мають розмах крил 1,7 метра. Хутро до 3 см в довжину, щільне, і різне за кольором, але з переважно відтінків темно-коричневого. Роди Epomophorus, Micropteropus, Epomops, Scotonycteris, Nanonycteris, Hypsignathus, Casinycteris, і Plerotes, зокрема, проявляють вторинні статеві ознакі, у тому числі, у самців, значно більший розмір, є залозисті мішечки з пучками волосся на плечах і великі глоткові мішечки в області грудей. Усі члени родини, крім родів Dobsonia, Eonycteris, Notopteris і Neopteryx мають кіготь на другому пальці на додаток до кігтя на великому пальці, всі члени підряду Microchiroptera не мають кігтя на другому пальці. Зовнішнє вухо Pteropodidae подовжені, овальні, досить прості; краї вуха утворюють повне кільце; у Microchiroptera ж зовнішнє вухо часто є складним. Члени цеї родини мають великі, добре розвинені очі. Зубна формула змінюється від I 2/2, C 1/1, P 3/3, M 2/3 = 34 до I 1/0, C 1/1, P 3/3, M 1/2 = 24.
Тільки рід Rousettus, як відомо, випромінює ультразвук під час польоту, на додаток до використання очей. Решта родів Pteropodidae, як вважають, знаходять шлях візуально, хіба що, можливо, трубконосі Nyctimene і Paranyctimene теж орієнтуватися за допомогою ехолокації.
Криланові активні в основному у вечірній і нічний час, але спостерігаються в польоті й у денний час. Вони часто покидають райони, де фрукти не доступні й часто здійснюють тривалі польоти між їх місцем спочинку і годівлі. Великі види повільні, але потужні летуни, так особини виду Pteropus alecto можуть літати аж 70 км від сідала до місця годівлі. Великі види часто товариські, в той час як дрібні види, як правило, поодинокі. Зокрема, спостерігалась колонія, що містили 100 особин австралійського виду Pteropus scapulatus.
Більшість видів цеї родини знаходять їжу по запаху. Багато, якщо не всі, з них витискають стиглу м'якоть плоду в рот, проковтуючи сік, і випльовуючи більшість з м'якоті і насіння. Проковтнутий продукт харчування проходить через дуже простий травний тракт за дуже короткий проміжок часу, може бути, в середньому півгодини. Члени цієї родини також жують квіти для отримання нектару і соків. Члени підродини Macroglossinae, здається, харчуються в основному нектаром і пилком. Nyclimene іноді включає комах в свій раціон.
Навіть спаровування відбувається догори ногами. Деякі види можуть розмножуватися протягом усього року, але більшість членів цієї родини, ймовірно, мають чітко визначені сезони розмноження. У більшості випадків самиці народжують тільки раз в році, і лише одне дитинча народжується. Вагітні самиці деяких видів утворюють розплідники осторонь від самців, де вони вигодовують своїх дітей. Криланові — відносно довгоживучі тварини, досягаючи в неволі більше ніж 30-річного віку.
Багато криланових є одними з найбільш зникаючих видів. Основною причиною цього є знищення їх місця існування в результаті збезлісення. Багато видів також є ендеміками невеликих островах і тому особливо уразливі до порушення екосистеми. Деякі види вважаються шкідниками, тому що вони їдять фрукти в садах або на них полюють заради м'яса. За даними МСОП 4 види є зниклими, 10 видів знаходиться під критичною загрозою, 17 знаходяться під загрозою, 36 є уразливими, 17 у близькому до уразливого стану, для 21 виду даних недостатньо.
Геологічний діапазон цеї родини включає ранній олігоцен в Європі, від раннього міоцену до тепер в Африці, від плейстоцену до тепер на Мадагаскарі, в Ост-Індії й у інших частинах ареалу.
Họ Dơi quạ (danh pháp khoa học: Pteropodidae) là một họ thuộc Bộ Dơi (Chiroptera). Tên gọi khác của họ này là dơi hoa quả, dơi hoa quả của Cựu Thế giới.[1] Tổng cộng có trên 250 loài. Việt Nam có 11 loài, như dơi chó (Cynopterus sphinx), dơi ngựa Thái Lan (Pteropus lylei). Đây là các loại dơi ăn trái cây có thân hình lớn. Loài nhỏ nhất có chiều dài 6 cm, loài lớn nhất có chiều dài lên đến 40 cm và sải cánh 150 cm. Chúng thường được gọi là cáo bay.
Trong khi loài dơi nhỏ sống khắp các châu lục (trừ châu Nam Cực) thì các loài thuộc họ Dơi quạ chỉ sinh sống ở các khu vực nhiệt đới và bán nhiệt đới thuộc Đông bán cầu: phía đông Địa Trung Hải, Nam Á. Họ dơi này đã không còn xuất hiện ở tây bắc châu Phi và tây nam Úc.[2][3]
Họ Dơi quạ gồm 2 phân họ tuyệt chủng và 7 phân họ tồn tại
Họ Dơi quạ (danh pháp khoa học: Pteropodidae) là một họ thuộc Bộ Dơi (Chiroptera). Tên gọi khác của họ này là dơi hoa quả, dơi hoa quả của Cựu Thế giới. Tổng cộng có trên 250 loài. Việt Nam có 11 loài, như dơi chó (Cynopterus sphinx), dơi ngựa Thái Lan (Pteropus lylei). Đây là các loại dơi ăn trái cây có thân hình lớn. Loài nhỏ nhất có chiều dài 6 cm, loài lớn nhất có chiều dài lên đến 40 cm và sải cánh 150 cm. Chúng thường được gọi là cáo bay.
Крыла́новые (лат. Pteropodidae) — семейство млекопитающих из отряда рукокрылых (Chiroptera) подотряда Yinpterochiroptera (ранее из-за своеобразной морфологии это семейство выделяли в отдельный подотряд Megachiroptera, что не поддерживается современными молекулярно-генетическими и кариологическими данными). Представителей рода Pteropus и близких родов в литературе часто называют летучими лисицами, а представителей рода Rousettus (а иногда и всех крыланов) — летучими собаками. По ряду признаков строения скелета (подвижные ребра, слабо видоизмененные шейные позвонки, наличие когтевой фаланги на втором пальце крыла) и отсутствию (как правило) развитой эхолокации, многие хироптерологи считают крыланов наиболее архаичными из современных рукокрылых[2].
В отличие от летучих мышей, многие крыланы достигают крупных размеров: длины тела до 42 см и размаха крыльев до 1,7 м (летучие лисицы). Однако имеются и мелкие нектаро- и пыльцеядные формы размером всего 5—6 см, с размахом крыльев 24 см. Масса варьирует от 15 до 900 г. Хвост короткий, недоразвитый или отсутствует; только у длиннохвостых крыланов (Notopteris) он относительно длинный. Межбедренная перепонка у большинства видов недоразвита. II палец крыла имеет концевую фалангу и обычно снабжён когтем.
Череп с удлинённым лицевым отделом. Глаза крупные. Крыланы в основном полагаются на зрение и обоняние; способность к эхолокации (так называемой «щелчковой», механизм которой отличен от таковой прочих рукокрылых) найдена только у летучих собак вида Rousettus egyptiacus (хотя, вероятно, присутствует и у других близких видов). Ушная раковина проста, без складок и выраженного козелка, иногда со слабо развитым противокозелком; ее внешний и внутренний края срастаются под отверстием слухового проходя. Трубконосые и карликовые трубконосые крыланы имеют характерные трубчатые ноздри, открывающиеся латерально. Язык покрыт развитыми сосочками; у мелких пыльцеядных видов он очень длинный. Щечные зубы плоскобугорчатые, полностью утратившие характерные для прочих рукокрылых структуры жевательной поверхности, приспособленные к питанию мягкой растительной пищей; всего их от 22 до 38. Кишечник в 4 раза длиннее тела.
Окраска у большинства видов тёмно-бурая, но может быть жёлтой, зеленоватой, с белыми пятнами на крыльях. Характерен половой диморфизм. Он проявляется у самцов в увеличенных клыках и более яркой окраске, в более крупных размерах (пещерные крыланы, биндемы, молотоголовые крыланы, некоторые виды эполетовых крыланов), в наличии железистых плечевых кожных мешков с растущими из них пучками волос (летучие собаки, эполетовые крыланы, биндемы и карликовые эполетовые крыланы, коровьемордые крыланы, крыланы Анхиеты), в наличии крупных глоточных мешков (эполетовые крыланы, молотоголовые крыланы, биндемы).
Представители семейства населяют тропическую и субтропическую зоны Восточного полушария. Распространены от Западной Африки до Филиппин, Самоа и Каролинских островов; на севере ареал семейства доходит до низовьев Нила (Египет), Кипра, Сирии, Южного Ирана и Южной Японии, на юге — до юго-западной Австралии. В фауне России отсутствуют. На некоторых островах Океании аборигенные млекопитающие до появления европейцев были представлены только крыланами.
Активны крыланы как правило ночью и в сумерках, хотя есть несколько островных популяций, активных и в дневное время. День проводят в кронах деревьев, под карнизами крыш, в пещерах, реже в больших дуплах. Постоянного убежища может не быть, так как крыланы кочуют в поисках пищи. С мест днёвок к местам кормёжек они могут совершать перелёты длиной до 30 км, а в общей сложности за ночь налетать до 90—100 км. Мелкие виды часто одиночны либо живут небольшими группами; крупные могут образовывать на днёвках большие скопления. Так, пальмовые крыланы (Eidolon) иногда образуют шумные поселения до 10 000 особей даже в крупных городах. Во время отдыха крылан обычно висит вниз головой, цепляясь острыми когтями за ветку или за неровность на потолке пещеры; иногда висит на одной ноге. Тело закутывает в широкие кожистые крылья, как в одеяло; в жаркую погоду обмахивается ими, как веером. В спячку крыланы не впадают.
Подвешивание вниз головой защищает спящую днём колонию от наземных хищников, а бодрствующие особи-сторожа поднимают тревогу при появлении хищных птиц или древесных змей[2].
Крыланы Филиппинских островов пугаются людей и покидают ветви своей днёвки, однако местные жители знают способ их успокоить. После того, как люди накрываются банановыми листьями, стая крыланов успокаивается и возвращается к месту днёвки[2].
Пищу крыланы разыскивают с помощью зрения и развитого обоняния. В отличие от летучих мышей, у них нет эхолокации, за исключением некоторых видов, которые эволюционно развили другую, отличную от таковой у прочих рукокрылых, эхолокационную систему[2].
Питаются в основном фруктами[2]: плодами манго, папайи, авокадо, гуавы, терминалии, сапотилового дерева, банана, кокосовых пальм и других тропических растений. Могут срывать плоды прямо на лету, либо вися рядом на одной ноге. Поедают плодовую мякоть, держа плод в одной лапе и откусывая маленькие кусочки[2]; выдавливают и пьют сок. Большинство крыланов практически не глотают плотные части корма, долго пережевывая кусочки фруктов и сплевывая плотные, почти сухие, выжимки. Мелкие длинноязыкие крыланы питаются нектаром и пыльцой цветов. Трубконосые крыланы, помимо растительной пищи, поедают и насекомых. Некоторые виды мигрируют вслед за созреванием различных плодов. Крыланы охотно пьют воду, глотая её на лету; иногда пьют и морскую воду, видимо, пополняя недостаток солей в пище.
Размножение у большинства видов, видимо, носит сезонный характер. Самка раз в год приносит 1 (реже 2) детёнышей. У крупных видов беременность длится до полугода. Новорожденные зрячие, покрыты шерстью; пока детёныш не научится летать, самка носит его с собой. В возрасте 3 месяцев молодняк пещерных крыланов уже переходит на питание плодами. В неволе некоторые крыланы доживали до 17—20 лет.
Крыланы могут причинять существенный ущерб садоводству, плантациям плодовых деревьев. Мясо крыланов некоторые племена употребляют в пищу. Все крыланы помогают распространять семена[2]; нектароядные виды опыляют растения (т. н. хироптерофилия). Примерами растений, опыляемых крыланами, являются хлебное дерево, баобабы и колбасное дерево (Kigelia).
Плодоядные представители семейства Pteropodidae были природным носителем вируса Хендра Hendra virus и вируса Нипах Nipah virus[3][4].
Семейство Pteropodidae включает более 170 видов, объединённых примерно в 40 родов. Число подсемейств в разных классификациях варьирует от 2-3 до 6. В частности, было давно показано, что питание пыльцой у крыланов развивалось несколько раз конвергентно.
Подсемейство Pteropodinae
Подсемейство Macroglossinae[6]
Подсемейство Cynopterinae
Подсемейство Eidolinae
Подсемейство Rousettinae (включая Epomophorinae)
Подсемейство Harpyionycterinae
Подсемейство Nyctimeninae
В конце 1980-х — начале 1990-х гг. было высказано предположение о том, что представители Megachiroptera и Microchiroptera выработали способность к машущему полету в результате конвергентной эволюции. Эта точка зрения, впрочем, не получила широкого распространения, позднейшие кариологические и молекулярно-генетические исследования также ни в коей мере ее не подтверждают.
Крыла́новые (лат. Pteropodidae) — семейство млекопитающих из отряда рукокрылых (Chiroptera) подотряда Yinpterochiroptera (ранее из-за своеобразной морфологии это семейство выделяли в отдельный подотряд Megachiroptera, что не поддерживается современными молекулярно-генетическими и кариологическими данными). Представителей рода Pteropus и близких родов в литературе часто называют летучими лисицами, а представителей рода Rousettus (а иногда и всех крыланов) — летучими собаками. По ряду признаков строения скелета (подвижные ребра, слабо видоизмененные шейные позвонки, наличие когтевой фаланги на втором пальце крыла) и отсутствию (как правило) развитой эхолокации, многие хироптерологи считают крыланов наиболее архаичными из современных рукокрылых.
狐蝠科(学名:Pteropodidae),哺乳綱翼手目的一科,狐蝠科所属的動物有利齒狐蝠屬(神女利齒狐蝠)、菲果蝠屬、番果蝠屬、豕果蝠屬等。
 分類 界 : 動物界 Animalia 門 : 脊索動物門 Chordata 亜門 : 脊椎動物亜門 Vertebrata 綱 : 哺乳綱 Mammalia 目 : コウモリ目(翼手目) Chiroptera 亜目 : Yinpterochiroptera または
分類 界 : 動物界 Animalia 門 : 脊索動物門 Chordata 亜門 : 脊椎動物亜門 Vertebrata 綱 : 哺乳綱 Mammalia 目 : コウモリ目(翼手目) Chiroptera 亜目 : Yinpterochiroptera またはオオコウモリ(大蝙蝠、英語 megabat)は、コウモリ(コウモリ目、翼手目)の1グループである。大翼手類(だいよくしゅるい、Megachiroptera)。
オオコウモリ上科 (Pteropodoidea) オオコウモリ科 (Pteropodidae) の1上科1科を構成する。さらに伝統分類ではこの上科のみでオオコウモリ亜目(大翼手亜目)を構成してきたが、系統分類ではYinpterochiroptera亜目の一部となる。
指の間に張った膜の翼で空を飛ぶ、いわゆるコウモリであるが、大型のものが多く、翼を広げると2m に達するものすらある。コウモリといえばココウモリ類が頭に浮かぶが、翼以外の特徴はかなり異なる。
特に、小型コウモリが反響定位によって飛行し、そのために目は小さく、耳がよく発達するのに対して、オオコウモリ類は視覚に頼って飛行し、そのため目が大きく、耳は小さく、一般的な哺乳類の顔に近い。英名で Pteropus 属を flying fox 「空飛ぶキツネ」というのがうなずける顔立ちをしている。
多くが熱帯に分布する。小型コウモリは昆虫など動物質の餌を主食とするものが大半だが、オオコウモリ類は果実や花蜜など植物質を主食としている。日本では琉球列島と小笠原諸島に分布する。
伝統分類では、コウモリはオオコウモリ亜目(大翼手亜目、オオコウモリ)とコウモリ亜目(小翼手亜目、ココウモリ)の2亜目に分けられた。
カール・フォン・リンネの時代以来、特にオオコウモリが霊長類に近いという意見があり、1986年「ココウモリとオオコウモリでは、脳と視神経の接続の仕方がまったく異なり、オオコウモリのそれは霊長目および皮翼目(ヒヨケザル目)と同一で、他の哺乳類には見られない独特のものである」ことを根拠に、「ココウモリはトガリネズミ目から進化し、オオコウモリはそれより後に霊長目から進化した」という、コウモリ類2系統説が提唱された[1]。
しかし2000年、分子系統により、コウモリはやはり単系統で、なおかつコウモリ亜目は側系統だとわかった。またその系統に基づき、オオコウモリ亜目はコウモリ亜目の一部と共に新設亜目Yinpterochiropteraに分類しなおすことが提案された[2]。
オオコウモリ(大蝙蝠、英語 megabat)は、コウモリ(コウモリ目、翼手目)の1グループである。大翼手類(だいよくしゅるい、Megachiroptera)。
オオコウモリ上科 (Pteropodoidea) オオコウモリ科 (Pteropodidae) の1上科1科を構成する。さらに伝統分類ではこの上科のみでオオコウモリ亜目(大翼手亜目)を構成してきたが、系統分類ではYinpterochiroptera亜目の一部となる。
큰박쥐류(Megabats) 또는 과일박쥐류는 박쥐목의 큰박쥐아목(Megachiroptera)에 속하는 박쥐의 총칭이다. 하위 과는 큰박쥐과(Pteropodidae)만을 포함하고 있다.[1] 큰박쥐아목은 대익수아목(大翼手亞目)으로, 큰박쥐과는 과일박쥐과로 부르기도 한다.
과일박쥐류는 사람과 가축에게 치명적일 수 있는 여러 가지 질병들의 숙주가 될 수 있는 것으로 알려졌다.[2] 그러나 과일박쥐들 자신이 그러한 질병에 감염되었다는 징후는 없는 것으로 보인다.
연구자들은 2001년부터 2년간 과일박쥐류가 에볼라 바이러스를 가지고 있는지를 테스트했다. 아프리카 중·서부에 사는 3종(망치머리박쥐(Hypsignathus monstrosus), 프란켓어깨장식과일박쥐(Epomops franqueti)와 작은목걸이과일박쥐(Myonycteris torquata))의 과일박쥐류에서 양성(陽性)반응이 나왔으나, 증상은 나타내지 않았다.[2] 이것은 이들 박쥐들이 바이러스의 숙주가 될 수 있음을 가리킨다. 2007년, 전염성이 있는 마르부르크 바이러스가 이집트과일박쥐 표본에서 발견되었으며, 이 종(種)이 그 위험한 바이러스의 숙주가 될 수 있다는 의심을 확정시켰다.[3]
다음은 2002년 박쥐목의 계통 분류이다.[4]
박쥐목 큰귀박쥐과 넓은 의미의 애기박쥐과좁은 의미의 애기박쥐과
다음은 2016년 큰박쥐류의 계통 분류이다.[5][6]
큰박쥐과 루세트박쥐아과젠커과일박쥐족
긴털루세트족
작은목도리과일박쥐족
견장과일박쥐족