en
names in breadcrumbs


Clostridium perfringens és un bacteri anaeròbic gram-positiu, immòbil i formador d'espores que es troba en els intestins dels éssers humans i de diversos animals homeoterms, en el sòl, en l'aigua, en els aliments (sobretot en les carns que no estan bé cuinades), entre altres. Les malalties causades poden ser fatals.
Produeix toxines que poden causar malalties com l'enteritis necròtica o la gangrena gasosa.
En la gangrena gasosa, el clostridi provoca destrucció en els teixits infectats si persisteix. Açò és provocat per l'alliberament d'exoenzimes específics que ataquen a les molècules constituents dels teixits d'animals: fosfolipases, hemolisines, colagenases, proteases.., que provoquen la putrefacció del teixit acompanyada d'una producció de gas, i d'ací el seu nom ("gasosa"). La solució, arribat aquest nivell, és l'amputació de la zona afectada; de no ser així la infecció sol acabar amb la mort de l'animal (porcs, pollastres, cavalls, humans...).
És el tercer indicador de contaminació fecal de les aigües. Es destrueix amb temperatures superiors a 121°.
Clostridium perfringens és un bacteri anaeròbic gram-positiu, immòbil i formador d'espores que es troba en els intestins dels éssers humans i de diversos animals homeoterms, en el sòl, en l'aigua, en els aliments (sobretot en les carns que no estan bé cuinades), entre altres. Les malalties causades poden ser fatals.
Produeix toxines que poden causar malalties com l'enteritis necròtica o la gangrena gasosa.
En la gangrena gasosa, el clostridi provoca destrucció en els teixits infectats si persisteix. Açò és provocat per l'alliberament d'exoenzimes específics que ataquen a les molècules constituents dels teixits d'animals: fosfolipases, hemolisines, colagenases, proteases.., que provoquen la putrefacció del teixit acompanyada d'una producció de gas, i d'ací el seu nom ("gasosa"). La solució, arribat aquest nivell, és l'amputació de la zona afectada; de no ser així la infecció sol acabar amb la mort de l'animal (porcs, pollastres, cavalls, humans...).
És el tercer indicador de contaminació fecal de les aigües. Es destrueix amb temperatures superiors a 121°.
Clostridium perfringens (dříve též C. welchii) je grampozitivní tyčinkovitá anaerobní sporulující bakterie z rodu Clostridium.[2] C. perfringens je v přírodě všudypřítomná a je běžně obsažena v rozkládající se vegetaci, mořském sedimentu, trávicí soustavě člověka i jiných obratlovců, na tělech hmyzu a v půdě.
Clostridium perfringens se běžně vyskytuje v infekcích jako benigní složka normální flóry.[3] V tomto případě je její role při onemocnění malá.
Infekce C. perfringens jsou prokázány u nekrózy tkáně, bakteriémie, enfyzematické cholicystitidy a u plynaté sněti, známé též jako klostridiální myonekróza. Toxin vznikající při plynaté sněti je znám jako α-toxin, vstupuje do plazmatické membrány buněk a tvoří v ní díry, které narušují normální funkci buňky.[4]
Po požití se bakterie množí a způsobuje koliku, průjem a někdy i nauzeu.
Účinky C. perfringens na mrtvá těla znají pracovníci v márnicích jako „tkáňový plyn“ a lze je zastavit jen nabalzamováním.
Ve Velké Británii a USA je bakterie C. perfringens třetí nejčastější příčinou nemocí z potravin. Hlavní útočiště poskytuje bakteriím nedostatečně tepelně upravené maso.[4] Enterotoxin Clostridium perfringens (CPE) způsobující onemocnění je termolabilní (rozkládá se při 74 °C) a lze ho zjistit v nedostatečně tepelně upraveném kontaminovaném jídle a ve fekáliích.[5]
Inkubační doba je 6 až 24 hodin (nejčastěji 10-12 h) po požití kontaminované potravy. Často se jedná o maso, které bylo sice dobře připraveno, ale příliš dlouho před konzumací. Protože C. perfringens tvoří spory, které přežijí teploty při vaření, tyto při dlouhém odstavení jídla vyklíčí a vyvinou se infekční bakteriální kolonie. Mezi typické příznaky nemoci patří břišní křeče a průjem; zvracení a horečka nejsou obvyklé. Stav obvykle vymizí během 24 hodin. Velmi zřídka se objevují smrtelné případy klostridiální nekrotizující enteritidy (též známé jako Pig-Bel) způsobované kmenem „typu C“, který produkuje silně ulcerativní β-toxin. Tento kmen se často vyskytuje v Papui-Nové Guineji.
Je pravděpodobné, že mnoho případů otrav jídlem kontaminovaným C. perfringens zůstává subklinických, protože protilátky proti toxinu jsou v populaci běžně rozšířené. To vede k závěru, že většina populace prožila otravu jídlem způsobenou C. perfringens.[4]
Clostridium perfringens je nejčastějším bakteriálním původcem plynaté sněti.
Na destičkách krevního agaru tvoří anaerobně rostoucí C. perfringens β-hemolytické, ploché, hrubé, průsvitné rozšiřující se kolonie s nerovnými okraji. Naglerova agarová destička obsahující 5 - 10 % vaječného žloutku se používá k identifikaci kmenů produkujících α-toxin, difundující lecitinázu, která interaguje s lipidy ve žloutku a tvoří charakteristickou sraženinu okolo kolonií. Polovina destičky je naočkována antitoxinem pro kontrolu identifikace.
V tomto článku byl použit překlad textu z článku Clostridium perfringens na anglické Wikipedii.
Clostridium perfringens (dříve též C. welchii) je grampozitivní tyčinkovitá anaerobní sporulující bakterie z rodu Clostridium. C. perfringens je v přírodě všudypřítomná a je běžně obsažena v rozkládající se vegetaci, mořském sedimentu, trávicí soustavě člověka i jiných obratlovců, na tělech hmyzu a v půdě.
Clostridium perfringens er en grampositiv sporedannende stavbakterie.[1]
Bakterien er udbredt i jord og dyregødning hvorfra den kan overføres til fødevarer og forårsage madforgiftning.[2] Årsagerne er for langsom nedkøling af varmebehandlet mad med kød eller fjerkræ kombineret med utilstrækkelig gennemvarmning inden spisning.[2][1] Forgiftningen skyldes et toksin som bakterierne danner i tyndtarmen.[2][1] Symptomerne er diarre og mavesmerter, eventuelt kombineret med kvalme og opkast. Det starter normalt 8-12 timer efter spisning af inficerede fødevarer[2], men der kan gå fra 6 til 48 timer.[1]. Symptomerne varer normalt omkring et døgn,[2] men diarre kan forekomme i op til 2 uger.[1] Der er kun sjældent komplikationer.[1]
Ved infektion af sår med Clostridium perfringens kan der komme gasgangræn idet der produceres et toksin, som medfører chok, hæmolyse og muskelnekrose.[1] Der er høj dødelighed hvis det ikke behandles.[1]
Clostridium perfringens er en grampositiv sporedannende stavbakterie.
Clostridium perfringens (lateinisch perfringere ‚durchbrechen‘) ist ein stäbchenförmiges, grampositives, endosporenbildendes, unbegeißeltes Bakterium der Gattung Clostridium. In (älterer) Fachliteratur findet sich auch gelegentlich die Bezeichnung Welch-Fraenkelscher Gasbazillus[1] bzw. Clostridium welchii.[2]
C. perfringens ist ein strikter Anaerobier, der das kurzzeitige Aussetzen in sauerstoffreicher Atmosphäre aber problemlos überlebt. Der Organismus kann im Boden (anaerobe Zonen), in Wasser, Staub und Lebensmitteln, aber auch im Darm von Mensch und Tier nachgewiesen werden (1.000 bis 10.000 Keime/g Fäzes). Im Boden zählen Clostridien zu den wichtigsten anaerob Cellulose-abbauenden Mikroorganismen.
Das Temperaturoptimum von C. perfringens liegt bei ca. 43 bis 47 °C (mit Generationszeiten von 8 bis 12 min), Extrembereich min. bei 10 bis 18 °C und max. bei 50 bis 52 °C. Die Sporen können in Abhängigkeit von diversen Umweltfaktoren, Temperaturen von 60 °C überleben. Die Hitzeresistenz ist je nach Stamm sehr variabel und kann bei 100 °C bis zu 60 min betragen. Das Toxin ist hitzelabil (4 min bei 60 °C). Als Dezimale Reduktionszeit werden 15 bis 145 min bei 90 °C und 0,31 bis 38 min bei 100 °C angegeben.
C. perfringens der Serotypen A, B, C, D und E bildet für den Menschen pathogene Exotoxine (Enterotoxine) aus. Durch den Nachweis der wesentlichen Toxine α, β, ε, ι können diese Serotypen des C. perfringens unterschieden werden.[1] Gasbrandkeime bilden mindestens zwölf Toxine, die als Enzyme (Proteasen, Kollagenasen, Desoxyribonukleasen und Phospholipasen) wirken. Diese Enzyme bauen Gewebe ab und führen zu Nekrosen im betroffenen Muskelgewebe.
Der Erreger zählt mit weiteren Clostridien zur Gruppe der Gasbrandbazillen und ist der häufigste Erreger des Gasbrands (70 bis 80 %). Darüber hinaus ist das Bakterium häufiger Verursacher der nekrotisierenden Pneumonie, der gangränösen Cholezystitis, einer Sepsis oder anderer unspezifischer Infektionskrankheiten. In der Humanmedizin sind insbesondere Typ A und Typ C von Bedeutung.[3] Darüber hinaus kann Clostridium perfringens Infektionserkrankungen des Zentralen Nervensystems verursachen, wovon die häufigste die clostridiale Meningitis ist, die sich meist aus einer Clostridien-Sepsis entwickelt, aber auch infolge von lokalen Traumen oder Operationen, wie der Ausräumung eines subduralen Hämatoms, entstehen kann. Seltener wurden auch Fälle einer clostridialen Enzephalitis beschrieben.[4] Bei Tieren werden die Erkrankungen durch Clostridium-perfringens-Toxine als Enterotoxämie bezeichnet.
Clostridium perfringens ist häufigster, jedoch nicht einziger Erreger des clostridialen Myositis – dem sogenannten Gasbrand. Dieser gilt neben Wundstarrkrampf und Botulismus als eine schwersten der Clostridienkrankheiten und wird auch als „clostridiale Myonekrose“[1] oder Gasgangrän[5] bezeichnet. Die Krankheit entwickelt sich meist nach Verletzungen mit Infektion bei Gartenarbeit oder Tätigkeiten im landwirtschaftlichen Bereich, aber auch nach Bissverletzungen oder Amputationen und hat eine Inkubationszeit von ca. 2 Tagen. Das Infektionsgebiet kennzeichnet sich durch Schwellung und bräunlich-livide Verfärbung. Bei der Palpation kann gegebenenfalls ein „Knistern“ (Crepitatio) festgestellt werden. Aus der Wunde entleert sich häufig stinkendes, seröses Wundsekret. Erfolgt keine schnelle Behandlung, kann es durch einen toxininduzierten Schock binnen Stunden zum Tod des Infizierten kommen.[1] Trotz optimaler Therapie ist die Letalität hoch und liegt bei 40 bis 60 %. Allerdings ist die Krankheit aufgrund einer guten chirurgischen Versorgung in der Bundesrepublik Deutschland selten geworden; im Jahre 1998 gab es in Deutschland 114 gemeldete Fälle von Gasbrand.[6]
Als pathomechanische Ursache des Gasbrandes lassen sich Clostridium-perfringens-Bakterien vom Serotyp A nachweisen. Diese zerstören durch ihr α-Toxin – eine Lecithinase, die membranständiges Lecithin in Phosphorylcholin und Diacylglycerol spaltet – die Zellmembranen im Infektionsgebiet. Die Vermehrung der toxinbildenden Erreger bzw. die Auskeimung der Sporen von C. perfringens wird dabei durch eine Senkung des Redoxpotentials im Gewebe – beispielsweise bei verminderter Durchblutung, Sekretansammlung oder Nekrose – angeregt. Demzufolge begünstigen Quetschwunden, verschmutzte Schürfwunden, große Wundhöhlen nach Amputation oder Pfählungswunden eine Infektion.[1]
C. perfringens zählt zudem zu den Lebensmittelvergiftern. Die Infektionsdosis liegt bei 700.000 Individuen/g, bei Lebensmitteln meist noch höher. Gefährdete Lebensmittel sind warmgehaltenes Fleisch (Rindfleisch, Geflügel), Austern und andere Meeresfrüchte. Die intestinalen C.-perfringens-Erkrankungen werden im überwiegenden Teil der Fälle von C.-perfringens-Stämmen vom Typ A verursacht.[1] In den Vereinigten Staaten von Amerika ist Clostridium perfringens mit geschätzten 248.000 Fällen je Jahr die häufigste gemeldete Ursache von Nahrungsmittelvergiftungen. Die nach dem Verzehr auskeimenden Clostridien beginnen im Darm mit der Herstellung des Perfringens-Enterotoxins, das die Durchlässigkeit des Darmepithels steigert und so zu Durchfällen und Darmkrämpfen führt, jedoch selten von Fieber oder Erbrechen begleitet wird. Erste Symptome treten innerhalb von 7 bis 15 Stunden nach dem Verzehr der kontaminierten Lebensmittel auf und verschwinden häufig nach 24 Stunden. Die Letalität ist gering.[5]
Wesentlich schwerwiegender ist beim Menschen die durch C. perfringens ausgelöste und erstmals im Ersten Weltkrieg beschriebene Enteritis necroticans (genannt auch Darmbrand[7]), welche eine hochgradig nekrotisierende Erkrankung des Jejunums (oberer Dünndarm) darstellt. Diese wird durch β-toxinbildende Stämme des Bakteriums vom Serotyp C hervorgerufen und verläuft häufig tödlich. Die genauen Pathomechanismen sind noch nicht abschließend geklärt.[1] Im Tierreich verursacht der Typ C die nekrotisierenden Darmentzündung der Saugferkel bzw. die nekrotische Enteritis bei Lämmern, Schafen und Kälbern.[2]
Die Nahrungsmittelvergiftung mittels Clostridium perfringens vom Typ A wird durch Isolierung des Erregers aus dem Darm oder am zuverlässigsten durch einen enzymgekoppelten Immunadsorptionstest (ELISA) zum Nachweis des Bakteriums im Darm diagnostiziert.[5] Eine Laboratoriumsdiagnose kann jedoch in der Regel nur eine nachträgliche Bestätigung der Infektion ermöglichen, da die Symptome der Erkrankung meist nach 24 Stunden bereits abgeklungen sind.[2] Im Lebensmittel selbst wird die Keimzahl von Clostridium perfringens auf Sulfit-Cycloserin-Agar (SC) ermittelt. Die Bestätigung kann mittels Lactose-Sulfit (LS) Medium und in Nitrat-Beweglichkeits-Medium (MN) erfolgen.[8]
Die Diagnose von Gasbrand wird zunächst klinisch gestellt.[1] Die Erregeranzucht kann aufgrund des zügigen Fortschreitens des Gasbrandes in der Regel nicht abgewartet werden und kann demzufolge lediglich der nachträglichen Bestätigung dienen.[6]
Der Nachweis von Clostridium perfringens wird zunächst mikroskopisch durch Anfertigung eines gram-gefärbten Präparates geführt, in dem ca. 4 bis 6 × 1 μm große Stäbchen mit abgerundeten Enden sichtbar werden. Dabei können in Originalpräparaten die Erreger teilweise von Kapseln umgeben sein, was an nicht angefärbten Zonen um die Bakterien erkennbar wird. Sporen sind gelegentlich in Stuhl- und Bodenproben zu finden, jedoch meist nicht in angezüchteten Kulturen. Als Merkmal dient u. a. die Unbeweglichkeit aufgrund der fehlenden Begeißelung und die fehlende Bildung von Sporen in vitro.
Des Weiteren wird das Verdachtsmaterial auf Anaerobier- bzw. Standard-Blutagar und auf Eigelb-Agar angezüchtet. Clostridium-perfringens-Kolonien werden unter Bebrütung in der Regel nach 10 bis 12 Stunden sichtbar. Charakteristisch sind beim Anaerobier-Blutagar runde, gewölbte, feuchtglänzende, gelegentlich rötlich schimmernde Kolonien von 3 bis 5 mm Durchmesser, die sich unter Sauerstoffeinwirkung erst grau, dann hellbraun und später grünlich verfärben und von keinem größeren Hämolysefeld umgeben sind. Auf dem Standard-Blutagar findet um die Kolonien eine Doppelzonenhämolyse statt. Auf Eigelb-Agar verursacht die vom Erreger freigesetzte Lecithinase eine charakteristische weißliche Aufhellung um den Wachstumsrasen („Seiffert-Nagler-Reaktion“). In Nährbouillons tritt rasch eine Trübung mit starker Gasentwicklung auf.
In Speziallaboratorien können zudem die Serotypen des Clostridium perfringens mittels Identifikation der Exotoxine in Tierversuchen unter Einsatz spezifischer Antiseren ermittelt werden.[3] Der Nachweis kann auch molekularbiologisch mittels PCR erfolgen.[9]
Clostridium perfringens (lateinisch perfringere ‚durchbrechen‘) ist ein stäbchenförmiges, grampositives, endosporenbildendes, unbegeißeltes Bakterium der Gattung Clostridium. In (älterer) Fachliteratur findet sich auch gelegentlich die Bezeichnung Welch-Fraenkelscher Gasbazillus bzw. Clostridium welchii.
Clostridium perfringens je anaerobna bakterija i uzročnik mionekroze (destruktivnog procesa na mišićima) u 80% slučajeva plinovite gangrene.
![]() Nedovršeni članak Clostridium perfringens koji govori o biologiji treba dopuniti. prema pravilima Wikipedije.
Nedovršeni članak Clostridium perfringens koji govori o biologiji treba dopuniti. prema pravilima Wikipedije.
Clostridium perfringens je anaerobna bakterija i uzročnik mionekroze (destruktivnog procesa na mišićima) u 80% slučajeva plinovite gangrene.
Clostridium perfringens (formerly known as C. welchii, or Bacillus welchii) is a Gram-positive, rod-shaped, anaerobic, spore-forming pathogenic bacterium of the genus Clostridium.[1][2] C. perfringens is ever-present in nature and can be found as a normal component of decaying vegetation, marine sediment, the intestinal tract of humans and other vertebrates, insects, and soil. It has the shortest reported generation time of any organism at 6.3 minutes in thioglycolate medium.[3]
Clostridium perfringens is one of the most common causes of food poisoning in the United States, alongside norovirus, Salmonella, Campylobacter, and Staphylococcus aureus.[4] However, it can sometimes be ingested and cause no harm.[5]
Infections due to C. perfringens show evidence of tissue necrosis, bacteremia, emphysematous cholecystitis, and gas gangrene, also known as clostridial myonecrosis. The specific name perfringens is derived from the Latin per (meaning "through") and frango ("burst"), referring to the disruption of tissue that occurs during gas gangrene.[6] The toxin involved in gas gangrene is α-toxin, which inserts into the plasma membrane of cells, producing gaps in the membrane that disrupt normal cellular function. C. perfringens can participate in polymicrobial anaerobic infections. It is commonly encountered in infections as a component of the normal flora. In this case, its role in disease is minor.
Tissue gas is produced when C. perfringens interacts with dead bodies. It causes extremely accelerated decomposition, and cannot be stopped by normal embalming measures. These bacteria are resistant to the presence of formaldehyde in normal concentrations.
Clostridium perfringens has a stable G+C content around 27–28% and average genome size of 3.5 Mb.[7] Genomes of 56 C. perfringens strains have since been made available on NCBI genomes database for the scientific research community. Genomic research has revealed surprisingly high diversity in C. perfringens pangenome, with only 12.6% core genes, identified as the most divergent Gram-positive bacteria reported.[7] Nevertheless, 16S rRNA regions in between C. perfringens strains are found to be highly conserved (sequence identity>99.1%).[7]
Although they lack flagella, C. perfringens bacteria are able to glide across surfaces because their bodies are lined with filaments from end-to-end. The hypermotile variants such as SM101, are often found arising on the edges of colonies on agar plates. Video microscopy of their gliding movement suggests that they form long, thin filaments that allow them to move rapidly like bacteria with flagella. Genome sequencing was used to identify the cause(s) of the hypermotile phenotype and their direct derivatives. In comparing them, strains SM124 and SM127, hypermotile derivatives of strains SM101 and SM102, respectively, contained 10 and six nucleotide polymorphisms (SNPs) relative to their parent strains. Mutations in cell division genes is the common feature of the hypermotile strains.[8]
Food poisoning in humans is caused by type A strains able to produce the CPE (for Clostridium perfringens enterotoxin).[9] The CPE is a polypeptide of 35.5 kDa that accumulates in the beginning of the sporulation and is excreted to the media when it lysates at the end of the sporulation. It is coded by the cpe gene, present in less than the 5% of the type A strains, and it can be located in the chromosome or in an external plasmid[10]
In the United Kingdom and United States, C. perfringens bacteria are the third-most common cause of foodborne illness, with poorly prepared meat and poultry, or food properly prepared, but left to stand too long, the main culprits in harboring the bacterium.[11] The C. perfringens enterotoxin (CPE) mediating the disease is heat-labile (inactivated at 74 °C (165 °F)). It can be detected in contaminated food (if not heated properly), and feces.[12] Incubation time is between 6 and 25 (commonly 10–12) hours after ingestion of contaminated food.[13]
Since C. perfringens forms spores that can withstand cooking temperatures, if cooked food is left standing for long enough, germination can ensue and infective bacterial colonies develop. Symptoms typically include abdominal cramping, diarrhea, and fever.[14] The whole course usually resolves within 24 hours, but can last up to 2 weeks in older or infirm hosts.[15]
Clostridium perfringens poisoning can also lead to another disease known as enteritis necroticans or clostridial necrotizing enteritis, (also known as pigbel); this is caused by C. perfringens type C. This infection is often fatal. Large numbers of C. perfringens grow in the intestines, and secrete exotoxin. This exotoxin causes necrosis of the intestines, varying levels of hemorrhaging, and perforation of the intestine. Inflammation usually occurs in sections of the jejunum, midsection of the small intestine. This disease eventually leads to septic shock and death. This particular disease is rare in the United States; typically, it occurs in populations with a higher risk. Risk factors for enteritis necroticans include protein-deficient diet, unhygienic food preparation, sporadic feasts of meat (after long periods of a protein-deficient diet), diets containing large amounts of trypsin inhibitors (sweet potatoes), areas prone to infection of the parasite Ascaris (produces a trypsin inhibitor). This disease is contracted in populations living in New Guinea, parts of Africa, Central America, South America, and Asia.[14]
Many cases of C. perfringens food poisoning likely remain subclinical, as antibodies to the toxin are common among the population. This has led to the conclusion that most of the population has experienced food poisoning due to C. perfringens.
Despite its potential dangers, C. perfringens is used as the leavening agent in salt-rising bread. The baking process is thought to reduce the bacterial contamination, precluding negative effects.[5]
Clostridium perfringens is the most common bacterial agent for gas gangrene. Some symptoms include blisters, tachycardia, swelling, and jaundice.[16]
A strain of C. perfringens might be implicated in multiple sclerosis (MS) nascent (Pattern III) lesions.[17] Tests in mice found that a toxin made by a rare strain of C. perfringens caused MS-like damage in the brain, and earlier work had identified this strain of C. perfringens in a human with MS.[18] MS patients were found to be 10 times more immune-reactive to the epsilon toxin than healthy people.[19]
Clostridium perfringens produces large colonies with irregular margins, often with a double zone of hemolysis.[20] Clostridium perfringens can be diagnosed by Nagler's reaction, in which the suspect organism is cultured on an egg yolk media plate. One side of the plate contains anti-alpha-toxin, while the other side does not. A streak of suspect organism is placed through both sides. An area of turbidity will form around the side that does not have the anti-alpha-toxin, indicating uninhibited lecithinase activity. In addition, laboratories can diagnose the bacteria by determining the number of bacteria in the feces. Within the 48 hours from when the disease began, if the individual has more than 106 spores of the bacteria per gram of stool, then the illness is diagnosed as C. perfringens food poisoning.[15] Other tests/reactions: Catalase: Negative, Spot indole: Negative,[21] Lecithinase: Positive, Lipase: Negative, Litmus Milk: Stormy Fermentation, Reverse CAMP plate: Positive, Gas Liquid Chromatography products: (Acetic, Butyric and Lactic Acids).
Typically, the symptoms of C. perfringens poisoning are used to diagnose it. However, diagnosis can be made using a stool culture test, in which the feces are tested for toxins produced by the bacteria.[22]
The growth of C. perfringens spores can be prevented by most importantly cooking food, especially beef and poultry, thoroughly, to the recommended temperatures. Leftover food should be refrigerated to a temperature below 40 °F (4 °C) within two hours of preparation. Large pots of food such as soup or stew with meats should be divided into small quantities and covered for refrigeration. Leftovers should be reheated to at least 165 °F (74 °C) before serving. A rule of thumb is that if the food tastes, smells, or looks different from what it is supposed to, then the food should be avoided. Even if it looks safe, a food that has been out for a long time can also be dangerous to eat.[15]
It can multiply between 12C and 50C.[23]
The most important aspect of treatment is prompt and extensive surgical debridement of the involved area and excision of all devitalized tissue, in which the organisms are prone to grow. Administration of antimicrobial drugs, particularly penicillin, is begun at the same time. Clostridium perfringens is more often susceptible to vancomycin compared to other pathogenic Clostridia.[24] Hyperbaric oxygen may be of help in the medical management of clostridial tissue infections.[25]
Clostridium perfringens is a leading cause of food poisoning in the United States and Canada.[26] Contaminated meats in stews, soups, and gravies are usually responsible for outbreaks and cause about 250,000 cases of foodborne illnesses in the United States every year. Deaths due to the disease are rare and mostly occur in elderly and people who are predisposed to the disease.[27] From 1998 to 2010, 289 confirmed outbreaks of C. perfringens illness were reported with 15,208 illnesses, 82 hospitalizations, and eight deaths.[28]
In human post-mortem bodies C. perfringens can cause extremely accelerated decomposition. The by-product, called tissue gas, is slowed or halted by embalming the body using special additive chemicals. It most commonly occurs in the bodies of people who have died of gangrene, large decubitus ulcers, necrotising fasciitis or who have had soil, faeces or water forced into wounds.
On May 7, 2010, 42 residents and 12 staff members at a Louisiana (USA) state psychiatric hospital were affected and experienced vomiting, abdominal cramps, and diarrhea. Three patients died within 24 hours. The outbreak was linked to chicken which was cooked a day before it was served and was not cooled down according to hospital guidelines. The outbreak affected 31% of the residents of the hospital and 69% of the staff who ate the chicken. How many of the affected residents ate the chicken is unknown.[29]
In May 2011, a man died after allegedly eating food contaminated with the bacteria on a transatlantic American Airlines flight. The man's wife and daughter were suing American and LSG Sky Chefs, the German company that prepared the inflight food.[30]
In December 2012, a 46-year-old woman died two days after eating a Christmas Day meal at a pub in Hornchurch, Essex, England. She was among about 30 people to fall ill after eating the meal. Samples taken from the victims contained C. perfringens. The hotel manager and the cook were jailed for offences arising from the incident.[31]
In December 2014, 87-year-old Bessie Scott died three days after eating a church potluck supper in Nackawic, New Brunswick, Canada. Over 30 other people reported signs of gastrointestinal illness, diarrhea, and abdominal pain. The province's acting chief medical officer says, Clostridium perfringens is the bacteria [sic] that most likely caused the woman's death.[32]
In October 2016, 66-year-old Alex Zdravich died four days after eating an enchilada, burrito, and taco at Agave Azul in West Lafayette, Indiana, United States. Three others who dined the same day reported signs of foodborne illness, which were consistent with the symptoms and rapid onset of C. perfringens infection. They later tested positive for the presence of the bacteria, but the leftover food brought home by Zdravich tested negative.[33][34]
In November 2016, food contaminated with C. perfringens caused three individuals to die, and another 22 to be sickened, after a Thanksgiving luncheon hosted by a church in Antioch, California, United States.[35]
In January 2017, a mother and her son sued a restaurant in Rochester, New York, United States, as they and 260 other people were sickened after eating foods contaminated with C. perfringens. "Officials from the Monroe County Department of Public Health closed down the Golden Ponds after more than a fourth of its Thanksgiving Day guests became ill. An inspection revealed a walk-in refrigerator with food spills and mold, a damaged gasket preventing the door from closing, and mildew growing inside."[36]
In July 2018, 647 people reported symptoms after eating at a Chipotle Mexican Grill restaurant in Powell, Ohio, United States. Stool samples tested by the CDC tested positive for C. perfringens.[37]
In November 2018, approximately 300 people in Concord, North Carolina, United States, were sickened by food at a church barbecue that tested positive for C. perfringens.[38]
Clostridium perfringens (formerly known as C. welchii, or Bacillus welchii) is a Gram-positive, rod-shaped, anaerobic, spore-forming pathogenic bacterium of the genus Clostridium. C. perfringens is ever-present in nature and can be found as a normal component of decaying vegetation, marine sediment, the intestinal tract of humans and other vertebrates, insects, and soil. It has the shortest reported generation time of any organism at 6.3 minutes in thioglycolate medium.
Clostridium perfringens is one of the most common causes of food poisoning in the United States, alongside norovirus, Salmonella, Campylobacter, and Staphylococcus aureus. However, it can sometimes be ingested and cause no harm.
Infections due to C. perfringens show evidence of tissue necrosis, bacteremia, emphysematous cholecystitis, and gas gangrene, also known as clostridial myonecrosis. The specific name perfringens is derived from the Latin per (meaning "through") and frango ("burst"), referring to the disruption of tissue that occurs during gas gangrene. The toxin involved in gas gangrene is α-toxin, which inserts into the plasma membrane of cells, producing gaps in the membrane that disrupt normal cellular function. C. perfringens can participate in polymicrobial anaerobic infections. It is commonly encountered in infections as a component of the normal flora. In this case, its role in disease is minor.
Tissue gas is produced when C. perfringens interacts with dead bodies. It causes extremely accelerated decomposition, and cannot be stopped by normal embalming measures. These bacteria are resistant to the presence of formaldehyde in normal concentrations.
Clostridium perfringens, antes llamado Bacillus aerogenes capsulatus, Bacillus perfringens, Bacillus welchii o Clostridium welchii, es una bacteria anaeróbica Gram-positiva, capsulada, esporulada e inmóvil que se encuentra ampliamente distribuida en el ambiente, de gran plasticidad ecológica. No suele aparecer esporulada, ni en productos patológicos ni en cultivos, requiriendo para esporular medios especiales.[1]
Se encuentra en los intestinos de los seres humanos y de varios animales homeotermos, en el suelo, en el agua, en los alimentos (sobre todo en las carnes que no están bien cocinadas), entre otros. Las enfermedades causadas pueden ser fatales.
La cápsula, la carencia de flagelos y la esporulación poco frecuente lo diferencian de otras especies del género.
Constituye el agente etiológico más importante de la gangrena gaseosa. Además, es responsable de otros cuadros clínicos como son: toxiinfecciones alimentarias, enteritis necrosante, celulitis e infecciones inespecíficas.
Los determinantes de patogenicidad de esta bacteria son variados, de tal manera que ejerce su acción patógena mediante la producción de varias toxinas citotóxicas, una enterotoxina y varias enzimas extracelulares con actividad biológica (colagenasas, hialuronidasas, etc.)
Produce toxinas que pueden causar enfermedades como la enteritis necrótica o la gangrena gaseosa.
En la gangrena gaseosa, el clostridio provoca destrucción en los tejidos infectados si persiste. Esto es provocado por la liberación de exoenzimas específicos que atacan a las moléculas constituyentes de los tejidos de animales: fosfolipasas, hemolisinas, colagenasas, proteasas.., que provocan la putrefacción del tejido acompañada de una producción de gas, y de ahí su nombre ("gaseosa"). Actualmente el tratamiento con antitoxinas, antibióticos y profilaxis quirúrgica es muy efectivo lo cual reduce muy significativamente los casos de amputación y de muerte. Sin embargo en casos extremos es necesario amputar para salvar la vida del paciente.
Es el tercer indicador de contaminación fecal de las aguas. Se destruye con temperaturas superiores a 121°C.
Al menos 8 de las toxinas producidas por este microorganismo son consideradas letales y 4 de ellas, α, β, ε ι y se consideran las más significativas, y se han utilizado para agrupar las cepas en 5 tipos toxigénicos, A, B, C, D y E (Petit et al., 1999).
Pertenece a la familia Clostridiaceae y al grupo de los clostridios que agrupa a unas 60 especies. Hay varios tipos de Clostridium perfringens:
Entre estos tipos, destacamos C. perfringens A y C, que son los que tienen capacidad de producir una enfermedad infecciosa en el ser humano.
C. perfringens es un microorganismo que reviste suma importancia en medicina humana y veterinaria ya que, pese a ser parte de la microbiota intestinal, es potencialmente patógeno y letal, tanto para animales como para el hombre. Tanto es así que el uso de algunas de sus toxinas como potenciales armas bioterroristas ha generado cierta preocupación en algunos países. Sin embargo, y a modo de contracara, otras de sus toxinas podrían ser usadas en el tratamiento de enfermedades, como transportadoras e internalizadoras de drogas en células procariotas (toxina iota) o en ciertas terapias antitumorales (enterotoxina).
El tipo A es el responsable de la casi totalidad de los cuadros clínicos en el hombre. El tipo C produce ocasionalmente enteritis necrosante. La enterotoxina es producida por múltiples cepas del tipo A y excepcionalmente por alguna de los tipos C y D.
Se trata de una proteína de bajo peso molecular (aproximadamente 35.000 Da) que presenta un punto isoeléctrico de 4,3 (Granum y Stewart, 1993). Esta enterotoxina es termolábil, así, el calentamiento en solución salina a una temperatura de 60 °C durante 5 minutos destruye su actividad biológica. Además, la toxina es muy sensible a pH extremos, aunque es resistente a algunos tratamientos proteolíticos (McDonel, 1986).
Se han propuesto diversos mecanismos de acción de esta enterotoxina: una acción colinérgica derivada de la acción lecitinasa, y alternativamente o al mismo tiempo una toxina con acción tipo cólera, activando la secreción de iones cloruro en el lumen, lo que conlleva la retención de iones sodio y secuestro de agua en el intestino; un tercer mecanismo sugiere efectos endoteliales que llevan a una vasodilatación en el intestino y aumento de la permeabilidad (Deshpande, 2002).
El cuadro clínico de toxiinfección alimentaria se produce por ingestión de gran número de bacterias (más de 10 8 células vegetativas) productoras de la enterotoxina.
Los signos aparecen tras un periodo de incubación de 8 a 24 horas y el cuadro clínico se caracteriza fundamentalmente por la aparición de dolor abdominal y diarreas severas. Cursa sin fiebre, y la enfermedad es de corta duración, con recuperación favorable, salvo en niños y personas debilitadas.
El cuadro clínico de la enteritis necrosante es un cuadro muy infrecuente, aunque grave, que aparece después de un periodo de incubación menor de 24 horas y se caracteriza por dolor abdominal, diarrea, vómitos, e inflamación aguda del intestino delgado con necrosis y gangrena en diversas porciones del mismo (Brynestad y Granum, 2002). Este cuadro clínico se relaciona con dietas hipoproteicas y se produce fundamentalmente por la ingestión de alimentos contaminados con C. perfringens tipo C que libera en el intestino toxina de la cual se han descrito 2 tipos, β 1 y β 2 (Gibert et al., 1997). Ambos tipos tienen una acción letal y necrótica, produciendo hemorragia y necrosis.
Actualmente la enteritis necrosante está restringida a los indígenas de Papua, Nueva Guinea, que habitualmente ingieren pocas proteínas en su dieta. Aunque la mayoría de los alimentos pueden contaminarse con este microorganismo, los productos cárnicos, en particular, son los más susceptibles.
La contaminación tiene lugar en cualquiera de los eslabones de la cadena alimentaria, que van desde su obtención, procesado culinario, conservación y recalentamiento. La prevención de la toxiinfección por C. perfringens no es fácil. Así, asegurar que el microorganismo no contamine el alimento resulta prácticamente imposible, ya que se trata de un microorganismo ubicuo.
Especial precaución debe tomarse en el caso de carnes rojas y aves, ya que estos animales actúan como reservorios (tracto intestinal). Además, es la especie del género Clostridium que se aísla con mayor frecuencia del hombre como microbiota normal (manos), actuando así el hombre también como reservorio.
Por lo tanto, resulta más práctico inhibir la multiplicación del microorganismo en el alimento, y si está presente en gran cantidad, reducirlo hasta niveles seguros.
Las esporas de este bacilo resisten el calentamiento de los alimentos y pueden germinar durante el enfriamiento. Se debe tener especial cuidado de no conservar nunca los alimentos ya cocinados a temperatura ambiente. El enfriamiento lento de 50 °C a 25 °C es particularmente peligroso en el caso de esta bacteria, puesto que a esas temperaturas, en unas pocas horas, se puede desarrollar un gran número de células vegetativas productoras de la enterotoxina.
En el ámbito de la medicina veterinaria, C. perfringens genera importantes pérdidas en la producción ganadera. En pequeños rumiantes es conocida como basquilla. En el caso de la producción avícola, por ejemplo, el reciente descubrimiento de una toxina (NetB), presente en cepas de C. perfringens tipo A aisladas de aves con enteritis necrótica, abre una nueva línea de investigación, relevante tanto para el conocimiento de la patogenia de estos microorganismos como para el desarrollo de nuevas vacunas. Esta toxina, o tal vez otras también, podrían estar involucradas en la enteritis necrótica por C. perfringens tipo A observada en otras especies animales.
Dado el renovado interés que existe en el estudio de C. perfringens y sus toxinas, es posible que algún día llegue a tenerse un perfil más completo de la biología de esta bacteria como comensal y como patógeno. Esta información permitirá dilucidar su papel en enfermedades entéricas en las que su participación aún es incierta.
Clostridium perfringens. MEB. 16.000X.
Clostridium perfringens, antes llamado Bacillus aerogenes capsulatus, Bacillus perfringens, Bacillus welchii o Clostridium welchii, es una bacteria anaeróbica Gram-positiva, capsulada, esporulada e inmóvil que se encuentra ampliamente distribuida en el ambiente, de gran plasticidad ecológica. No suele aparecer esporulada, ni en productos patológicos ni en cultivos, requiriendo para esporular medios especiales.
Se encuentra en los intestinos de los seres humanos y de varios animales homeotermos, en el suelo, en el agua, en los alimentos (sobre todo en las carnes que no están bien cocinadas), entre otros. Las enfermedades causadas pueden ser fatales.
La cápsula, la carencia de flagelos y la esporulación poco frecuente lo diferencian de otras especies del género.
Constituye el agente etiológico más importante de la gangrena gaseosa. Además, es responsable de otros cuadros clínicos como son: toxiinfecciones alimentarias, enteritis necrosante, celulitis e infecciones inespecíficas.
Los determinantes de patogenicidad de esta bacteria son variados, de tal manera que ejerce su acción patógena mediante la producción de varias toxinas citotóxicas, una enterotoxina y varias enzimas extracelulares con actividad biológica (colagenasas, hialuronidasas, etc.)
Clostridium perfringens Clostridium generoko bakterioa da, janari-intoxikazioak eta gangrena gaseosoa eragiten dituena.
Habitat ezberdinetan bizi da: lurzoruan, itsaso hondoetan, hondakin-uretan eta gizakia eta beste animalia batzuen hesteetan, besteak beste (gure heste-floraren partaide saprofitoa da).
Clostridium perfringens bazilo Gram positiboa da, anaerobioa (nahiz eta oxigenoaren kontzentrazio txikiak jasateko gai izan). Ez da mugikorra eta endosporak sortzen ditu, Clostridium guztien antzera.
Gluzidoak ez ezik, aminoazidoak ere hartzitzen ditu. Laktosaren hartzidura ere (+) da.
Eskakizun nutritibo zorrotzak ditu eta sulfatoak eta sulfitoak erreduzitzen ditu, sulfuroak sortuz (ezaugarri honetan oinarriturik hazkuntza-inguru hautakorrak erabiltzen dira laborategian bakterioa isolatzeko).
Giza-gorozkietan sarritan dagoenez, kutsadura fekalaren adieraletzat jotzen da mikrobio hau, eta ohikoa da bere bilaketa laborategian edateko ur-analisietan, beste bakterioekin batera (Escherichia colirekin, esaterako).
Bere birulentzia areagotzen duten hainbat toxina eta entzima ekoizten ditu: alfa toxina edo lezitinasa, enterotoxina bat, O hemolisina, kolagenasa eta hialuronidasa, besteak beste [1].
Bi dira bakterio honek sortzen dituen patologia nagusiak: janari-intoxikazioak (gastroenteritisa eragiten dutenak) eta gangrena gaseosoa.
Clostridium perfringens da janari-intoxikazioak sortzen dituen mikrobio ohikoenetariko bat. Okela kutsatua eta gaizki kozinatua da intoxikazio horien iturri nagusia.
Janari-intoxikazioa gerta dadin Clostridium perfringens-ek kopuru handietan egon behar du elikagaietan [2]. [3]
Bakterioak egosteko tenperaturei aurre egiten dieten endosporak sortzen dituenez, kontsumitu aurretik elikagaia inguruko tenperaturan uzten bada esporak hozitu daitezke, eta bakterio berriak agertu egingo dira, janari-intoxikazioa sortuko dutenak. Horregatik, funtsezkoa da kozinatu ondoren eta kontsumitu aurretik janariak hozkailuan sartzea [4].
Enterotoxina bat da janari-intoxikazioaren sintomen eta gastroenteritisaren errudun nagusia. Enterotoxina hori ez da elikagaian sortzen, organismo barruan baizik, eta gaitzaren beherakoak eta okak eragiten ditu.
Gastroenteritisa ez da larria, eta 24-48 ordutan berez sendatzen da.
Gangrena gaseosoa Clostridium perfringens zauri zikin eta sakonetan sartzen denean agertzen den patologia da. Beste Clostridium baten antzera (Clostridium tetani, tetanosen eragilea), Clostridium perfringensek zauri sakonak aprobetxatzen ditu organismoan sartzeko eta bere toxina kaltegarria askatzeko. Toxina horrek ondoeza orokorra eragiten du odolera iristen denean, heriotzarekin bukatzen dena tratamendua ezarri ezean.
Zauri sakonetan mikrobio patogenoak bere hazkuntzarako behar duen giro anaerobioa topatzen du.
Gaitzaren izena Clostridium perfringens-ek eragiten duen sintometatik dator: mikrobioak kaltetzen duen gorputzaren zatia ilundu egiten da eta zorne kiratsua jariatzen du, gas burbuilak dituena (bakterioak burutzen dituen hartziduren ondorioz askatzen da gas hori).
Bakterio patogenoak ehunen suntsiketa burutzen du ekoizten dituen toxina eta entzima hidrolitikoen bidez.
Lehenengo Mundu Gerran zauri traumatikoek gangrena gaseosoaren ugaritzea ekarri zuten, soldadu asko hilez edo elbarri geratuz. Tratamendurik gabe, bizia salbatzeko ohikoa zen garai hartan gangrenatutako gorputz-zatiaren ebakitze edo anputazioa.
2014ean egindako ikerketa batek Clostridium perfringensen andui bat esklerosi anizkoitzarekin lotuta egon litekeela proposatzen zuen. Saguekin egindako saioek andui berezi horrek ekoizten zuen toxina batek (epsilon toxina) esklerosi anizkoitzaren antzeko sintomak eragiten zituela animalien burmuinean agerian jarri zuten. Era berean, ikertzaileek esklerosi anizkoitzaren gaixoek toxina horren aurkako antigorputzek zituztela antzeman zuten [5]
Clostridium perfringens Clostridium generoko bakterioa da, janari-intoxikazioak eta gangrena gaseosoa eragiten dituena.
Habitat ezberdinetan bizi da: lurzoruan, itsaso hondoetan, hondakin-uretan eta gizakia eta beste animalia batzuen hesteetan, besteak beste (gure heste-floraren partaide saprofitoa da).
Clostridium perfringens on klostrideihin (Clostridium) kuuluva grampositiivinen bakteeri, joka aiheuttaa ruokamyrkytyksen. Sitä esiintyy yleisesti ympäristössä ja myös eläinten ja ihmisten suolistossa. Tartunta on yleensä peräisin lihasta tai kalasta. Oireet alkavat vuorokauden kuluessa tartunnasta ja häviävät noin vuorokauden kuluessa. Jos lihaa tai kalaa säilytetään liian lämpimässä, bakteerit lisääntyvät niissä vaarallisiksi määriksi.[1]
C. perfringens muodostaa itiöitä, jotka voivat säilyä elossa ruoanvalmistuksessa, sillä ne kestävät keittämistä +100 °C:ssa 30–120 minuuttia. Keittäminen aktivoi itiöt muuttumaan kasvukykyisiksi soluiksi, jotka voivat aiheuttaa ruokamyrkytyksiä.[2]
Vuosina 1975–2000 C. perfringens on ollut Suomessa yleisin ruokamyrkytysten aiheuttaja.[2] Lisäksi se aiheuttaa harvinaista vaikeasti hoidettavaa kaasukuoliota[3] ja hevosilla Baron Gruffin tautia.
Clostridium perfringens on klostrideihin (Clostridium) kuuluva grampositiivinen bakteeri, joka aiheuttaa ruokamyrkytyksen. Sitä esiintyy yleisesti ympäristössä ja myös eläinten ja ihmisten suolistossa. Tartunta on yleensä peräisin lihasta tai kalasta. Oireet alkavat vuorokauden kuluessa tartunnasta ja häviävät noin vuorokauden kuluessa. Jos lihaa tai kalaa säilytetään liian lämpimässä, bakteerit lisääntyvät niissä vaarallisiksi määriksi.
C. perfringens muodostaa itiöitä, jotka voivat säilyä elossa ruoanvalmistuksessa, sillä ne kestävät keittämistä +100 °C:ssa 30–120 minuuttia. Keittäminen aktivoi itiöt muuttumaan kasvukykyisiksi soluiksi, jotka voivat aiheuttaa ruokamyrkytyksiä.
Vuosina 1975–2000 C. perfringens on ollut Suomessa yleisin ruokamyrkytysten aiheuttaja. Lisäksi se aiheuttaa harvinaista vaikeasti hoidettavaa kaasukuoliota ja hevosilla Baron Gruffin tautia.
Clostridium perfringens (anciennement appelé Clostridium welchii ou parfois Bacillus perfringens) est un bacille Gram positif du genre Clostridium. La bactérie est immobile, sporulée et anaérobie stricte. Cette bactérie va produire des nécrotoxines, provoquant ainsi l'entérite nécrosante. La toxine majeure la plus fréquente est la toxine alpha, essentiellement produite par Clostridium perfringens type A. Cette toxine est impliquée dans de très nombreux cas de gangrène chez les animaux dont l'humain. Seule ou en association avec d'autres toxines, elle cause également des mortalités brutales chez les porcs et les ruminants.
Plusieurs espèces de clostridies telluriques et fécales peuvent lorsqu'elles sont introduites dans des tissus où elles trouvent les conditions d'anaérobiose nécessaires à leur développement, déclencher la gangrène gazeuse. C'est un processus d'infection locale intense, accompagné de phénomènes généraux graves dus aux toxines résorbées.
Il s'agit généralement de plaies profondes, atteignant les plans musculaires et comportant des tissus dévitalisés. Expérimentalement, il faut mille fois moins de clostridies pour déclencher l'infection dans des tissus dévitalisés que dans des tissus normalement irrigués et un million de fois moins s'il y a en outre des corps étrangers.
Une fois déclenché, le processus infectieux entraîne rapidement un cercle vicieux : les toxines nécrosantes augmentent la quantité de tissus dévitalisés (myonécrose) ; les hyaluronidases et collagénases favorisent la propagation des germes dans les tissus ; le dégagement de gaz, en comprimant les vaisseaux sanguins, augmente l'anoxie et l'anaérobiose et supprime l'apport par voie sanguine des substances de défense et antibiotiques, ce qui peut entraîner la nécessité d'amputations importantes.
La gangrène gazeuse peut être produite par différents germes, souvent associés. Les plus importants sont :
Le clostridium perfringens peut en outre être responsable des affections suivantes :
Cl. perfringens se distingue des autres par son immobilité, la présence d'une capsule (peu visible dans les cultures), la très grande rareté de ses spores et un plus grand volume (plus ou moins 5 microns sur 1 micron).
Les colonies sont rondes de plus ou moins 1 mm, fortement hémolytiques sur gélose au sang, lisses pour Cl. perfringens et souvent irrégulières pour les autres. En gélose profonde, il y a une production de gaz abondante. Les espèces se distinguent entre elles par la détermination des sucres fermentés, la production de sulfure d'hydrogène (H2S), la coagulation spongieuse du lait et surtout par les toxines produites.
Cl. perfringens secrète une douzaine d'enzymes et toxines, dont la principale est la toxine alpha caractéristique du type A (le plus fréquent et le plus important en médecine humaine).
Cette toxine alpha est une lécithinase qui exerce les effets suivants :
Les autres clostridies pathogènes sécrètent aussi diverses toxines antigéniquement distinctes (lécithinases moins actives que celle du Cl. perfringens, toxines nécrosantes, etc.).
La présence de bacilles Gram positif, assez gros avec capsule (Cl. perfringens) ou fins avec spores subterminales (autres clostridies) dans un pus d'odeur fétide, permet un diagnostic présomptif.
Si l'examen direct a révélé une flore associée, on peut en chauffant à 70 °C éliminer les germes non sporulants. On peut aussi rendre les milieux sélectifs en ajoutant de la néomycine ou de la kanamycine à 100 mg/ml, antibiotiques qui n'inhibent pas les clostridies. Les milieux les plus utilisés sont le milieu de Rosenow, la gélose profonde au thioglycolate, les géloses au jaune d'œuf ou au sang en jarre pour anaérobiose. Culture à 46°c durant 24h
La toilette chirurgicale des plaies et l'administration d'antibiotiques (pénicillines, tétracyclines et sulfamidés) avant que ne s'installe le cercle vicieux décrit plus haut (rôles pathogènes) constituent les principales méthodes prophylactiques. Ces mêmes méthodes seront encore employées, quoique moins efficacement, dans le traitement des cas déclarés. On pourra y adjoindre des séjours en oxygène hyperbare dans des caissons étanches.
Clostridium perfringens (anciennement appelé Clostridium welchii ou parfois Bacillus perfringens) est un bacille Gram positif du genre Clostridium. La bactérie est immobile, sporulée et anaérobie stricte. Cette bactérie va produire des nécrotoxines, provoquant ainsi l'entérite nécrosante. La toxine majeure la plus fréquente est la toxine alpha, essentiellement produite par Clostridium perfringens type A. Cette toxine est impliquée dans de très nombreux cas de gangrène chez les animaux dont l'humain. Seule ou en association avec d'autres toxines, elle cause également des mortalités brutales chez les porcs et les ruminants.
Clostridium perfringens (antes chamado C. welchii, ou Bacillus welchii) é unha especie de bacterias con forma de bacilo grampositivas, anaeróbicas, formadoras de endósporas e non motís.[1] C. perfringens é moi común na natureza e pode encontrarse como un compoñente normal da flora de microorganismos da vexetación en descomposición, sedimentos mariños, tracto intestinal humano e doutros vertebrados e insectos, e no solo.
C. perfringens é unha dos principais axentes causantes de intoxicacións alimentarias, aínda que ás veces pode ser inxerido sen que faga dano.
Ademais das intoxicacións alimentarias, pode producir infeccións. As infeccións debidas a C. perfringens poden causar necrose de tecidos, bacteremia, colecistite enfisematosa, e gangrena gasosa, que se coñece tamén como mionecrose clostridial. Na gangrena gasosa está implicada unha toxina da bacteria chamada α-toxina. C. perfringens pode participar en infeccións anaerobias polimicrobianas. Clostridium perfringens encóntrase moitas veces neste tipo de infeccións como un compoñente da flora normal, e nese caso o seu papel na infección é pouco importante.
A acción de C. perfringens nos cadáveres é producir gas nos tecidos, que só pode evitarse co embalsamamento.
É un bacilo non motil grampositivo anaerobio, que forma endósporas moi resistentes. Pode realizar a respiración anaerobia utilizando o nitrato como aceptor final de electróns, e tamén fermentacións nas que produce gases, como o CO2. É un organismo mesófilo cunha temperatura de crecemento óptima de 37 °C. Ten un xenoma de algo máis de 3 millóns de pares de bases (3,6 millón no tipo A) e un contido GC relativamente baixo (de 24 a 53%)[2]. Non pode sintetizar todos os aminoácidos. Os serotipos de C. perfringens denomínanse A, B, C, D e E e dependen da exotoxina que produza (as catro principais son: alfa, beta, epsilon e iota), que teñen efectos citotóxicos e necrotizantes. Ademais das exotoxinas, produce unha enterotoxina, que é o seu factor de virulencia principal, e denomínase enterotoxina de Clostridium perfringens (CPE), que afecta á permeabilidade das membranas celulares nas enfermidades gastrointestinais que produce.[3][4][5]
C. perfringens é un dos principais causantes de intoxicacións alimentarias, que se poden producir principalmente por inxerir carne ou aves pouco cociñadas e contaminada coa bacteria, ou carne que foi suficientemente cociñada pero que se gardou demasiado tempo antes de consumirse.[6] A enterotoxina de Clostridium perfringens (CPE)[7] que media na enfermidade é lábil á calor (inactívase a 74 °C) e pode aparecer na comida contaminada, se non se prepara debidamente, e nas feces.[8] O período de incubación é de entre 6 e 24 horas (normalmente 10-12 horas) despois da inxestión de comida contaminada.
Como C. perfringens forma esporas que poden resistir as temperaturas de cocción, se a comida preparada se deixa estar durante certo tempo a temperatura moderada sen consumir, pode producirse a xerminación das esporas e orixinárense colonias bacterianas infectivas. Os síntomas típicos son cambras abdominais, diarrea; vómitos e febre. Xeralmente desaparecen en 24 horas. Hai tamén casos raros mortais de enterite necrotizante clostridial no que están implicados as cepas de tipo C do microorganismo, que producen unha potente β-toxina ulcerativa. Estas cepas encóntranse principalmente en Papúa Nova Guinea.
Moitos casos de intoxicación alimentaria por C. perfringens son probablemente subclínicos, xa que os anticorpos contra a toxina son comúns na poboación, o que quere dicir que a maioría da poboación padeceu algunha intoxicación alimentaria por C. perfringens aínda que fose leve.
A pesar do seu perigo potencial, C. perfringens (xunto con outras bacterias) utilízase como axente para levedar certos tipos de pan sen lévedo orixinarios dos Montes Apalaches, xa que o proceso de enfornado reduce a contaminación bacteriana evitando efectos negativos.[9]
Clostridium perfringens é o axente bacteriano máis común que produce a gangrena gasosa, a cal é unha necrose ou putrefacción dos tecidos con produción de gas. É causada principalmente pola alfa-toxina de Clostridium perfringens.[10] Os gases forman burbullas nos músculos e un característico cheiro a tecido en descomposición. Despois de espallarse localmente de forma rápida e destrutiva (o cal pode producirse só nunha horas), prodúcese o espallamento sistémico da bacteria, e as toxinas bacterianas poden causar a morte. Este é un problema moi importante nas feridas traumáticas graves e de guerra (na Primeira Guerra Mundial causou a morte por gangrena gasosa de moitos soldados feridos). C. perfringens crece doadamente en placas de ágar sangue en condicións anaeróbicas, e a miúdo produce unha zona dobre de beta-hemólise.
C. perfringens pode diagnosticarse mediante a reacción de Nagler cando o organismo sospeitoso se cultiva en placas con medio de xema de ovo (fonte de lecitina). Un lado da placa contén anti-alfa-toxina, e o outro lado non. Seméntase unha estría co organismo sospeitoso en ambos os lados. Fórmase unha área de turbidez arredor do lado que non ten a anti-alfa-toxina, o que indica que a actividade de lecitinase non está inhibida.[11][12]
O tratamento clínico debe ser rápido, sen agardar polos resultados do laboratorio. As feridas traumáticas deben limparse con coidado. As feridas que non se poden limpar non deberían pecharse con puntos de sutura. A profilaxe con penicilina mata moitos clostridios, e é útil en feridas sucias e amputacións da parte inferior das pernas. Para que se estableza a infección requírese unha alta dose do microorganismo; o estado de portador persiste durante varios días.
Na intoxicación alimentaria non se recomendan antibióticos, senón que se fai unha rehidratación oral ou, en casos graves, intravenosa.[13]
Clostridium perfringens (antes chamado C. welchii, ou Bacillus welchii) é unha especie de bacterias con forma de bacilo grampositivas, anaeróbicas, formadoras de endósporas e non motís. C. perfringens é moi común na natureza e pode encontrarse como un compoñente normal da flora de microorganismos da vexetación en descomposición, sedimentos mariños, tracto intestinal humano e doutros vertebrados e insectos, e no solo.
C. perfringens é unha dos principais axentes causantes de intoxicacións alimentarias, aínda que ás veces pode ser inxerido sen que faga dano.
Ademais das intoxicacións alimentarias, pode producir infeccións. As infeccións debidas a C. perfringens poden causar necrose de tecidos, bacteremia, colecistite enfisematosa, e gangrena gasosa, que se coñece tamén como mionecrose clostridial. Na gangrena gasosa está implicada unha toxina da bacteria chamada α-toxina. C. perfringens pode participar en infeccións anaerobias polimicrobianas. Clostridium perfringens encóntrase moitas veces neste tipo de infeccións como un compoñente da flora normal, e nese caso o seu papel na infección é pouco importante.
A acción de C. perfringens nos cadáveres é producir gas nos tecidos, que só pode evitarse co embalsamamento.
Clostridium perfringens je anaerobna bakterija i uzročnik mionekroze (destruktivnog procesa na mišićima) u 80% slučajeva plinovite gangrene.
![]() Nedovršeni članak Clostridium perfringens koji govori o biologiji treba dopuniti. Dopunite ga prema pravilima Wikipedije.
Nedovršeni članak Clostridium perfringens koji govori o biologiji treba dopuniti. Dopunite ga prema pravilima Wikipedije.
Clostridium perfringens je anaerobna bakterija i uzročnik mionekroze (destruktivnog procesa na mišićima) u 80% slučajeva plinovite gangrene.
Clostridium perfringens adalah spesies bakteri gram-positif yang dapat membentuk spora dan menyebabkan keracunan makanan.[1] Beberapa karakteristik dari bakteri ini adalah non-motil (tidak bergerak), sebagian besar memiliki kapsul polisakarida, dan dapat memproduksi asam dari laktosa.[1] C. perfringens dapat ditemukan pada makanan mentah, terutama daging dan ayam karena kontaminasi tanah atau tinja.[1] Bakteri ini dapat hidup pada suhu 15-55 °C, dengan suhu optimum antara 43-47 °C.[1] Clostridium perfringens dapat tumbuh pada pH 5-8,3 dan memiliki pH optimum pada kisaran 6-7.[1] Sebagian C. perfringens dapat menghasilkan enterotoksin pada saat terjadi sporulasi dalam usus manusia.[1] Spesies bakteri ini dibagi menjadi 5 tipe berdasarkan eksotoksin yang dihasilkan, yaitu A, B, C, D, dan E.[1] Sebagian besar kasus keracunan makanan karena C. perfringens disebabkan oleh galur tipe A, dan ada pula yang disebbkan oleh galur tipe C.[2]
Clostridium perfringens adalah spesies bakteri gram-positif yang dapat membentuk spora dan menyebabkan keracunan makanan. Beberapa karakteristik dari bakteri ini adalah non-motil (tidak bergerak), sebagian besar memiliki kapsul polisakarida, dan dapat memproduksi asam dari laktosa. C. perfringens dapat ditemukan pada makanan mentah, terutama daging dan ayam karena kontaminasi tanah atau tinja. Bakteri ini dapat hidup pada suhu 15-55 °C, dengan suhu optimum antara 43-47 °C. Clostridium perfringens dapat tumbuh pada pH 5-8,3 dan memiliki pH optimum pada kisaran 6-7. Sebagian C. perfringens dapat menghasilkan enterotoksin pada saat terjadi sporulasi dalam usus manusia. Spesies bakteri ini dibagi menjadi 5 tipe berdasarkan eksotoksin yang dihasilkan, yaitu A, B, C, D, dan E. Sebagian besar kasus keracunan makanan karena C. perfringens disebabkan oleh galur tipe A, dan ada pula yang disebbkan oleh galur tipe C.
Il Clostridium perfringens (noto in precedenza come Clostridium welchii) è un batterio gram-positivo, a forma di bastoncello, anaerobio, solfito-riduttore e sporigeno, appartenente al genere Clostridium.[1] C. perfringens è ubiquitario in natura e può essere trovato come un normale componente di vegetali in decomposizione, nel sedimento marino, nel tratto intestinale degli esseri umani e di altri vertebrati, negli insetti, nell'acqua e nel suolo. Virtualmente ogni campione di suolo che sia esaminato, ad eccezione delle sabbie del Sahara, contiene C. perfringens.
I Clostridium che contaminano le ferite sono in genere polimicrobici, e comprendono le specie C. perfringens, C.novyi, C. septicum ed altri; questi provengono prevalentemente dall'ambiente oppure sono una componente della normale flora microbica dell'ospite.[2] L'ambiente anaerobico presente nelle ferite profonde facilita la replicazione del Clostridium e la produzione di tossine. Infezioni a carico di C. perfringens mostrano evidenza di necrosi dei tessuti, batteremia, enfisema, colecistiti, e gangrena gassosa, conosciuta anche come mionecrosi. La tossina coinvolta nella gangrena gassosa è nota con il nome di α-tossina, una fosfolipasi C che porta a una emolisi massiva e a un aumento della permeabilità vascolare con perdite di sangue causate dalla degradazione delle piastrine. Nel complesso produce alterazioni nella membrana cellulare, interferendo con le sue normali funzioni.[3]
La gangrena gassosa è un processo che ha inizio con l'ingresso di spore in una ferita scarsamente ossigenata. Queste, una volta germinate, indurranno la degenerazione del tessuto molle adiacente con relativa produzione di gas nel caso in cui producano specifiche tossine, sia alfa sia teta. Il gas conferirà alla zona un caratteristico crepitio.
Il C. perfringens è uno dei principali responsabili dei processi di putrefazione dei cadaveri con produzione di gas tissutale.
Alcuni ceppi di C. perfringens producono una tossina che causa tossinfezione alimentare se ingerita. In Gran Bretagna e negli Stati Uniti sono la terza causa più comune di malattie derivate dagli alimenti, con carne e pollame non ben cucinati principali colpevoli di ospitare il batterio.[3] L'enterotossina clostridiale che media la malattia è termolabile ed è inattivata a 74 °C ; può essere ritrovata nei cibi contaminati e nelle feci.[4]
L'incubazione è tra le 8 e le 16 ore dopo l'ingestione del cibo contaminato. Manifestazioni tipiche sono crampi addominali e diarrea mentre vomito e febbre sono più rari. L'intero corso della malattia si risolve in circa 24 ore. Rarissimi sono i casi fatali da enterite clostridiale necrotizzante in cui si sa essere coinvolto il "Tipo C" dell'organismo, che produce la β-tossina, potenzialmente ulcerante.
Pare che molti casi di avvelenamento da cibo a carico di C. perfringens rimangano subclinici, dato che gli anticorpi contro la tossina sono diffusi nella popolazione. Questo porta alla conclusione che, se non tutta, almeno la maggioranza della popolazione ha sperimentato un avvelenamento da cibo dovuta a C. perfringens.[3]
Utilizzando piastre con agar sangue, il C. perfringens cresce anaerobicamente e produce β-emolisi, è piatto, diffuso, rugoso, forma colonie traslucenti con margini frastagliati. Una piastra di agar Nagler contenente 5-10% albume è usata per identificare ceppi che producono α-tossina, una lecitinasi diffusibile che interagisce con i lipidi nel tuorlo d'uovo producendo un caratteristico precipitato intorno alle colonie. Metà delle piastre sono trattate con antitossina che agisce come controllo durante l'identificazione.
Un altro terreno usato nella ricerca del C. perfringens è il T.S.C. (Triptosio Solfito Cicloserina Agar), su cui la riduzione del solfito è rivelata dalla caratteristica colorazione nera delle colonie.
Il Clostridium perfringens (noto in precedenza come Clostridium welchii) è un batterio gram-positivo, a forma di bastoncello, anaerobio, solfito-riduttore e sporigeno, appartenente al genere Clostridium. C. perfringens è ubiquitario in natura e può essere trovato come un normale componente di vegetali in decomposizione, nel sedimento marino, nel tratto intestinale degli esseri umani e di altri vertebrati, negli insetti, nell'acqua e nel suolo. Virtualmente ogni campione di suolo che sia esaminato, ad eccezione delle sabbie del Sahara, contiene C. perfringens.
Clostridium perfringens ir grampozitīva obligāti anaeroba baktērija. Ir zināmi 168 celmi.[1] Patogēns cilvēkiem izraisa gāzes gangrēnu.
Veido sporas; sporu veidošanas laikā šūnas producē toksīnus, kas izraisa saslimšanu. Baktēriju veģetatīvās šūnas spēj augt temperatūrā no 12 līdz 50 °C; zemākās temperatūrās tās nespēj augt.[2]
Baktērijas veido 12 toksīnus, no kuriem 4 ir letāli: hemolizīns, proteāze, neirominidāze un enterotoksīns. Dažādus toksīnus veido dažādi celmi, balstoties uz šīm atšķirībām, izšķir 5 sugu tipus - A, B, C, D un E. Enterotoksīnu producē A tips.[2]
Clostridium perfringens ir grampozitīva obligāti anaeroba baktērija. Ir zināmi 168 celmi. Patogēns cilvēkiem izraisa gāzes gangrēnu.
Clostridium perfringens (dahulu dikenali sebagai C. welchii, atau Bacillus welchii) ialah bakterium gram-positif, berbentuk batang, anaerobik dan membentuk spora daripada genus Clostridium.[1]
Clostridium perfringens (dahulu dikenali sebagai C. welchii, atau Bacillus welchii) ialah bakterium gram-positif, berbentuk batang, anaerobik dan membentuk spora daripada genus Clostridium.
Clostridium perfringens is een gram-positieve, anaerobe, sporevormende staafvormige bacterie. De bacterie komt veel in de natuur voor.
De pathogeniteit komt door de productie van necrotiserende en histolytische toxinen (lecithinasen) en enzymen als proteasen en collagenasen.
De bacterie veroorzaakt onder andere gasgangreen, voedselvergiftiging en necrotische enteritis.
Clostridium perfringens is een gram-positieve, anaerobe, sporevormende staafvormige bacterie. De bacterie komt veel in de natuur voor.
De pathogeniteit komt door de productie van necrotiserende en histolytische toxinen (lecithinasen) en enzymen als proteasen en collagenasen.
De bacterie veroorzaakt onder andere gasgangreen, voedselvergiftiging en necrotische enteritis.
Clostridium perfringens er sporeformende bakteriene som forekommer i tarmene til de fleste dyr og mennesker, samt jord og søle.
Den forårsaker sjelden dødsfall, og det må til mange bakterier av denne typen for i det hele tatt kunne gi sykdom.Symptomene på denne bakterien er som regel kvalme og oppkast.
Bakterien kan overleve koking, og klarer seg uten oksygen. Den trives best mellom 43 og 47 grader. Matvarer det er påvist mange clostridium-bakterier i er kylling og lapskaus.
Clostridium perfringens er sporeformende bakteriene som forekommer i tarmene til de fleste dyr og mennesker, samt jord og søle.
Den forårsaker sjelden dødsfall, og det må til mange bakterier av denne typen for i det hele tatt kunne gi sykdom.Symptomene på denne bakterien er som regel kvalme og oppkast.
Bakterien kan overleve koking, og klarer seg uten oksygen. Den trives best mellom 43 og 47 grader. Matvarer det er påvist mange clostridium-bakterier i er kylling og lapskaus.
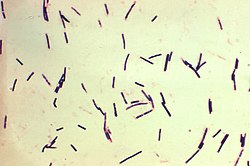
Laseczka zgorzeli gazowej (łac. Clostridium perfringens, syn. Clostridium welchii) jest Gram-dodatnią, beztlenową laseczką, wytwarzającą endospory należącą do rodzaju Clostridium[1]. Rezerwuarem C. perfringens jest przewód pokarmowy koniowatych[2] C. perfringens jest dość rozpowszechniona w środowisku za sprawą rozpowszechnienia koni i może być odnaleziona jako składnik kompostu, osadu dennego, układu pokarmowego człowieka (flora fizjologiczna) i innych kręgowców, a także u owadów oraz w glebie.
C. perfringens jest głównym czynnikiem etiologicznym choroby zwanej zgorzelą gazową (łac. gangraena gaseosa). Jest to martwica mięśni lub tkanki łącznej z wytworzeniem gazu. Nieleczona prowadzi do śmierci spowodowanej toksemią i wstrząsem.
C. perfringens wytwarza 14 toksyn, które zostały oznaczone kolejnymi literami alfabetu greckiego. Cztery spośród nich: α, β, ε i ι to toksyny letalne. Główną rolę odgrywa toksyna α (fosfolipaza C), która powoduje lizę erytrocytów, leukocytów, płytek krwi i komórek śródbłonka, co wpływa na zwiększenie przepuszczalności naczyń krwionośnych.
Inwazyjność wynika z bogatego zestawu enzymów: kolagenazie, proteinazom, hemolizynom, hialuronidazie, deoksyrybonukleazie oraz neuraminidazie.
Laseczka zgorzeli gazowej (łac. Clostridium perfringens, syn. Clostridium welchii) jest Gram-dodatnią, beztlenową laseczką, wytwarzającą endospory należącą do rodzaju Clostridium. Rezerwuarem C. perfringens jest przewód pokarmowy koniowatych C. perfringens jest dość rozpowszechniona w środowisku za sprawą rozpowszechnienia koni i może być odnaleziona jako składnik kompostu, osadu dennego, układu pokarmowego człowieka (flora fizjologiczna) i innych kręgowców, a także u owadów oraz w glebie.
Clostridium perfringens (anteriormente conhecida como Clostridium welchii) é uma bactéria, em forma de bastão, anaeróbica e formadora de esporos. A C. perfringens está onipresente na natureza podendo ser encontrada como um componente normal da vegetação apodrecida, sedimentos marinhos, trato intestinal de seres humanos e outros vertebrados, insetos, e do solo. Essa bactéria pode causar enterite quando presente em alimentos contaminados e a gangrena gasosa, quando afeta feridas expostas e cirúrgicas. Período de incubação: 6 a 24 horas.[1]
Clostridium perfringens (anteriormente conhecida como Clostridium welchii) é uma bactéria, em forma de bastão, anaeróbica e formadora de esporos. A C. perfringens está onipresente na natureza podendo ser encontrada como um componente normal da vegetação apodrecida, sedimentos marinhos, trato intestinal de seres humanos e outros vertebrados, insetos, e do solo. Essa bactéria pode causar enterite quando presente em alimentos contaminados e a gangrena gasosa, quando afeta feridas expostas e cirúrgicas. Período de incubação: 6 a 24 horas.
Clostridium perfringens (tidigare Clostridium welchii) är en relativt stor grampositiv, stavformad, anaerob, sporbildande bakterie i familjen Clostridium.[1] Bakterien är orörlig och omsluten av en kapsel. C. perfringens är extremt vanlig och förekommer nästan överallt, till exempel i multnande växter, tarmarna hos människor och andra ryggradsdjur, insekter och jord. Nästan all jordprov som tas innehåller C. perfringens.
C. perfringens verkan på döda kroppar är känd för bårhusarbetare som tissue gas [2] och kan endast stoppas genom balsamering.
I USA och Storbritannien är C. perfringens bakterien den tredje vanligaste orsaken till livsmedelsburna sjukdomar. Dåligt förberedda kött- och fågelrätter är de största källorna som hyser bakterien.
Clostridium perfringens enterotoxin (CPE) som orsakar sjukdomen är värmelabilt (inaktiveras vid 74°C) och kan påträffas i förorenad mat, om den inte upphettas korrekt. Den förekommer även ofta i avföring hos djur och människor. Inkubationstiden uppgår mellan 6 och 24 (vanligen 10-12) timmar efter intag av förorenade livsmedel. Clostridium perfringens elimineras vid upphettning, men kan bilda sporer som tål matlagningstemperaturer. Om maten förvaras i rumstemperatur efter tillagning kan det utvecklas nya bakterier ur sporerna. Dessa tillväxer snabbt och tillverkar toxin. Vid matförgiftning av Clostridium perfringens är den karaktäristiska maträtten någon form av kost som tillagats i större mängd, och som lämnats framme efter tillagning för att svalna under en längre tid. De sporer som överlevt tillredningen kan då åter växa ut. Sporerna främjas i en hög temperatur. Andra bakterier har dessutom dött vid tillagningen vilket gynnar C. perfringens’ tillväxt då den kan ske utan konkurrens.[3][4]
Infektionsdosen är emellertid stor. Per gram mat krävs det ca 100 000 bakterier för att utveckling av sjukdomen ska ske. Då bakterien återgår till sporform bildas toxinet i tarmen. Eftersom sjukdomssymptomen uppkommer p.g.a. toxinet, sprids infektionen inte personer emellan. Typiska symptom inkluderar magkramper och diarré. Kräkningar och feber är dock mer ovanligt. Hela sjukdomsförloppet försvinner vanligen inom 24 timmar.[5]
Clostridial necrotizing enteritis (CNE) är en mycket ovanlig, dödlig typ av matförgiftning orsakad av ”typ C”-stammar av organismen. Dessa producerar ett kraftigt sårbildande β-toxin. Denna stam har främst påträffas i Papua Nya Guinea.
Många fall av C. perfringens matgiftning förblir sannolikt subkliniska, då antikroppar mot toxinet är vanligt förekommande bland befolkningen. Detta har lett till slutsatsen att större delen av befolkningen har upplevt matförgiftning på grund av C. perfringens.[källa behövs]
Trots dess potentiella faror, används C. perfringens som jäsningsmedel i "salt-rising bread" (bröd utan jäst). Bakningsprocessen tros reducera den bakteriella kontamineringen, vilket förebygger negativa effekter.[6]
Clostridium perfringens kan även orsaka gasbrand, en fruktad men relativt ovanlig sjukdom. Bakterierna existerar framför allt i tjocktarmen, men det krävs särskilda förutsättningar för att infektionen ska uppstå. För att gasbrand ska etablera sig fordras att bakterierna introduceras i vävnad med nedsatt viabilitet. Sådana omständigheter kan föreligga i vävnad där blodcirkulationen är nedsatt. Speciellt även då vävnaden är mekaniskt skadad, till exempel vid olycksfall. Då bakterierna når vävnad av detta slag kan de tillverka olika toxiner och enzymer. Dessa utvecklar vätgas och koldioxid som framkallar vävnadssönderfall. Vid sådana förutsättningar främjas spridningen av bakterier över större kroppsområden, som då även angrips av toxinfrisättningen.
Den karaktäristiska gasbrandsinfektionens förlopp är tämligen dramatiskt. Patienten påverkas starkt, och drabbas av oerhörd smärta. Man kan åskåda hur infektionen timme för timme sprider sig i vävnaden, som bokstavligen smälter ner. Denna nedbrytning försiggår vanligtvis under gasutveckling. Detta ger, det för gasbrand så karaktäristiska ”knistret”, då man med fingret trycker på det infekterade området på huden vid palpation.
Det förekommer olika typer av gasbrand, bl.a. äkta gasbrand (gasgangrän) och anaerob cellulit.[7]
Gasgangrän är också är känt som Clostridial myonecrosis. Toxinet som är involverat i gasgangrän kallas α-toxin, och skär in i plasmamembranet hos celler och skapar luckor i membranet vilket stör normal cellulär funktion.
Intensiv terapi ges i form av antibiotika, kirurgi och HBO (hyperbar oxygenbehandling). All nekrotisk vävnad avlägsnas från såret som hålls luftigt och rent. Penicillin har en effektiv verkan på att eliminera Clostridium perfringens-bakterierna. I dessa sår återfinns emellertid vanligtvis en blandflora av olika bakterier, vilka är betydande för infektionen. Detta faktum gör att det kan krävas antibiotika med bredare spektrum.[8]
I maj 2011 avled en man efter han ätit, vad som påståtts vara, mat förorenad med Clostridium perfringens ombord på ett American Airlines flygplan. Mannens fru och dotter stämmer American Airlines och LSG SKY Chefs, ett tyskt företag som uppgivits ha tillagat maten, för hans död.[9]
Clostridium perfringens (tidigare Clostridium welchii) är en relativt stor grampositiv, stavformad, anaerob, sporbildande bakterie i familjen Clostridium. Bakterien är orörlig och omsluten av en kapsel. C. perfringens är extremt vanlig och förekommer nästan överallt, till exempel i multnande växter, tarmarna hos människor och andra ryggradsdjur, insekter och jord. Nästan all jordprov som tas innehåller C. perfringens.
C. perfringens verkan på döda kroppar är känd för bårhusarbetare som tissue gas och kan endast stoppas genom balsamering.
C. perfringens — великі (0,8-1 × 4-8 мікрон) плеоморфні паличкоподібні грам-позитивні бактерії. Ендоспори овальні, розташовані центрально або субтермінально. Нерухомі, в організмі людини утворюють капсулу. Утворюють стабільні L-форми, здатні рости на поверхні скла[2].
C. perfringens — хемоорганогетеротроф, облігатний анаероб. Росте на простих живильних середовищах за анаеробними умовами. На агарирозвних середовищах утворюються круглі колонії 1-2 мм в діаметрі з гладким або зубчастим краєм. Колонії, що виросли в товщі агару, мають сочевицеподібну форму. У рідкому середовищі — помутніння з подальшим проясненням середовища і утворенням білуватого пластівцеподібного осаду. На середовищі Кітт-Тароцці — помутніння з рясним газоутворенням. На кров'яному агарі утворюються круглі гладкі сіруваті колонії, що поступово зеленіють і стають оточені зоною гемолізу β-типа. На жовтковому агарі, зважаючи на утворення лецитінази, утворюються зони преципітації. Ця бактерія здатна зброджувати глюкозу, лактозу, мальтозу і цукрозу з активним газоутворенням. Синтезує також масляну кислоту в ході ацетобутіратного бродіння, здатний відновлювати нітрат[3].
У 1989 році було проведено картування геному C. perfringens з використанням методу пульс-електрофорезу[4], у 2001 році була визначена нуклеотидна послідовність всього геному C. perfringens штаму 13, його геном представлений однією кільцевою двуцепочечной молекулою ДНК розміром 3031430 пар основ, вміст ГЦ становить 28,6 % кількість відкритих рамок зчитування 2660, також є плазміда pCP13 розміром 54310 пар основ, яка містить 63 відкритих рамки зчитування[5]. Геном C. perfringens штаму ATCC13124 представлений молекулою ДНК розміром 3256683 пар основ і містить 3015 генів, з них 2899 кодують білки, вміст ГЦ становить 28,37 %[6]. У C. perfringens штаму E88 геном розміром 2799250 пар основ і містить 2372 відкритих рамки зчитування[7]. В геномі добре охарактеризовані гени ентеротоксинів[8], ці гени можуть знаходитися як на хромосомі, так і на плазмідах[9] і є мобільними елементами[10].
C. perfringens є збудником харчових токсикоінфекцій людини і одним із збудників газової гангрени. Факторами вірулентності є протеази, лецитіназа, колагеназа, гіалуронідаза та деякі інші ферменти. Ця бактерія також синтезує токсини[11][12][13], зокрема α-токсин є фосфоліпазою C, що володіє гемолітичними властивостями[14], ε-токсин є білком розміром 300 амінокислот, що утворює пори в мембранах епітеліоцитів кишечнику людини та в результаті викликає вихід іонів К+ і води з клітини; смертельна концентрація (LD50) для мишей становить 0,1 мкг на кг маси[15]. C. perfringens також синтезує Пеніцилін-зв'язуючі білки, що надають їй резистентності проти антибіотиків цього класу[16].
Clostridium perfringens (tên cũ là C. welchii hoặc Bacillus welchii) là vi khuẩn Gram dương, hình que, kị khí, là vi khuẩn sinh nội bào tử gây bệnh của chi Clostridium [1].C. perfringens thường có trong tự nhiên và có thể được tìm thấy như một thành phần thường thấy trong sự phân rã của thực vật, cặn biển, đường ruột của con người và các động vật có xương sống, côn trùng và đất. Theo báo cáo thu nhận được, thời gian ngắn nhất của một mẫu bất kỳ trong môi trường thioglycollate trung bình là 6,3 phút.[2]
C. perfringens là nguyên nhân phổ biến thứ ba gây ngộ độc thực phẩm ở Anh Quốc mặc dù đôi khi nó có thể được ăn vào mà không gây hại.
Nhiễm trùng do C. perfringens cho biểu hiện hoại tử mô, bệnh nhiễm trùng máu, viêm túi mật phồng nôn, và hoại tử, cũng gọi là hoại tử ổ nang Clostridial. Các độc tố liên quan đến hoại tử khí được gọi là α-toxin, chèn vào màng tế bào của tế bào, tạo ra khoảng trống trong màng phá vỡ chức năng tế bào bình thường. C. perfringens có thể tham gia nhiễm trùng kị khí đa bào. Clostridium perfringens thường gặp trong các bệnh nhiễm trùng như là một thành phần của hệ thực vật bình thường. Trong trường hợp này, vai trò của nó trong bệnh tật là yếu tố phụ.
Tác động của C. perfringens lên các xác chết tại các nhà xác được biết như là khí mô và chỉ có thể ngưng lại bằng cách ướp xác.
Mặc dù không có đuôi nhưng C.perfringens vẫn có thể lướt trên bề mặt bởi vì cơ thể của chúng được lót bằng sợi tơ (sợi filament) từ đầu đến cuối. Các biến thể siêu di động (hypermotile) như SM101, thường thấy phát sinh trên các cạnh của khuẩn lạc trên đĩa thạch. Video kính hiển vi sự chuyển động trượt của chúng cho thấy rằng chúng có cấu trúc thành sợi dài, mỏng cho phép chúng di chuyển nhanh như vi khuẩn có đuôi. Trình tự gen được sử dụng để xác định (các) nguyên nhân của kiểu hình siêu di động và dẫn xuất trực tiếp của chúng. So sánh chúng, chủng SM124 và SM127, các dẫn xuất của các dòng SM101 và SM102 tương ứng, chứa 10 và 6 nucleotide polymorphisms (SNPs) so với các dòng mẹ. Các đột biến trong các gen phân chia tế bào là đặc điểm chung của các dòng siêu di động.
Ở Anh và Hoa Kỳ, vi khuẩn C. perfringens là nguyên nhân thứ ba gây ra bệnh thực phẩm, với thịt và thịt gia cầm sơ chế không tốt, hoặc thực phẩm được sơ chế kỹ lưỡng, nhưng phải để lâu quá, là thủ phạm chính trong việc chứa vi khuẩn. Clostridium perfringens enterotoxin (CPE) trung gian gây bệnh là không ổn định nhiệt (không hoạt động ở 74 °C (165 °F)). Nó có thể được tìm thấy trong thực phẩm bị ô nhiễm (nếu không được làm nóng đúng cách), và ở trong phân. [5] Thời gian ủ bệnh là từ 6 đến 24 (thường là 10-12) giờ sau khi ăn phải thực phẩm bị ô nhiễm.
Vì C. perfringens tạo thành bào tử có thể chịu được nhiệt độ nấu ăn nên nếu thức ăn nấu chín được để một thời gian đủ lâu thì sự nảy mầm có thể xảy ra và các khuẩn lạc của chủng vi khuẩn này sẽ phát triển. Các triệu chứng thường bao gồm chuột rút bụng, tiêu chảy, nôn mửa, và sốt [6]. Toàn bộ diễn biến của bệnh thường được giải quyết trong vòng 24 giờ, nhưng có thể kéo dài đến hai tuần ở những người lớn tuổi hoặc người có sức khỏe yếu. [7]
Ngộ độc Perfringens cũng có thể dẫn đến một căn bệnh khác được gọi là bệnh nang hoại tử ruột (còn gọi là pigbel); Bệnh này là do cùng một chủng gây ra perfringens ngộ độc thực phẩm. Tuy nhiên, nhiễm trùng này thường gây tử vong. Số lượng lớn C. perfringens phát triển trong ruột, và tiết ra độc tố exotoxin. Độc tố này gây hoại tử ruột, các mức độ xuất huyết khác nhau và thủng ruột. Viêm thường xuất hiện ở các phần của ruột chay, vùng giữa của ruột non. Bệnh này cuối cùng dẫn đến sốc nhiễm trùng và tử vong. Bệnh đặc biệt này hiếm gặp ở Hoa Kỳ; Thường nó xảy ra ở những vùng dân số có nguy cơ cao hơn. Các yếu tố nguy cơ gây hoại tử ruột bao gồm chế độ ăn thiếu protein, chế độ ăn không hợp vệ sinh, các bữa tiệc có thịt xuất hiện lẻ tẻ (sau thời kỳ dài chế độ ăn thiếu protein), chế độ ăn có chứa một lượng lớn chất ức chế trypsin (khoai lang), các khu vực dễ bị nhiễm ký sinh trùng Ascaris (tạo ra chất ức chế trypsin). Bệnh này xảy ra ở quần thể sống ở New Guinea, một phần của Châu Phi, Trung Mỹ, Nam Mỹ và Châu Á. [6]
Nhiều trường hợp bị ngộ độc thực phẩm C. perfringens có thể vẫn còn dưới lâm sàng, vì các kháng thể đối với độc tố là phổ biến trong quần thể. Điều này đã dẫn đến kết luận rằng hầu hết dân số đã bị ngộ độc thực phẩm do C. perfringens.
Mặc dù có nguy cơ tiềm ẩn, C. perfringens được sử dụng làm chất lên men trong bánh mì muối. Quá trình nướng được cho là làm giảm bớt sự nhiễm bẩn của vi khuẩn, ngăn chặn những tác động tiêu cực [8].
Clostridium perfringens là tác nhân vi khuẩn phổ biến nhất cho hoại tử khí.
Nghiên cứu công bố năm 2014 cho thấy một dòng C. perfringens có thể liên quan đến chứng đa xơ cứng (MS). Các xét nghiệm trên chuột cho thấy một độc tố được tạo ra bởi một dòng C. perfringens hiếm gặp gây ra tổn thương giống như MS trong não, và những nghiên cứu trước đây đã xác định được chủng C. perfringens này ở người có MS [9]. Các bệnh nhân MS được phát hiện có khả năng phản ứng miễn dịch với độc tố epsilon nhiều hơn mười lần so với những người khỏe mạnh [10].
C. perfringens có thể được chẩn đoán bởi phản ứng của Nagler nơi sinh vật nghi ngờ được nuôi cấy trên một đĩa đệm lòng đỏ trứng. Một mặt của đĩa chứa chất chống độc alpha, trong khi mặt kia không. Một chuỗi các sinh vật nghi ngờ được đặt qua cả hai bên. Một vùng có độ đục sẽ hình thành xung quanh mà không có chất chống độc tố alpha, cho thấy hoạt tính lecithinase không bị ngăn cấm. Ngoài ra, các phòng thí nghiệm có thể chẩn đoán được vi khuẩn bằng cách xác định số lượng vi khuẩn trong phân. Trong vòng 48 giờ kể từ khi bệnh bắt đầu, nếu cá nhân có hơn 106 bào tử vi khuẩn trên một gram phân, sau đó bệnh được chẩn đoán là C. perfringens ngộ độc thực phẩm [11]. Các xét nghiệm / phản ứng khác: Catalase: Negative, Spot indole: Tích cực, Lecithinase: Tích cực, Lipase: Negative, Sữa Litmus: Phun ngược, Tấm CAMP ngược: Tích cực, Gas Liquid Chromatography products: (Acetic, Butyric and Lactic Acids).
Thông thường, các triệu chứng ngộ độc C. perfingens được sử dụng để chẩn đoán nó. Tuy nhiên, chẩn đoán có thể được thực hiện bằng cách sử dụng một bài kiểm tra môi trường phân, trong đó phân được kiểm tra chất độc được sản sinh bởi các vi khuẩn. [12]
Clostridium perfringens (tên cũ là C. welchii hoặc Bacillus welchii) là vi khuẩn Gram dương, hình que, kị khí, là vi khuẩn sinh nội bào tử gây bệnh của chi Clostridium .C. perfringens thường có trong tự nhiên và có thể được tìm thấy như một thành phần thường thấy trong sự phân rã của thực vật, cặn biển, đường ruột của con người và các động vật có xương sống, côn trùng và đất. Theo báo cáo thu nhận được, thời gian ngắn nhất của một mẫu bất kỳ trong môi trường thioglycollate trung bình là 6,3 phút.[2]
C. perfringens là nguyên nhân phổ biến thứ ba gây ngộ độc thực phẩm ở Anh Quốc mặc dù đôi khi nó có thể được ăn vào mà không gây hại.
Nhiễm trùng do C. perfringens cho biểu hiện hoại tử mô, bệnh nhiễm trùng máu, viêm túi mật phồng nôn, và hoại tử, cũng gọi là hoại tử ổ nang Clostridial. Các độc tố liên quan đến hoại tử khí được gọi là α-toxin, chèn vào màng tế bào của tế bào, tạo ra khoảng trống trong màng phá vỡ chức năng tế bào bình thường. C. perfringens có thể tham gia nhiễm trùng kị khí đa bào. Clostridium perfringens thường gặp trong các bệnh nhiễm trùng như là một thành phần của hệ thực vật bình thường. Trong trường hợp này, vai trò của nó trong bệnh tật là yếu tố phụ.
Tác động của C. perfringens lên các xác chết tại các nhà xác được biết như là khí mô và chỉ có thể ngưng lại bằng cách ướp xác.
Clostridium perfringens (Veillon and Zuber 1898) Hauduroy et al. 1937
Clostridium perfringens (лат.) — вид грамположительных, строго анаэробных (за исключением C. perfringens типа A) спорообразующих бактерий рода клостридий. Возбудитель пищевых токсикоинфекций человека, один из возбудителей газовой гангрены. Является санитарно-показательным организмом. Открыта в 1892 году Уэлчем и Нетталом.
Крупные (0,8—1,5 × 4—8 мкм) полиморфные палочковидные грамположительные бактерии. Споры овальные, расположены центрально либо субтерминально. Неподвижны, в организме человека образуют капсулу. Образуют стабильные L-формы, способные расти на поверхности стекла[1].
Хемоорганогетеротроф, облигатный анаэроб. Растёт на простых питательных средах в анаэробных условиях. На агаризованных средах образуются круглые колонии 1—2 мм в диаметре с гладким или зубчатым краем. Колонии, выросшие в толще агара, имеют чечевицеобразную форму. В жидкой среде — помутнение с дальнейшим просветлением среды и образованием беловатого хлопьевидного осадка. На среде Китт-Тароцци — помутнение с обильным газообразованием. На кровяном агаре образуются круглые гладкие сероватые колонии, постепенно зеленеющие и окружённые зоной гемолиза β-типа. На желточном агаре ввиду образования лецитиназы образуются зоны преципитации. Сбраживают с активным газообразованием глюкозу, лактозу, мальтозу и сахарозу. Образует масляную кислоту в ходе ацетобутиратного брожения, способен восстанавливать нитраты[2].
В 1989 году было проведено физическое картирование генома C.perfringens с использованием метода пульс-электрофореза[3], в 2001 году была определена нуклеотидная последовательность всего генома C.perfringens штамма 13, этот геном представлен одной кольцевой двуцепочечной молекулой ДНК размером 3031430 п.н. Доля пар Г+Ц составляет 28,6%. Количество открытых рамок считывания составляет 2660. Также имеется плазмида pCP13 размером 54310 п.н., которая содержит 63 открытые рамки считывания[4]. Геном C.perfringens ATCC13124 представлен кольцевой двуцепочечной молекулой ДНК размером 3256683 п.н. и содержит 3015 генов, из них 2899 кодируют белки. Доля пар Г+Ц составляет 28,37%[5]. У C. perfringens штамма E88 геном размером 2799250 п.н. и содержит 2372 открытых рамок считывания[6]. Охарактеризованы гены энтеротоксинов C. perfringens[7], гены токсинообразования могут находиться как на хромосоме, так и на плазмидах[8] и являются транспозибельными элементами[9].
C. perfringens является возбудителем пищевых токсикоинфекций человека и одним из возбудителей газовой гангрены. Синтезируют протеиназы, лецитиназу, коллагеназу, гиалуронидазу и другие ферменты агрессивности. Продуцируют также токсины[10][11][12]. α-токсин является фосфолипазой С, обладающей гемолитическими свойствами[13], ε-токсин является белком размером 300 аминокислот, образующий поры в мембранах эпителиоцитов кишечника человека и вызывающий выход ионов K+ и воды из клетки, LD50 для мышей составляет 0,1 мкг на кг веса[14].
Clostridium perfringens (лат.) — вид грамположительных, строго анаэробных (за исключением C. perfringens типа A) спорообразующих бактерий рода клостридий. Возбудитель пищевых токсикоинфекций человека, один из возбудителей газовой гангрены. Является санитарно-показательным организмом. Открыта в 1892 году Уэлчем и Нетталом.
产气荚膜梭菌(学名:Clostridium perfringens)是革兰氏阳性杆状厌氧菌,因能分解肌肉和结缔组织中的糖类而产出大量气体以及可以在体内能形成荚膜而得名。发现于人类和其他脊椎动物的肠道、昆虫和土壤等处。
二名法 Clostridium perfringens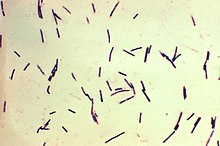
ウェルシュ菌(ウェルシュきん、学名:Clostridium perfringens)とはクロストリジウム属に属する嫌気性桿菌である。河川、下水、海、土壌中など自然界に広く分布している[1]。ヒトを含む動物の腸内細菌叢における主要な構成菌であることが多い。少なくとも12種類の毒素を作り、α, β, ε, ιの4種の主要毒素の産生性によりA, B, C, D, E型の5つの型に分類される。Clostridium perfringens B型菌の毒素はヒツジの赤痢の原因となる。
かつてClostridium welchiiという学名で呼ばれていたことがある。ウィリアム・H・ウェルチ(英語版)が分離培養し1892年にBacillus aerogenes capsulatusと命名したが、後年ウェルチにちなんでBacterium welchii Migula 1900という学名が与えられ、ついでBacillus welchiiやClostridium welchiiと呼ばれるようになった。しかし命名規約上はBacterium welchiiよりも早く命名されたBacillus perfringens Veillon and Zuber 1898に優先権があるため、これが1937年にクロストリジウム属に移されて現在の学名として登録されている。
一般に、ビフィズス菌などと対比され、悪玉菌の代表とされている。臭い放屁の原因、悪玉の常在菌である。
A型菌はヒトや動物の腸管内に定常的にかなりの数が存在し、糞便や土壌中に栄養型、芽胞型のいずれでも多数存在している。一方B~E型菌の自然の生存場所は動物の腸管内と考えられている。
グラム陽性で大きさは0.6~2.4×1.3~19.0μmの大型桿菌である。菌体はまっすぐで両端は鈍円である。芽胞は楕円形で、菌体中央または一端近くに位置して菌体より膨隆しない。本菌はほかのクロストリジウム属と異なり鞭毛をもたず運動性がない。活性酸素処理機構が弱体なため酸素濃度によって障害を受ける偏性嫌気性菌である。生体内または血清添加培地で増殖した場合、莢膜を形成する。一般に芽胞は形成されにくい。至適増殖温度は43-47℃。分裂時間は45℃で約10分間と短い。37℃で最も多くの毒素を産生する[1]。
本菌は主要な毒素(major antigen)がα、β、ε、ιの4種あり、これらの産出のパターンによってA~Eの5型に分けられる。minor antigenとして8つ、すなわちγ、δ、η、θ(溶血素)、κ(コラゲナーゼ)、μ(ヒアルニダーゼ)、λ(プロテアーゼ)、ν(DNase)があげられる。病原性の本体としてもっとも重要なのはα毒素でありA~E型全てが産出する[2]。minor antigenは局所での病巣の広がりと栄養調達に役にたっている。A型菌がヒトへの病原性を示す。一方、B~E型菌の自然の生息場所は動物の腸管内と考えられている。A型菌はα毒素、B型菌はα, β, ε毒素、C型菌はα, β毒素、D型菌はα, ε毒素、E型菌はα, ι毒素を産生する。
A型菌の主要毒素がα毒素である。A~E型菌の全てがα毒素を産出するがA型菌で最も多く作られる。α毒素の本体はホスホリパーゼC(レシチナーゼC)である。細胞膜を構成するレシチン含有リポ蛋白に作用し膜に傷害を与えて細胞を破壊する。A型菌はヒトや腸管内に定常的にかなりの数が存在し、糞便や土壌中に栄養型、芽胞型のいずれでも多数存在している。
C型菌による壊疽性腸炎の原因毒素と考えられている。
D型菌はヒツジやヤギやウシなど草食獣に感染し腸性中毒症を起こすことが知られていた。この感染症は急激に衰弱し死にいたる。ボツリヌス毒素、破傷風毒素に次ぐ強力な致死活性を示す毒素である。病理学的には脳組織の軟化と壊死、腎組織も破壊され四肢の痙攣がおこることが特徴である。稀にヒトにも感染する。D型菌の病原因子がε毒素と考えられている。ε毒素の受容体はシアロ糖タンパクと脂質が関与すると推察されている。D型菌の感染症はε毒素が腸管において腸間膜の透過性を亢進させ、その結果本毒素が生体内に取り込まれ、脳血管の透過性を亢進させ四肢の痙攣や脳浮腫や痙攣を起こすと推察されている。
E型菌の産出するι(イオタ)トキシンは二元毒素(二成分毒素、binary toxin)として知られている[4]。E型ウェルシュ菌はα毒素とι毒素を産出する。E型ウェルシュ菌は牛や馬の腸炎の原因と考えられている。stilesとWlikinsはイオタ毒素を精製し、毒素は互いに結合や相互作用がなく、Ia成分(軽鎖、イオタa成分)とIb成分(重鎖、イオタb成分)からなる二成分毒素で、両者の共存下で毒素作用を示すことを報告した[5]。イオタ毒素はディフィシル菌のCDT、ボツリヌス菌のC2毒素、スピロフォルム菌ι毒素様毒素、セレウス菌とバチルス・チューリンゲンシスの昆虫殺虫性蛋白質とともに防御抗原ファミリーに属する。また防御抗原ファミリーの中でクロストリジウム属のディフィシル菌のCDT、ボツリヌス菌のC2毒素、ウェルシュ菌のイオタ毒素、スピロフォルム菌イオタ毒素様毒素はADPリボシル化酵素活性をもつ二成分毒素である。
イオタ毒素遺伝子はE型ウェルシュ菌のプラスミドDNAからクローニングされた[6]。Ia遺伝子、Ib遺伝子の順に並び、同じ方向で転写され両者の間に存在する短い非コード領域が243b.p存在する。その塩基配列から推定されるIaのアミノ酸配列よりIaは454残基で発現する。N末側の41残基のシグナルペプチドが外れて、413残基の分子量47,605の蛋白質として産出される。このプロトキシンからN末端の13残基のプロペプチドがはずれ活性体は400残基である。Ibは876残基(分子量98,467)で発現され、N末側の39残基のシグナルペプチドがはずれ、836残基(分子量941.023)から成るプロトキシンとして菌体外に放出される。プロトキシンはタンパク分解酵素の作用で211残基のプロペプチドがはずれ664残基のアミノ酸からなる分子量74,147の成熟タンパクとなることが知られている。Iaの推定アミノ酸配列と他の蛋白質の配列を比較すると、スピロフォルム菌が産出するι毒素様毒素の酵素成分であるSaとは約80%と高いアミノ酸相同性を示す。さらに同じADPリボシル化毒素ファミリーの酵素成分(A成分)セレウス菌とバチルス・チューリンゲンシスのVIP2の配列とは32%の相同性が認められ、C2毒素のC2Ⅰとは10%の相同性である。百日咳毒素、大腸菌易熱性エンテロトキシン、コレラ毒素、ボツリヌスC2毒素、ボツリヌスC3毒素、セレウス菌殺虫毒素といった種々のADPリボシル化酵素のアミノ酸配列には芳香族アミノ酸-Arg、芳香族アミノ酸-疎水性アミノ酸-Ser-Thr-Ser-疎水性アミノ酸、Glu/Gln-x-Gluの配列はよく保存されている[7]。この部位はNAD+の結合や触媒活性に関与する共通モチーフと考えられている。さらにADPリボシル化毒素の中で立体構造が明らかになっているジフテリア毒素やコレラ毒素などと比較するとアミノ酸配列に相同性は認められないがADPリボシル化活性に寄与する触媒cavityの構造は著しく類似している[8]。コレラ毒素、百日咳毒素、ジフテリア毒素はA-B毒素として知られている。
イオタ毒素は致死、皮膚壊死活性、細胞毒性(細胞の円形化)などの作用がある。ι毒素はIaとIbの両方の投与で致死作用を示す。すなわちマウスにIa(4ng以上)、Ib(50ng以上)の静注をするとマウスは死亡する[9]。マウスのいずれかの成分を静注し、120分後に他方の成分を静注しても致死活性が認められる。一方、Iaを投与後、抗Ia抗体、その後Ibを投与すると致死活性は阻害されるが、Ibを投与して、抗Ib抗体、、次にIaを投与しても致死活性は阻害されない。モルモット皮膚壊死活性は、Ibを皮下に投与後、Iaを腹腔内投与しても認められるが、この逆の投与は活性を示さない。これらのことから生体内における毒素の作用はIbが特異的な受容体に結合することによって開始することが報告された[10]。かつては、二成分毒素は単独では生物活性は示さないと考えられていたが、IbがVero細胞においてモノマーで細胞膜に結合後、7量体のオリゴマーを形成し、ラフトに集積後Kイオン遊離を誘導すること、さらにIb単独でエンドサイトーシスを誘導して細胞内に進入することが明らかになった[11]。細胞膜上で7量体のオリゴマーを形成し、細胞からカリウムイオンの遊離作用を示すが細胞死は引き起こさない。Iaは筋肉、または非筋肉のGアクチンのArg残基をADPリボシル化する。一方、同じ二成分毒素でADPリボシル化毒素でもあるボツリヌスC2毒素のC2Ⅰは非筋肉のGアクチンのみをADPリボシル化する。Iaは基質特異性が広いのが特徴である。ADPリボシル化活性はNAD+をニコチンアミドとADP-リボースに水解するNAD+グリコハイドロラーゼ(NADase)活性と、このADP-リボース部をアクチンに転移させるトランスフェラーゼ(ARTase)活性から成る。徳島文理大学の永浜らはIaの分子中で、酵素活性に関与しているアミノ酸残基をアミノ酸置換とカイネティック分析より解析した[12]。295位Argと338位Ser残基はNAD+の結合に関与し、295位Arg、338位Ser、380位Glu残基はNADase活性に、378位Glu残基はARTase活性に関与していることを報告している。さらに彼らはIaとNADH共結晶のX線結晶解析を行った[13]。彼らはその立体構造からIaはNドメイン(N末端側1~210残基)とCドメイン(C末端側211~413残基)の2つのドメインからなることを明らかにした。これら2つのドメインはいずれも大きなcavityを有し、非常によく似た立体構造を示した。IaのNドメインは酵素活性に重要なアミノ酸残基が全て存在し、そこにNADHが結合する。IaのCドメインはIbと相互作用すると考えられている。
まとめるとイオタ毒素の作用機序はIbモノマーが細胞膜のLSRに結合し 7量体オリゴマーを形成し脂質ラフトに集積する。IbオリゴマーにIaのNドメインが結合する。IaとIbオリゴマーの複合体はエンドサイトーシスで細胞内に取り込まれる。初期エンドソームの酸性化によりIaが細胞質に遊離する。遊離したIaが細胞質のアクチンをADPリボシル化して細胞毒性を示す。ι毒素はアクチンArg177にADPリボシルグループを転移させる。Ιa毒素は非筋肉、筋肉のアクチン両方に作用する。Gアクチン(球状アクチン)をADPリボシル化するがFアクチン(Gアクチンが重合したマイクロフィラメント)には作用しない。GアクチンがADPリボシル化するとGアクチンのFアクチン重合能が消失し細胞骨格の構造が変化して細胞の変形が起こると推察されている。
Ib自体はアミノ酸配列は炭疽菌防御抗原(PA)と34%、ボツリヌス菌C2毒素のC2Ⅱと41%の相同性を示す。立体構造から4つのドメインからなる。ドメイン1(1-84)が酵素成分との結合、ドメイン2(84-302)が膜侵入領域、ドメイン3(302-416)がオリゴマー形成、ドメイン4(416-664)が細胞への結合へ関与している。PAとIbのドメインごとのアミノ酸配列のそれぞれは41%、40%、35%、16%であり、ドメイン4の相同性が低い。これは両者の結合部位の違いと考えられている[14]。またボツリヌスC2毒素のC2Ⅱとドメインごとのアミノ酸配列はドメイン1は34%、ドメイン2は38%、ドメイン3は36%と高い相同性があるが、ドメイン4は相同性が存在しない[15]。
イオタ毒素の受容体はクロストリジウム・ディフィシルの二成分毒素毒素であるCDTと同様にLSRである[16]。LSRは肝臓、小腸、大腸、肺、腎臓、副腎、精巣、卵巣を含む多くの組織で高発現している[17]。またLSR以外にCD44も受容体である可能性が示されている[18]。
Ibのドメイン4の一部である442-664アミノ酸残基からなるリコンビナント蛋白質Ib442-664はLSRと相互作用する。angubindin-1と言われるようになった[19][20]。
ウェルシュ菌が食中毒の原因になることは1953年ホブスにより確認された。ウェルシュ菌A型菌がヒトへの病原性を示す。A型菌はmajor antigenではα毒素のみを産出する。A型菌のうち(組織傷害性毒素とは別に)エンテロトキシンを産出する株によってウェルシュ菌食中毒が起こる。これがヒトへの毒性で頻度が高い。アメリカではサルモネラ中毒、ブドウ球菌食中毒に次いで多く、日本でも原因別患者数で常に上位を占めている。エンテロトキシンはウェルシュ菌の他の毒素とは異なり芽胞を形成するときにだけ産出され栄養型菌の増殖中には産出されない。ウェルシュ菌による食中毒は多量の生菌を含む食物の摂取により起こる。発症の原因は毒素であるが食物中で予め産出された毒素によるものではなく、生菌の摂取が前提になることから本症は感染型食中毒に分類される。ウェルシュ菌エンテロトキシンは芽胞形成時に産出される特徴的な毒素と考えられている。
菌で汚染された食物を加熱調理すると、耐熱性の芽胞は生残していて、調理後の冷却とともに発芽し、食物中に急激に増殖する。食物とともに腸管に達した菌は芽胞を形成する。このときにエンテロトキシンが作られ、菌体の融解に伴って放出される。この毒素が腸管粘膜細胞に作用して症状が発現する。
分離されるウェルシュ菌のうち約5%がウェルシュ菌エンテロトキシン(CPE、Clostridium perfringens enterotoxin)を産出する[21][22]。ほとんどCPE陽性株はA型ウェルシュ菌に分類されるがC型やD型であることも一般的である[23]。変異CPEを産出する菌も認められるがA型、C型、D型のウェルシュ菌が産出するCPE蛋白質のアミノ酸配列は原則として同一と考えられている。E型ウェルシュ菌の産出するCPEは10アミノ酸程度の変異が知られている[24]。
CPEはN末端の細胞障害性領域とC末端の結合領域の2つの機能的ドメインからなるA-B毒素である[25][26][27]。1997年にCPE受容体が同定され[28]、1999年にCPE受容体がクローディン-4と同一であることが判明した[29]。
A型ウェルシュ菌由来のエンテロトキシン遺伝子(cpe遺伝子)の全塩基配列(GenBank accession no.M98037)はすでに報告されている[30][31]。cpe遺伝子は染色体上またはプラスミド上に存在する。ヒトの食中毒事例に由来するcpe遺伝子の大部分は染色体上にある。かつてはヒトの食中毒事例では染色体上[32]、家畜から分離される場合はプラスミド上と考えられていた[33]。
CPEは319アミノ酸からなる分子量35317Da、等電点4,3、易熱性の蛋白質である。活性発揮のためにプロテアーゼによる切断などの翻訳後プロセシングは必要とされない[34]。しかし、トリプシン処理によりN末端側25アミノ酸を切断することにより、活性が数倍上昇する[35]。アミノ酸配列上、他の細菌由来のPore-forming toxin(孔形成毒素)との相同性は認められない[36]。例外としてアミノ酸配列の相同性がボツリヌス菌が産出するAntp70/C1蛋白質との間にわずかに認められるがその意義は明らかになっていない[37]。
CPE分子の186番目の位置にシステイン残基が1つ存在する。CPEはこのシステイン残基をはさんでN末端側とC末端側の機能ドメインに分割可能である[38]。C末端断片は感受性細胞表面に発現する受容体への結合ドメインが存在し[39][40]、N末端断片には細胞障害性発揮のために必要なドメインが含まれている[41]。active domainとbinding domainに分かれるA-B型毒素に分類される。CPEは電気泳動の際に、ドデシル硫酸ナトリウム(SDS)を加えて、変性条件下におくことにより、高分子量の自己凝集体を形成する。C末端ドメイン(アミノ酸186~319)は単一バンドとして電気泳動されることから、自己凝集活性はNドメインにあると考えられている。その後の研究ではアミノ酸290~319のC末端断片でもCPE受容体と結合した[42]。またC-CPE184-319の変異体を用いた研究ではY306、Y310、Y312、L315などがCPEとCPE受容体の結合に重要な役割を果たすことがわかった[43]。C-CPE184-319のC末端の16アミノ酸を欠失させたC-CPE303はクローディン-4とC-CPEは相互作用できなくなった[44][45]。大阪大学の近藤らはC-CPE184-319のC末端の16アミノ酸をそれぞれ置換することでドメイン・マップを作成した[46]。その結果から作成されたC-CPE変異体のひとつであるC-CPEY306/L315Aはクローディン4との結合が弱いだけではなく、多くのクローディン・ファミリーとも結合が弱いため[47][48]、C-CPEを用いた実験で陰性対照群としてしばしば用いられる。
生物活性としては細胞膜への小孔形成、小孔形成による膜透過性の変化と細胞の形態変化、細胞死が知られている。これらの細胞に対する毒性は、実験的には腸管のみならず、腎臓、肝臓などに由来する上皮系培養細胞で認められた[49][50][51][52]。多くの膜孔形成性毒素が細胞膜に存在するコレステロールなどの脂質を受容体とし、比較的広範囲の細胞種に対して作用するのに対してCPEは腸管、腎臓、肝臓などに由来する上皮系細胞に対してのみ作用することが古くから知られていた。1990年代にCPE受容体とよばれる4回膜貫通型蛋白質が同定された[53][54]。後にCPE受容体はタイトジャンクションを形成するクローディン・ファミリータンパクの一つであることが明らかにされた[55][56]。クローディン・ファミリーのうちCPE受容体と証明されているものはクローディン3、4、6、8、14である。クローディン1、2、5、10は通常の病態生理学的に想定される毒素濃度ではCPEと結合しない[57]。CPEの一部であるC-CPE(C末端CPE)はクローディンバインダーとして知られている。C-CPEはマウスにおいて大量投与した場合は肝障害を示すことが報告されている[58]。CPE感受性のあるクローディンを発現する培養細胞にC-CPEを添加するとイムノブロッティングでクローディン蛋白質の発現が低下することからC-CPEと結合したクローディンは細胞内に取り込まれ分解されると予想された[59]。タイトジャンクションのリモデリングの際にクローディンがエンドサイトーシスで細胞内に取り込まれることが報告されており[60]、クローディンとC-CPEの複合体も同様に細胞内に取り込まれ分解されると考えられている[61]。
CPEの上皮細胞への作用機構は以下の3つのプロセスからなる。すなわち、標的細胞への結合、細胞膜上の多量体化、細胞膜への孔形成というプロセスが必要である。上皮経細胞のクローディンに結合するが、この結合はキメラクローディンを用いた研究ではECS-2の領域が重要と言われていた[62]。その後の構造生物学的な検討ではECS-1とECS-2の両方との相互作用が重要であるとわかった[63]。具体的にはECS-1を構成するA39からI41がC-CPEとCPE受容体の結合に重要であることがわかった。しかしECS-1のこの部分の配列はCPE感受性のないクローディンでも保存されているため、変異体ではないクローディン・ファミリーにおいてはECS-2のアミノ酸配列でCPE感受性が決まっている[64]。クローディンに接着したCPEは細胞膜上で多量体を形成する。CPEは単量体では可溶であるが多量体では膜蛋白質となるため大きな構造変化があると考えられている。多量体形成後に細胞膜に孔を形成しカルシウムイオンを流入させることで細胞死を起こす。
ウェルシュ菌は様々な症状をおこす。
ウェルシュ菌(ウェルシュきん、学名:Clostridium perfringens)とはクロストリジウム属に属する嫌気性桿菌である。河川、下水、海、土壌中など自然界に広く分布している。ヒトを含む動物の腸内細菌叢における主要な構成菌であることが多い。少なくとも12種類の毒素を作り、α, β, ε, ιの4種の主要毒素の産生性によりA, B, C, D, E型の5つの型に分類される。Clostridium perfringens B型菌の毒素はヒツジの赤痢の原因となる。
かつてClostridium welchiiという学名で呼ばれていたことがある。ウィリアム・H・ウェルチ(英語版)が分離培養し1892年にBacillus aerogenes capsulatusと命名したが、後年ウェルチにちなんでBacterium welchii Migula 1900という学名が与えられ、ついでBacillus welchiiやClostridium welchiiと呼ばれるようになった。しかし命名規約上はBacterium welchiiよりも早く命名されたBacillus perfringens Veillon and Zuber 1898に優先権があるため、これが1937年にクロストリジウム属に移されて現在の学名として登録されている。
一般に、ビフィズス菌などと対比され、悪玉菌の代表とされている。臭い放屁の原因、悪玉の常在菌である。
웰치간균(Welch bacillus, Clostridium perfringens 클로스트리디움 페르프링겐스[*])은 혐기성 상태에서 잘 자라는 균이며 pH5 이하에서는 잘 자라지 못한다. 가스괴저균이라고도 한다.
14종의 아미노산을 요구하는 그람 양성균이며 간균이다.
난원형의 아포를 생성하며 아포를 형성할 때 A~E형 독소 또한 함께 생성한다.
일반적으로 성인의 대변에서도 0~109g/하루 정도의 양으로 검출되는데, 증식 수가 1,000,000균/g 이상일 경우 식중독 증상이 나타난다.
이 균의 잠복기는 8~24시간이며 심한 복통과 설사 증상이 나타난다.