pt-BR
nomes no trilho de navegação


Legionella pneumophila és un eubacteri gramnegatiu prim, pleomòrfic, flagel·lat del gènere Legionella.[1][2] L. pneumophila és el patogen humà primari en aquest grup i és l'agent causal de la legionel·losi o la malaltia dels legionaris. L. pneumophila és morfològicament un bacil sense càpsula no acidoresistent, no esporulat, i aeròbic i incapaç d'hidrolitzar gelatina o produir ureasa i no són fermentadors. L. pneumophila no conté pigments ni produeix autofluorescència. És oxidasa negatiu i catalasa positiu i produeix beta lactamasa.
Mentre L. pneumophila és classificat com un organisme gramnegatiu, es tenyeix dèbilment a causa del seu contingut únic en lipopolisacàrids a l'exterior de la paret cel·lular exterior .[3] En les cadenes laterals de la paret cel·lular determinen l'especificitat de l'antigen somàtic d'aquests organismes. La composició química d'aquestes cadenes laterals tant pel que fa als monòmers de sucres com la seva disposició determina la natura de l'antigen O, que són cabdals en la classificació serològica de diversos bacteris gramnegatius. Com a mínim s'han descrit 35 serovars diferents de L. pneumophila així com es realitza en altres espècies.
Els sèrums s'han utilitzat tant per a estudis d'aglutinació així com per a la descoberta directa de bacteris en teixits usant anticossos fluorescents. L'anticòs específic en pacients pot determinar-se per la prova indirecta d'anticossos fluorescents. ELISA i les proves de microaglutinació també han estat aplicades amb èxit.
L. pneumophila és un bacteri intracel·lular facultatiu que pot envair i duplicar-se dins d'amebes i, en humans, en macròfags. Amoeba spp. serveix de reservori de L. pneumophila i també proporciona protecció enfront l'estrès mediambiental com la cloració.[4] La internalització dels bacteris es pot veure potenciada per la presència d'anticossos i del complement, però no és imprescindible. Un pseudopodi es cargola al voltant del bacteri en una forma única de fagocitosi. Un cop interioritzats, els bacteris s'envolten en un vacúol lligat a membrana que no es fusiona amb els lisosomes que degradarien altrament els bacteris. Els bacteris es multipliquen en aquest compartiment protegit. Els bacteris utilitzen un sistema de secreció tipus IVB conegut com a Icm/Dot per injectar proteïnes efectores a l'hoste. Aquests efectors estan implicats en l'augment la capacitat dels bacteris per sobreviure dins de la cèl·lula de l'hoste. La supervivència és reforçada per aquestes proteïnes efectores (Proteïnes Ank) perquè interfereixen amb la fusió del vacúol que conté la legionel·la amb la degradació dels endosomes de l'amfitrió.[5]
Tenen un sistema de secreció tipus IV que secreta una metal·loproteasa de 39 kDa al líquid de cultiu, que és citotòxic per a algunes cèl·lules de teixits cultivades. El sistema de secreció tipus IV és igualment necessari per a una plena virulència.[6] La natura patògena de L. pneumophila fou reconegut després del brot de 1976 en un grup d'homes ancians que assistien a una convenció de la Legió americana a Filadèlfia, Pennsylvania (per això el nom la malaltia de legionaris). Aquest brot afectà més de 200 persones, amb 34 morts. És important destacar que no s'ha pogut demostrar la transmissió persona a persona.[7]
La determinació i publicació de les seqüències completes de genomes de tres aïllaments clínics que L. pneumophila del 2004 preparà el camí per a la comprensió de la biologia molecular de L. pneumophila en particular i de legionel·la en general. En profunditat i usant l'anàlisi comparativa de genomes varietats d'ADN per estudiar el contingut de gens de 180 soques de legionel·la revelà l'alta plasticitat de genomes i la freqüent transferència horitzontal de gens. S'aconseguí una idea més profunda del cicle vital de L. pneumophila investigant el perfil de l'expressió gènica de L. pneumophila en Acanthamoeba castellanii, el seu hoste natural. L. pneumophila exhibeix un cicle vital bifàsic i defineix diferents expressions gèniques segons si es troba en la fase transmissiva o replicativa.[2]
Legionella pneumophila és un eubacteri gramnegatiu prim, pleomòrfic, flagel·lat del gènere Legionella. L. pneumophila és el patogen humà primari en aquest grup i és l'agent causal de la legionel·losi o la malaltia dels legionaris. L. pneumophila és morfològicament un bacil sense càpsula no acidoresistent, no esporulat, i aeròbic i incapaç d'hidrolitzar gelatina o produir ureasa i no són fermentadors. L. pneumophila no conté pigments ni produeix autofluorescència. És oxidasa negatiu i catalasa positiu i produeix beta lactamasa.
Legionella pneumophila ist ein gramnegatives, unbekapseltes und sporenloses Stäbchen-Bakterium. Es ist Auslöser der Legionärskrankheit und des Pontiac-Fiebers. Die für den Menschen wichtigsten (humanpathogenen) Serotypen von Legionella pneumophila sind die Serotypen 1 (70 bis 80 Prozent aller Legionellosen beim Menschen), 4 und 6.
Legionella pneumophila ist ein obligat aerobes, gramnegatives Stäbchen mit meist monopolarer Begeißelung. Im Nativpräparat finden sich meist kurze Stäbchen, während in Kultur meist unterschiedlich große Stäbchen-Bakterien (2–20 µm) vorherrschen. Legionellen benutzen vor allem Aminosäuren als Energiequelle. Zucker können nicht zu Säuren verstoffwechselt werden. Legionellen sind auf Cystein und Eisen(III)-Ionen im Nährmedium angewiesen. Daher findet man sie in der freien Natur in der Regel in Kombination mit autotrophen Mikroorganismen (beispielsweise Eisen-Mangan-Bakterien) oder man findet sie in Amöben (beispielsweise Acanthamoeba, Naegleria). Amöben scheinen bei der Verbreitung von Legionella pneumophila eine wichtige Rolle zu spielen. Legionellen bilden keine Urease und Nitratase, sind jedoch Katalase positiv. Legionellen sind gegen Austrocknung empfindlich. Bei einer Temperatur von 60 °C überleben sie etwa fünf Minuten.
Legionella pneumophila bildet Biofilme mit einer Dichte von bis zu 100000 KBE/cm2. Der Biofilm schützt die Bakterien vor Bioziden oder rauen Umgebungsbedingungen.[1]
Legionella pneumophila findet sich weltweit in Erd- und Gewässerproben. Als Infektionsquelle für den Menschen findet man es in Warmwasserleitungen mit nicht ausreichend erhitztem Wasser (
Legionellosen treten meist sporadisch, seltener in kleinen Epidemien auf. In den USA schätzt man, dass ca. 30 Erkrankungsfälle pro Jahr und 100.000 Einwohnern auftreten. Die Legionellosen haben in den Sommer-Monaten einen Höhepunkt. In endemischen Gebieten schätzt man, dass etwa 5 % der Pneumonien auf Legionellen zurückzuführen sind. Für Deutschland schätzt man, dass knapp 4 % aller ambulant auftretenden Pneumonien auf Legionellen zurückzuführen sind.[2]
Die Legionärskrankheit ist eine atypische, interstitielle Pneumonie mit Fieber, Durchfällen, Kopfschmerzen und Desorientiertheit. Sie betrifft häufig immungeschwächte Menschen (beispielsweise Alkoholiker, HIV-Erkrankte).
Das Pontiac-Fieber ist eine akute, selbstlimitierende respiratorische Erkrankung mit Husten und Schnupfen, die meist nach sieben Tagen spontan ausheilt.
Die Übertragung erfolgt in der Regel aerogen, meist durch Einatmen von erregerhaltigen Aerosolen aus Klimaanlagen oder Wasserhähnen. Es wird geschätzt, dass nur 10 % der Infektionen wirklich zu einer Erkrankung führen. Eine Mensch-zu-Mensch-Übertragung findet nicht statt.
Die Inkubationszeit einer Legionärskrankheit beträgt zwei bis zehn Tage, die des Pontiac-Fiebers jedoch nur ein bis zwei Tage.
Legionella pneumophila adhäriert an Wirtszellen über einen Pilus und induziert eine besondere Form der Phagozytose (sog. coiling phagocytosis), entgeht aber der intrazellulären Abtötung und vermehrt sich in nicht aktivierten phagozytierenden Zellen. Legionella pneumophila induziert eine teilweise nekrotisierende Entzündung der Alveolen. Die Abwehr von Legionella pneumophila als intrazellulärer Erreger ist wahrscheinlich von T-Lymphozyten abhängig. Diese aktivieren die erregerhaltigen Makrophagen, so dass die Erreger im Inneren der Phagozyten vernichtet werden können. Legionella pneumophila produziert Exotoxine (beispielsweise Hämolysin) und Enzyme. Die Rolle im Krankheitsgeschehen dieser Exotoxine ist noch nicht abschließend geklärt. Das Protein MIP (macrophage infectivity potentiator), ein 24 kDA Protein, scheint bei der Phagozytose-Induktion beteiligt zu sein.
Die Therapie der Legionärskrankheit erfolgt meist mit Makroliden (beispielsweise Erythromycin) in Kombination mit Rifampicin oder einem Fluorchinolon. Der Erregernachweis ist nach § 7 des Infektionsschutzgesetzes meldepflichtig.
Legionella pneumophila wurde erst 1976 entdeckt, als bei einer Tagung der American Legion in Philadelphia eine Epidemie unter den teilnehmenden Veteranen auftrat. 29 der 182 erkrankten Veteranen verstarben damals. Damals erhielt die Legionärskrankheit ihren Namen.[5]
Legionella pneumophila ist ein gramnegatives, unbekapseltes und sporenloses Stäbchen-Bakterium. Es ist Auslöser der Legionärskrankheit und des Pontiac-Fiebers. Die für den Menschen wichtigsten (humanpathogenen) Serotypen von Legionella pneumophila sind die Serotypen 1 (70 bis 80 Prozent aller Legionellosen beim Menschen), 4 und 6.
Legionella pneumophila is a thin, aerobic, pleomorphic, flagellated, non-spore-forming, Gram-negative bacterium of the genus Legionella.[1][2] L. pneumophila is the primary human pathogenic bacterium in this group and is the causative agent of Legionnaires' disease, also known as legionellosis.
In nature, L. pneumophila infects freshwater and soil amoebae of the genera Acanthamoeba and Naegleria.[3] The mechanism of infection is similar in amoeba and human cells.
L. pneumophila is a Gram-negative, non-encapsulated, aerobic bacillus with a single, polar flagellum often characterized as being a coccobacillus. It is aerobic and unable to hydrolyse gelatin or produce urease. It is also non-fermentative. L. pneumophila is neither pigmented nor does it autofluoresce. It is oxidase- and catalase-positive, and produces beta-lactamase. L. pneumophila colony morphology is gray-white with a textured, cut-glass appearance; it also requires cysteine and iron to thrive. It grows on yeast extract agar in "opal-like" colonies.
While L. pneumophila is categorized as a Gram-negative organism, it stains poorly due to its unique lipopolysaccharide content in the outer leaflet of the outer cell membrane.[4] The bases for the somatic antigen specificity of this organism are located on the side chains of its cell wall. The chemical composition of these side chains both with respect to components and arrangement of the different sugars, determines the nature of the somatic or O-antigenic determinants, which are important means of serologically classifying many Gram-negative bacteria. At least 35 different serovars of L. pneumophila have been described, as well as several other species being subdivided into a number of serovars.
Sera have been used both for slide agglutination studies and for direct detection of bacteria in tissues using immunofluorescence via fluorescent-labelled antibody. Specific antibody in patients can be determined by the indirect fluorescent antibody test. ELISA and microagglutination tests have also been successfully applied.
Legionella stains poorly with Gram stain, stains positive with silver, and is cultured on charcoal yeast extract with iron and cysteine.

L. pneumophila is a facultative intracellular parasite that can invade and replicate inside amoebae in the environment, especially species of the genera Acanthamoeba and Naegleria, which can thus serve as a reservoir for L. pneumophila. These hosts also provide protection from environmental stresses, such as chlorination.[5] Legionella has been shown to proliferate on the walls of pipes in biofilms.[6] Sloughed legionella from biofilms in plumbing systems can be aerosolized through faucets, showers, sprinklers, and other fixtures which can lead to infection after prolonged exposure.
In the United States, approximately 3 infections with L. pneumophila appear per 100,000 people per year.[7] The infections peak in the summer. Within endemic regions, about 4% to 5% of pneumonia cases are caused by L. pneumophila.[8]
In humans, L. pneumophila invades and replicates inside macrophages. The internalization of the bacteria can be enhanced by the presence of antibody and complement, but is not absolutely required. Internalization of the bacteria appears to occur through phagocytosis. However, L. pneumophila is also capable of infecting non-phagocytic cells through an unknown mechanism. A rare form of phagocytosis known as coiling phagocytosis has been described for L. pneumophila, but this is not dependent on the Dot/Icm (intracellular multiplication/defect in organelle trafficking genes) bacterial secretion system and has been observed for other pathogens.[9] Once internalized, the bacteria surround themselves in a membrane-bound vacuole that does not fuse with lysosomes that would otherwise degrade the bacteria. In this protected compartment, the bacteria multiply.
The bacteria use a type IVB secretion system known as Dot/Icm to inject effector proteins into the host. These effectors are involved in increasing the bacteria's ability to survive inside the host cell. L. pneumophila encodes for over 330 "effector" proteins,[10] which are secreted by the Dot/Icm translocation system to interfere with host cell processes to aid bacterial survival. It has been predicted that the genus Legionella encodes more than 10,000 and possibly up to ~18,000 effectors that have a high probability to be secreted into their host cells.[11][12]
One key way in which L. pneumophila uses its effector proteins is to interfere with fusion of the Legionella-containing vacuole with the host's endosomes, and thus protect against lysis.[13] Knock-out studies of Dot/Icm translocated effectors indicate that they are vital for the intracellular survival of the bacterium, but many individual effector proteins are thought to function redundantly, in that single-effector knock-outs rarely impede intracellular survival. This high number of translocated effector proteins and their redundancy is likely a result of the bacterium having evolved in many different protozoan hosts.[14]
For Legionella to survive within macrophages and protozoa, it must create a specialized compartment known as the Legionella-containing vacuole (LCV). Through the action of the Dot/Icm secretion system, the bacteria are able to prevent degradation by the normal endosomal trafficking pathway and instead replicate. Shortly after internalization, the bacteria specifically recruit endoplasmic reticulum-derived vesicles and mitochondria to the LCV while preventing the recruitment of endosomal markers such as Rab5a and Rab7a. Formation and maintenance of the vacuoles are crucial for pathogenesis; bacteria lacking the Dot/Icm secretion system are not pathogenic and cannot replicate within cells, while deletion of the Dot/Icm effector SdhA results in destabilization of the vacuolar membrane and no bacterial replication.[15][16]
Legionella is auxotrophic for seven amino acids: cysteine, leucine, methionine, valine, threonine, isoleucine, and arginine.[17] Once inside the host cell, Legionella needs nutrients to grow and reproduce. Inside the vacuole, nutrient availability is low; the high demand of amino acids is not covered by the transport of free amino acids found in the host cytoplasm. To improve the availability of amino acids, the parasite promotes the host mechanisms of proteasomal degradation. This generates an excess of free amino acids in the cytoplasm of L. pneumophila-infected cells that can be used for intravacuolar proliferation of the parasite.
To obtain amino acids, L. pneumophila uses the AnkB F-Box effector, which is farnesylated by the activity of three host enzymes localized in the membrane of the LCV: farnesyltransferase, Ras-converting enzyme-1 protease, and ICMT. Farnesylation allows AnkB to get anchored into the cytoplasmic side of the vacuole.
Once AnkB is anchored into the LCV membrane, it interacts with the SCF1 ubiquitin ligase complex and functions as a platform for the docking of K48-linked polyubiquitinated proteins to the LCV.
The K48-linked polyubiquitination is a marker for proteasomal degradation that releases two- to 24-amino-acid-long peptides, which are quickly degraded to amino acids by various oligopeptidases and aminopeptidases present in the cytoplasm. Amino acids are imported into the LCV through various amino acid transporters such as the neutral amino acid transporter B(0).
The amino acids are the primary carbon and energy source of L. pneumophila, that have almost 12 classes of ABC-transporters, amino acid permeases, and many proteases, to exploit it. The imported amino acids are used by L. pneumophila to generate energy through the TCA cycle (Krebs cycle) and as sources of carbon and nitrogen.
However, promotion of proteasomal degradation for the obtention of amino acids may not be the only virulence strategy to obtain carbon and energy sources from the host. Type II–secreted degradative enzymes may provide an additional strategy to generate carbon and energy sources.
The determination and publication of the complete genome sequences of three clinical L. pneumophila isolates in 2004 paved the way for the understanding of the molecular biology of L. pneumophila in particular and Legionella in general. In-depth comparative genome analysis using DNA arrays to study the gene content of 180 Legionella strains revealed high genome plasticity and frequent horizontal gene transfer. Further insight in the L. pneumophila lifecycle was gained by investigating the gene expression profile of L. pneumophila in Acanthamoeba castellanii, its natural host. L. pneumophila exhibits a biphasic lifecycle and defines transmissive and replicative traits according to gene expression profiles.[2]
Transformation is a bacterial adaptation involving the transfer of DNA from one bacterium to another through the surrounding liquid medium. Transformation is a bacterial form of sexual reproduction.[18] In order for a bacterium to bind, take up, and recombine exogenous DNA into its chromosome, it must enter a special physiological state referred to as "competence".
To determine which molecules may induce competence in L. pneumophila, 64 toxic molecules were tested.[19] Only six of these molecules, all DNA-damaging agents, caused strong induction of competence. These were mitomycin C (which introduces DNA inter-strand crosslinks), norfloxacin, ofloxacin, and nalidixic acid (inhibitors of DNA gyrase that cause double-strand breaks), bicyclomycin (causes double-strand breaks), and hydroxyurea (causes oxidation of DNA bases). These results suggest that competence for transformation in L. pneumophilia evolved as a response to DNA damage.[19] Perhaps induction of competence provides a survival advantage in a natural host, as occurs with other pathogenic bacteria.[18]
Several enzymes in the bacteria have been proposed as tentative drug targets. For example, enzymes in the iron uptake pathway have been suggested as important drug targets.[20] Further, a cN-II class of IMP/GMP specific 5´-nucleotidase which has been extensively characterized kinetically. The tetrameric enzyme shows aspects of positive homotropic cooperativity, substrate activation and presents a unique allosteric site that can be targeted to design effective drugs against the enzyme and thus, the organism. Moreover, the enzyme is distinct than its human counterpart making it an attractive target for drug development.
Macrolides (azithromycin or clarithromycin) or fluoroquinolones (levofloxacin or moxifloxacin) are the standard treatment for Legionella pneumonia in humans, with levofloxacin being considered first line with increasing resistance to azithromycin. Two studies support superiority of levofloxacin over macrolides, although not FDA approved.[21]
Legionella pneumophila is a thin, aerobic, pleomorphic, flagellated, non-spore-forming, Gram-negative bacterium of the genus Legionella. L. pneumophila is the primary human pathogenic bacterium in this group and is the causative agent of Legionnaires' disease, also known as legionellosis.
In nature, L. pneumophila infects freshwater and soil amoebae of the genera Acanthamoeba and Naegleria. The mechanism of infection is similar in amoeba and human cells.
Legionella pneumophila es una bacteria pleomórfica, flagelada y Gram negativa del género Legionella.[1][2] L. pneumophila es el patógeno primario humano en este grupo y causante de la legionelosis o enfermedad del legionario.
Bacilo delgado, Gram negativo, móvil por flagelos.
Legionella pneumophila es una bacteria pleomórfica, flagelada y Gram negativa del género Legionella. L. pneumophila es el patógeno primario humano en este grupo y causante de la legionelosis o enfermedad del legionario.
Legionella pneumophila Legionella generoko bakterioa da, legionelosia eragiten duena. Bakterioa isolatua izan zen lehenbizikoz 1977an, Filadelfia hirian 1976an gertatu zen legionelosiaren agerraldi larri baten ostean.
Legionella pneumophila bakterio Gram negatiboa da, aerobio hertsia. Bazilo itxura du, katalasa eta oxidasa (+) da eta mugikorra, daukan flagelo polar bati esker. Ez ditu nitratoak erreduzitzen. Gram negatiboa izan arren, gaizki tindatzen da Gram tindaketarekin, ohikoa izanik tindaketa bereziak erabiltzea baziloa ongi ikusi ahal izateko [1].
Eskakizun nutritibo zorrotzak ditu, eta ez du laborategiko ohiko hazkuntza-inguruetan hazten. Besteak beste, zisteina eta burdina behar ditu. Eskakizun zorrotz horiek bere isolamendua eta identifikazioa zaildu zuten, urtebete baino gehiago igaro baitzen Filadelfiako agerraldiaren agerpena eta agerraldi horren mikrobio eragilearen identifikazioaren artean.
Bakterioaren habitat naturala ura da, eta ibai, laku, padura eta lur hezeetatik isolatu daiteke. Hortik igaro ahal da gizakiak egindako ur ingurune artifizialetara (ur biltegiak, etxe zein eraikin handiko hoditeriak, hozte dorreak...). Ingurune artifizial horiek kolonizatzen dituenean arriskutsu bihurtzen da baziloa, legionelosia eragin baitezake.
Berezko ezaugarria du Legionella pneumophilak: zelula barneko parasitoa da. Aske bizi denean, sarritan ameben barruan bizi da [2]. Gizakia infektatzen duenean, aldiz, makrofagoen barruan egon daiteke, lisosomen jarduerari aurre egiten baitio.
Gaur egun (2015ean) bakterio honen 35 serotipo inguru ezagutzen dira. Legionella pneumophilaren 1. serotipoa da patogeno garrantzitsuena.
Bere habitat naturaletan Legionella pneumophila ez da arriskutsua, baina ur ingurune artifizialak (hozte dorreak, etxe zein eraikinen hoditeriak, aire girotuaren sistemak, jakuzziak...) kolonizatzen dituenean osasunerako benetako mehatxu bihurtzen da, ingurune horien sedimentuek eta korrosio-gaiek, inguruneen tenperatura epelekin batera, bakterioaren hazkundea areagotzen dutelako nabarmen. Bakterioak eragiten duen infekzioa arnas bidetik harrapatzen denez, aerosolak sortzen dituzten mekanismoak (dutxak, hozte dorreak, aire girotuaren sistemak...), bereziki, infekzioaren fokuak izan ohi dira.
Legionella pneumophila azken urteetan azaleratzen ari den patogenotzat jotzen da, 1976an baino lehen guztiz ezezaguna baitzen. Bakterioak sortzen duen gaitza -legionelosia-, nolabait, gure zibilizazio teknifikatuaren ondorioa izaten da, aerosolak sortzen dituzten gailuen bidez (hozte dorreak, aire girotuaren sistemak...) harrapatzen baita.
Legionella pneumophilak arnas aparatuaren bi patologia eragin ditzake: Pontiako sukarra, gripearen antzeko gaitz mugatua, eta legionelosia edo legionarioen gaitza, pneumonia akutu oso larria. Legionelosi infekzio sistemikoa da, beheko arnas traktuan eragiten duena. Sukarra, eztula, hotzikarak, nekea eta buruko mina dira gaitz honen ohiko sintomak, eta pertsona inmunogutxituengan hilkorra izan daiteke.
Ez dago argi zergatik bakterioak batzuetan Pontiac-eko sukarra eragiten duen eta beste batzuetan legionelosia. Mikrobiologo batzuen ustez, bakterioaren infekzio-dosia eta gaixoaren immunitate-sistemaren egoera erabakigarriak dira gaitz arina (Pontiac-eko sukarra) edo larria (legionelosia) garatzeko orduan.
Legionelosia ez da pertsonen artean transmititzen, ezta bakterioak kutsatutako ura edaten. Arnas bidetik harrapatzen da, bakterioak dituzten aerosolak inhalatzerakoan.
Zelula barneko parasitoa denez, eta makrofagoen barruan egon daitekeenez, erantzun immune humoralak ez du balio Legionellak sortutako infekzioak kontrolatzeko. Immunitate zelularrak (T linfozitoen bidezkoa) besterik ez du organismoa babestuko patogeno horren aurka [3].
Legionella pneumophila Legionella generoko bakterioa da, legionelosia eragiten duena. Bakterioa isolatua izan zen lehenbizikoz 1977an, Filadelfia hirian 1976an gertatu zen legionelosiaren agerraldi larri baten ostean.
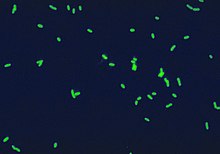
Legionella pneumophila est une bactérie intracellulaire facultative parasitant les monocytes humains et certains protistes phagotrophes (ex/ amibes) retrouvés dans les eaux douces.
Ces bactéries sont des bacilles à Gram négatif, mobiles grâce à la présence d'un ou plusieurs flagelles. Elles sont retrouvées de manière ubiquitaire dans les environnements d'eau douce et dans les terres humides. La taille des légionnelles varie de 0,5 - 0,8 à μm[1].
Les légionelles peuvent entraîner trois formes de maladies regroupées sous le terme de légionellose :

Les Légionelles représenterait 6 % des pneumonies, soit pour les 500 000 pneumonies ambulatoires recensées en 2004 en Allemagne, il faudrait compter 30 000 cas imputables directement aux Légionelles[5].
En 2004, 475 légionelloses ont été diagnostiquées en Allemagne soit 20 % de plus que l’année précédente. Cela est vraisemblablement en partie dû à l’amélioration et le recours plus systématique aux procédés de détection. L’âge et le sexe des cas observés montrent, en concordance avec les observations des années passées, que les malades sont principalement des adultes en particulier des hommes âgés alors que les enfants et les jeunes adultes ne sont guère, voire pas, affectés. Un âge avancé représente, en raison vraisemblablement d’une faible immunité ou d’autres maladies préexistantes, un risque pour la contraction de la maladie du légionnaire. La différence constatée entre les sexes est, jusqu'à présent, restée inexpliquée[6].
Les Légionelles sont tolérantes aux milieux acides. Elles ont ainsi pu être observées dans des milieux possédant des pH allant de 2,7 à 8,3, dans des sources d’eau salée ou encore dans des nappes phréatiques dont la température était inférieure à 20 °C[3]. L’étude de l’influence de la température sur le développement de bactéries L. pneumophila de trois souches différentes a permis de définir l’intervalle de température optimal de croissance autour de 42 °C avec une absence de multiplication pour des valeurs supérieures à 44 - 44,2 °C[7]. Des Légionelles ont été observées dans des systèmes d’eau chaude dont la température s’élevait à plus de 66 °C. L’observation d’une production de dioxyde de carbone pour des températures allant jusque 51,6 °C suggère que certains enzymes respiratoires des Légionelles survivent encore à ces températures. Elles peuvent être exposées à des températures de 50 °C pendant plusieurs heures sans être détruites[3]. La température influence également la mobilité et la résistance en modifiant la formation des pili et des flagelles. Cela signifie qu’elle a un impact direct sur la virulence de L. pneumophila[8].
Un certain nombre d’autres variables affecte les Légionelles. L’étude statistique d’eau de réservoir d’eau potable corroborée à la présence et le cas échéant le degré de contamination a permis d’établir ces paramètres. Ainsi, l’augmentation de la dureté de l’eau et de sa conductivité, la présence de volume de stockage et de douches influencent positivement la présence et la croissance des Légionelles. De même, une augmentation du pH coïncide significativement avec une augmentation simultanée de la fréquence de colonisation observée. A contrario, une augmentation de la température au-dessus de 50 °C entraîne une diminution des observations de Légionelles[9],[10]. Ces paramètres ont une influence variable suivant les souches de Légionelles[11].
La qualité de l’eau a, elle aussi, une influence déterminante sur la survie des Légionelles. Il est en effet démontré que des Légionelles s’étant développées dans une eau faiblement chargée en éléments nutritifs présentent une résistance accrue à l’action désinfectante du chlore[12]. Une eau pure ne permet pas aux Legionella pneumophila de proliférer. Elles y survivent mais ne se multiplient pas. Les acides aminés sont l’élément nutritif principal requis pour la croissance des Légionelles[3]. Les Légionelles ont également besoin de sels de fer dissous qui sont presque toujours présents sous forme de produit d’oxydation ou présents dans l’eau utilisée pour produire l’eau potable[13]. De plus, les concentrations en fer, zinc et potassium favorisent la croissance des L. pneumophila ce qui sous entend que la nature des canalisations et leur produit de corrosions peuvent être des éléments importants dans leur développement[14]. De même, la turbidité doit être prise en compte. En effet, les particules contenues dans l’eau et dont le diamètre est supérieur à 7 μm peuvent protéger les bactéries coliformes de l’action du chlore[15].
La comparaison entre les souches de Légionelles issues de sujet atteint de légionelloses et de souches prélevées dans différents environnements, montre qu’il existe une différence de répartitions. Les Legionella pneumophila représentent 43 % des Légionelles que l’on peut trouver dans l’environnement alors qu’elles sont détectées dans 96 % des cas d’infections humaines. Parmi ces Legionella pneumophila infectieuses, 88 % appartiennent au serogroupe 1 contre 43 % en règle générale. Enfin, 79 % appartiennent au sous groupe mAb2+, lorsque ce rapport est de seulement 43 % dans les prélèvements dans l’environnement. Ces observations permettent d’affirmer que certaines souches de Légionelles sont plus pathogènes pour l’homme que d’autres[16].
Plusieurs organismes, incluant des protozoaires, des algues et certaines bactéries autres que les Légionelles, ont montré, lors de tests en laboratoires, qu’ils favorisaient la croissance, à des degrés divers, des Legionella pneumophila[17].
Les contaminations de réseau d’eau potable par les légionelles sont statistiquement corrélées à la présence d’amibes[9]. Les Legionella pneumophila peuvent, en effet, être des parasites intracellulaires. Les Légionelles sont ainsi susceptibles de parasiter des amibes et de se multiplier à l’intérieur. Elles peuvent se multiplier dans 17 espèces d’amibes différentes[3],[18]. Il semble que leurs mécanismes d’infection aient évolué et contribuent à privilégier certains protozoaires plus que d’autres et en particulier Acanthamoeba, Naegleria et Hartmanella spp[18]. Leur capacité à se multiplier à l’intérieur des amibes reste dépendante de la température. Une étude rapporte que le nombre d’espèces supportant leur multiplication est sensiblement inférieur à 42 °C qu’à 35 °C et qu’à 45 °C aucun des six échantillons d’amibes étudiés dans le cadre de cette étude n’autorisait une augmentation du nombre de Légionelles[17].
Les Légionelles trouvent au sein de ces protozoaires une protection contre l’action des désinfectants. Les Legionella pneumophila infectant des kystes de d’Acanthamoeba polyphaga peuvent même résister à des concentrations de plus de 50 mg/l de chlore[19]. Ces Protozoaires peuvent être issus de cours d’eau, d’eau stagnante ou encore de réservoirs d’eau potable. Ils peuvent donc servir de refuge aux Légionelles et leur permettre ainsi de survivre également à des modifications du milieu telles qu’une dessiccation ou encore une modification de la température devenant moins propice à leur multiplication.
Une étude a montré que les Légionelles qui ressuscitaient après être passées en état VBNC (Viable But Non-Culturable) présentaient une plus forte résistance contre l’action antimicrobienne du cuivre et de l’argent[20]. Les L. pneumophila issues des protozoaires sont courtes, épaisses et hautement mobiles. Elles possèdent une paroi épaisse et lisse, expriment différentes protéines et gènes. Elles possèdent, par exemple, une concentration en b-hydroxybutyrate plus élevée. Toutes ces modifications entraînent une résistance plus importante aux antibiotiques et biocides, une capacité de pénétration des cellules de mammifères supérieure et une virulence accrue[8]. Des études ont montré que les Légionelles dépourvues de flagelles étaient moins aptes à infecter les protozoaires et les macrophages que leurs congénères qui en étaient munies[3]. Les flagelles influent notamment la mobilité. Or, les lignées issues des amibes sont hautement mobiles. Cette propriété est présumée faciliter la contamination et est corrélée à l’expression d’autres traits virulents. Des Légionelles issues d’amibes exposées pendant 24 heures à 5 μg/ml de rifampin (antibiotique) survivent à 71 % lorsque leurs congénères s’étant développées librement périssent à 99,9 %. Les germes issus du parasitisme d’amibes sont donc non seulement plus résistants aux agents antimicrobiens mais également plus virulents[8].
Le parasitisme pourrait être, par le renforcement de la virulence et de la résistance des Légionelles, une première étape nécessaire avant la contamination humaine [21]. Le nombre de germes n’est ainsi donc pas le seul facteur relevant pour provoquer une infection mais également « le vécu » du germe[22].
La virulence des Légionelles est liée à leur capacité de prolifération dans l’hôte où elles infectent de façon opportuniste les cellules phagocytaires. La façon dont elles infectent les macrophages est la même que pour les amibes[17]. L’infection n’est pas seulement liée à la virulence et au nombre de bactéries mais également à la prédisposition et à la sensibilité de l’organisme infecté[3],[4] notamment la consommation de cigarettes, l’âge et en général les personnes au système immunitaire affaibli. L’infection de l’homme par les Légionelles est, du point de vue des Legionella pneumophila, irrémédiablement fatale. En effet, jamais une transmission d’homme à homme n’a pu être constatée[4]. Cela induit que les mutations permettant à Legionella pneumophila d’infecter et de parasiter les macrophages humains ne peuvent être transmises et disparaissent. La capacité de L. pneumophila à réaliser l’infection pulmonaire d’un hôte est donc la conséquence de la pression sélective exercée par les amibes qui sont une autre classe de phagocytes[8].
Les amibes qui croissent dans une eau à température élevée, tolèrent des températures plus hautes que des amibes issues d’une eau plus froide. Cela signifie que les amibes peuvent, dans une certaine mesure, s’accoutumer à leur environnement[23]. D’autres pathogènes profitent des amibes notamment Mycobacterium, Sarcobium, Vibrio, Pseudomonas, Burkholderia, Listeria, ou encore Francisella[8]. Un parasitisme des protozoaires par Campylobacter jejuni (bactérie responsable d’infections alimentaires la plus répandue dans le monde) a également été observé[24].
Pour finir et souligner une fois de plus l’importance des relations bactérie/protozoaire : une souche inconnue de bactérie, s’apparentant aux Legionella et ne pouvant se multiplier uniquement que grâce à un parasitisme intracellulaire, a été découverte dans des réservoirs d’eau potable[25].
Le biofilm est un facteur important du développement de Legionella pneumophila. Le biofilm contient environ 95 % des microorganismes présents dans les réseaux d'eau[26]. Les micro-organismes forment le biofilm comme un mécanisme de protection contre les conditions défavorables du milieu telles que des températures extrêmes ou une faible concentration en éléments nutritifs. La rugosité de la surface sur laquelle se développe le biofilm joue un rôle essentiel. Le biofilm est constitué de polysaccharide sécrété par les cellules. Cette substance est une matrice de polysaccharide polyanionique hydraté produite par polymérase et rattachée aux composants lipopolysaccharide des cellules du mur[27]. À toutes les étapes de la formation du biofilm, des portions du film peuvent être arrachées par les turbulences du courant de l’eau et ainsi mettre en suspension les micro-organismes contenus dans le biofilm leur permettant de coloniser d’autres parties du système hydraulique. Le biofilm est un écosystème extrêmement complexe constitué de bactéries, d’algues, de fongi et de protozoaires[3].
Le biofilm facilite non seulement les échanges d’éléments nutritifs et gazeux mais aussi, protège les micro-organismes des biocides, des augmentations temporaires de température et des tentatives d’élimination physique en particulier sur les surfaces corrodées ou entartrées. Un biofilm peut se former aux interfaces eau-solide mais également aux interfaces eau-huile. Il se forme préférentiellement là où les vitesses sont moindres et où l’eau stagne. Les Légionelles présentes à l’intérieur du biofilm sont plus résistantes que celles sous forme planctonique. Les biofilms jouent un rôle clé dans la présence persistante des Légionelles pendant des conditions de stress[3],[28]. Si les biofilms les protègent, les Legionella pneumophila ne semblent cependant pas capables de se multiplier massivement en leur sein. Une étude a ainsi montré que le développement des biofilms de Legionella pneumophila était curieusement dû principalement à la réplication des bactéries planctoniques[29].
La prévention de la formation de biofilm est une mesure déterminante contre la prolifération de Legionella pneumophila. En effet, lorsqu’un biofilm s’est formé, il est difficile de l’enlever, en particulier dans les systèmes de canalisations complexes. Les éléments favorisant l’apparition d’un biofilm sont : la présence de nutriments dans l’eau ou dans les éléments constitutifs du système, l’entartrage et la corrosion, les températures d’eau élevées, l’eau stagnante ou les faibles flux notamment dans les bras morts des réseaux de canalisations ou dans les cuves de stockage par exemple (et aussi les équipements surdimensionnés et/ou faiblement utilisés)[3]. L’accumulation de tartre, d’algues, de boues, de vase ou limons, de rouille et autres produits d’oxydation dans les systèmes d’adduction d’eau potable favorise la croissance de biofilms et de Legionella Pneumophila. L’entartrage et la corrosion augmentent la surface disponible et rendent possible la formation de micro niches protégées des produits désinfectants véhiculés par l’eau. Ils sont responsables d’une augmentation de la concentration en nutriments et en fer. Les croissances de biofilm incontrôlées peuvent même aller jusqu'à obstruer les canalisations. Il convient cependant de relativiser car les biofilms présent dans les réseaux d’eau potable sont le plus souvent très minces. La présence simultanée d’un biofilm et de protozoaires double l’effet protecteur pour les bactéries. Ils permettent l’augmentation de la charge organique et inactivent les concentrations résiduelles de désinfectant[3].
Les matériaux constituant les canalisations sont un facteur de développement du biofilm. Les matériaux synthétiques peuvent, par exemple, comporter des composés organiques qui peuvent fournir une source de nutriments pour les micro-organismes. Il a été observé que le polyéthylène réticulé était lié à des concentrations de biomasse deux à trois fois supérieures à celle observées dans les canalisations en acier inoxydable[30]. Certains caoutchoucs fournissent un substrat riche en nutriments, préférentiellement colonisés par les bactéries. Le cuivre présente une résistance à la colonisation, mais finit à terme par être aussi recouvert d’un biofilm et se corroder, et perd ainsi sa capacité de résistance aux micro-organismes[30]. L’étude de 452 échantillons d‘eau prélevés aléatoirement dans des résidences familiales des banlieues de deux villes allemandes a montré que les canalisations en cuivre n’avaient pas d’effet inhibiteur contre le développement des bactéries et qu’au contraire elles étaient plus fréquemment colonisées que les canalisations synthétiques ou en acier galvanisé[31]. Les matériaux métalliques sont plus sujets à la corrosion ce qui favorise la formation d’un bio film[3].
La contamination d’un système peut être due à une portion très réduite d’un système non exposée aux fluctuations thermiques et aux désinfections[3].
Les biofilms flottants sont aussi très fréquemment contaminés par les Légionelles et les amibes qui leur sont associées. Ces biofilms flottants permettent notamment aux L. pneumophila de coloniser des parties de réseau qui leur seraient normalement inaccessibles[32].
Une étude a mesuré un nombre de colonies bactériennes, dans un réseau expérimental, plusieurs fois plus élevé après une désinfection (dioxyde de chlore) qu’auparavant et la présence persistante d’un biofilm que la désinfection n’a donc pas permis de détruire. Cela montre qu’une désinfection insuffisante peut superficiellement endommager le biofilm et entraîner la libération de micro-organismes dans le système[33].
Tout exploitant d’un établissement mettant de l’eau à la disposition du public est responsable de la protection des utilisateurs des installations face aux éventuels risques[34]. La désinfection d’une installation d’eau potable domestique est réservée aux cas de contamination accidentelle du réseau[26]. Le but d’une désinfection d’un système contaminé par les Légionelles est d’obtenir durablement moins de 100 UFC / 100 ml à chaque point de prélèvement[35].
On distingue deux types de désinfection. Les désinfections discontinues, qui procèdent par un traitement choc en coupant le circuit de la distribution et dont la durée de l’intervention est limitée dans le temps. L’eau ne répond alors plus aux normes relatives à la distribution d’eau potable. Le deuxième type de désinfection est la désinfection de type continue, qui consiste comme la première, à installer un dispositif sur le réseau injectant un désinfectant. Contrairement à une désinfection discontinue, une désinfection continue ne cherche pas à obtenir des résultats immédiats. La différence se situe également dans le fait que dans le choix d’une désinfection continue, il faut que l’eau traitée reste aux normes[36]. En effet, l’eau continue d’être utilisée et le réseau continu de fonctionner normalement. Le traitement n’est pas limité dans le temps, il est arrêté lorsque les résultats escomptés sont atteints. Les désinfections discontinues ne permettent souvent qu’une élimination éphémère des germes. Le contrôle des contaminations microbiennes requiert, en effet, le maintien d’une concentration résiduelle de désinfectant constante dans l’ensemble du réseau. Les amibes et en particulier les kystes d’amibes jouent le rôle de réservoir à Légionelles et permettent la recolonisation rapide des réseaux dès l’arrêt des désinfections. Des stratégies de traitement ayant pour cibles les amibes devraient, notamment, permettre d’améliorer le contrôle des Legionella pneumophila[37].
De nombreuses études ont montré que la température minimale pour une désinfection par choc thermique était de 60 °C[38]. L’élévation de la température permet de tuer aussi efficacement les Légionelles qu'une exposition des bactéries aux ultraviolets et plus rapidement qu’une concentration de chlore à 4-6 mg/l ou d’ozone à 1-2 mg/l[39]. L’interruption de la recirculation d’une boucle de recirculation de l’eau chaude et l’augmentation de la température à plus de 60 °C n’a aucun impact sur les populations de Légionelles[31]. D’après la DVGW-Arbeitsblatt W 551, l’ensemble du réseau doit au minimum être désinfecté 3 minutes à 70 °C. Cette action présente le risque d’endommager les installations et d’entraîner une turbidité anormale[36]. La désinfection thermique présente également le risque d’entraîner des brûlures. Des cas mortels de brûlures dues à des réseaux d’eau chaude ont déjà été reportés[4]. À la suite d'une mise en application d’une désinfection thermique, les auteurs d'une autre expérience rapportent que 5 minutes « de chasse » et de chauffage à plus de 60 °C ne sont pas suffisantes. Ils recommandent 30 minutes. Cette étude rapporte également que le nettoyage des robinets et des pommeaux de douche n’a eu aucune influence sur la contamination de Légionelles[40]. L’étude des effets d’une désinfection thermique sur des Légionelles intra protozoaire montre que 3 minutes à 70 °C ne suffisent pas, l’étude recommande 73 °C pendant 10 minutes pour pouvoir obtenir des résultats probants[33]. Les recommandations en France sont les suivantes : 30 minutes à 60 °C en tout point du réseau.
Le type et la dose de désinfectant doivent être soigneusement sélectionnés en fonction de la situation. C'est-à-dire en prenant en considération les paramètres caractéristiques de l’eau pH, dureté, les teneurs en composés organiques et inorganiques[38].
Les agents désinfectant énumérés ci-après concernent des désinfections chimiques utilisées en continu et non des désinfections par traitement choc.
L’injection de cuivre ou d’argent est généralement interdite, par exemple, en Allemagne sauf dérogation accordée par la commission de l’eau potable de la BRD1[36]. Toutefois, de nombreuses études ont été menées sur l’utilisation des ions d’argent et de cuivre et les résultats intéressants méritent d’être cités.
Une étude du pouvoir bactéricide de l’argent s’est intéressée à la résistance de trois bactéries : Legionella pneumophila, Pseudomonas aeruginosa et Escherichia coli. C’est L. pneumophila qui a montré la plus forte tolérance à l’exposition aux cations d’argent[41]. Néanmoins, le recours aux cations d’argent et de cuivre semble permettre de lutter efficacement contre les Légionelles. La désinfection de deux hôpitaux contaminés par des Legionella pneumophila en est un exemple. Les cations ont été pour cela injectés de manière séquentielle dans la boucle de recirculation de l’eau chaude et ont permis d’éliminer les germes en 4 semaines dans le premier bâtiment et en 12 semaines dans le second hôpital. Il n’y a pas eu de recolonisation avant 6 - 12 semaines après la désactivation du dispositif dans le premier hôpital, et après 8 - 12 semaines dans le deuxième hôpital. Des concentrations significatives de cuivre ont été retrouvées dans le biofilm. Cela pourrait expliquer pourquoi il n’y a pas eu de recolonisation avant un certain laps de temps[42]. L’utilisation simultanée de cuivre et d’argent entraîne une efficacité multipliée comparativement à l’action de chaque métal pris individuellement. L’utilisation de ces métaux est une option viable pour les systèmes de recirculation d’eau chaude. Les concentrations résiduelles doivent être contrôlées du point de vue de la potabilité et de la possible action sur les eaux usées[38]. Une autre étude a montré que l’utilisation des ions cuivre-argent ne permettait pas d’éliminer le biofilm et qu'à la suite de l’arrêt du traitement, la recolonisation du réseau s’opérait systématiquement [37].
L’utilisation d’ionisateur de cuivre/argent requiert lors de son utilisation sur des grandes installations de multiplier les équipements, ce qui engendre un coût prohibitif[43].
Les oxydants sont les produits de désinfections les plus couramment utilisés[44].
Dissous dans l’eau, le chlore gazeux, le l’hypochlorite de sodium et l’hypochlorite de calcium, le chlorure de chaux et le chlore produit à partir d’électrolyse d’ions chlorure agissent tous de la même manière, par la formation d’acide hypochloreux (HOCl)[45]. Le chlore est le désinfectant le plus utilisé mais en raison de sa propension à former des sous produits de réactions toxiques (trihalomethanes, chloroforme…) d’autres réactifs sont utilisés. La dose autorisée est de 1,2 mg/l. En sortie de traitement de désinfection, la concentration résiduelle ne doit pas excédée 0,3 mg/l[44].
Les concentrations requises pour le contrôle des L. pneumophila sont de 2 à 6 mg/l (désinfection discontinue) lorsque les concentrations habituellement utilisés dans le traitement de l’eau potable sont de l’ordre de 1 mg/l[38]. Les limitations de l’utilisation du chlore sont essentiellement liées à l’apparition de sous produits de réactions, notamment, les méthanes tri halogénés (THM)[46].
Avec un pH inférieur à 7,6, le chlore est présent majoritairement sous forme d’acide hypochloreux HOCl. Pour un pH supérieur, c’est sous la forme d’ion hypochlorite ClO-. L’acide hypochloreux est plus biocide que l’ion hypochlorite[44],[38]. Cela a pour effet de diminuer l’efficacité du chlore lorsque le pH augmente[46].
La température améliore sensiblement l’efficacité du chlore contre les Légionelles. Il a été ainsi constaté une réduction du nombre de bactérie plus importante, dans un temps plus restreint, pour une température de 43 °C contre 25 °C, pour les mêmes concentrations de chlore utilisées[39]. Dans les eaux contenant de l’ammoniac, le chlore réagit en formant des chloramines. Même avec des faibles concentrations, cela peut entraîner l’apparition d’odeurs et la diminution de la teneur en chlore libre[46].
Le chlore affecte les mécanismes respiratoires et de transport des bactéries ainsi que les acides nucléiques. Les Légionelles sont plus résistances aux chlore que les E. coli et d’autres bactéries utilisées comme indicateur de contamination de l’eau. Les retours sur expériences permettent d’affirmer que le chlore permet de supprimer les Légionelles mais rarement de manière définitive sans doute en raison des refuges que constituent les biofilms[47] et les amibes[19],[37].
Le dioxyde de chlore est un gaz explosif et instable en solution à partir d’une certaine concentration. Il ne peut par conséquent n’être utilisé qu’en solution d’une concentration maximale de 4 g/l de ClO2 et cela dans le but de minimiser les concentrations des émanations dans les volumes d’air au-dessus de la solution. Pour des raisons de sécurité et éviter les risques liés au transport, les solutions de dioxyde de chlore doivent être réalisées sur le lieu de leur utilisation.
Dans l’eau potable, les Chlorites ClO2- sont le produit de réaction prédominant du dioxyde de chlore. Ils correspondent à environ 50 à 70 % de la quantité de dioxyde de chlore ayant réagi. Le reste est converti en chlorates ClO3− et Chlorure Cl−[48]. La production des ions chlorites est indésirable. Les chlorites sont, en effet, considéré comme un poison du sang. Les chlorates sont également potentiellement dangereux pour la santé humaine. Il a été ainsi montré chez l’animal que les chlorites comme les chlorates endommageaient le sang par oxydation. De même, ils sont responsables de complications chez la femme enceinte[43]. Leur concentration maximale autorisée est, par conséquent, de 0,2 mg/l[46],[44] et fait l’objet d’une référence qualité en France fixée à 0,2 mg/l. La concentration maximale de dosage est limitée à 0,4 mg/l en Allemagne[44],[45].
Il existe plusieurs procédés de fabrication d’une solution de dioxyde de chlore. À la sortie du traitement, il doit rester 0,05 mg/L de dioxyde de chlore résiduel au minimum. Contrairement au Chlore, l’efficacité du dioxyde de chlore n’est pas aussi fortement dépendante du potentiel d’hydrogène. Même si une meilleure efficacité est notable pour des pH élevés[46],[48]. Il ne réagit pas avec l’eau, mais uniquement avec son contenu. Cela signifie que le dioxyde de chlore est simplement dissout dans l’eau et non pas hydrolysé ou dissocié. Il est important de souligner que le dioxyde de chlore est en revanche peu stable et que cette stabilité est quant à elle fortement liée au pH, à la température ainsi qu’à l’exposition à la lumière[44].
L’utilisation du ClO2 est parfois préférée à celle du chlore car elle produit moins de substances organochlorées et pas de chloroformes. Ses qualités de désinfection ne dépendent pas de la présence d’ammoniac et il n’oxyde pas le bromure. Cependant, les concentrations autorisées en eau potable sont telles que la durée de vie du ClO2 est tout de même fortement dépendante de la qualité de l’eau. Il est pour cela souvent utilisé en complément d’une autre désinfection, en complément d’une désinfection au chlore par exemple[49].
Enfin, comme pour le chlore, les risques de corrosion doivent être pris en considération en particulier pour les réseaux en acier[50].
Plusieurs analyses de cas pratiques d’utilisation du dioxyde de chlore pour la désinfection de réseaux d’eau potable en milieu hospitalier confirment que le choix du dioxyde de chlore est approprié pour lutter contre les Légionelles. Il ressort de ces études que six mois minimum sont nécessaires avant d’observer une diminution importante des Légionelles. Les durées nécessaires observées pour l’élimination des Légionelles varient, le plus souvent, de 39 semaines à 6 ans (17 mois[4]). Une concentration supérieure à 0,1 mg/L est efficace pour éradiquer L. pneumophila et une concentration résiduelle comprise entre 0,3 et 0,5 mg/L est souhaitable (la limitation est de 0,2 mg/l en Allemagne). Les concentrations requises restent au-dessous des limitations de l’EPA contrairement à une hyperchloration par exemple[43],[51],[52],[50].
Le dioxyde de chlore utilisé de manière continue, est rapporté par certains auteurs, comme étant le désinfectant le plus efficace pour contrôler Legionella pneumophila dans l’eau potable. Il est le seul permettant d’observer un effet dans les bras mort du réseau. Il permet de réduire significativement la flore microbienne notamment le biofilm[37].
Le dioxyde de chlore ne semble pas permettre une élimination complète des Legionella pneumophila. Cependant, il a démontré que cela n’est pas nécessaire et que seule une limitation de leur concentration suffit à prévenir de la Légionellose[52].
Il est difficile d’obtenir une concentration résiduelle satisfaisante dans le réseau d’eau chaude. Le fait d’ouvrir et de laisser couler les robinets et les douches régulièrement permet d’améliorer l’efficacité de la désinfection au dioxyde de chlore. Pour minimiser la réaction du dioxyde de chlore avec les composés organiques dissous dans l’eau, l’injection peut se réaliser à la sortie des cuves de stockage de l’eau chaude. Cela a pour effet de réduire le temps de contact du dioxyde de chlore avec l’eau et d’avoir des concentrations résiduelles plus hautes dans les canalisations où cela est souhaité[52],[51],[50].
Le Brome n’est pas utilisé pour la désinfection de l’eau potable. Reporté comme moins efficace que le chlore, il permet toutefois de maintenir les réseaux vierges de contaminations incontrôlées tant que la concentration résiduelle est maintenue[38].
L’iode a déjà été utilisé pour désinfecter l’eau potable. Cependant, peu d’informations sont disponibles quant à sa capacité de lutte contre les Légionelles[38].
L’eau oxygénée est une solution incolore et soluble dans l’eau. Elle se décompose en eau et oxygène. Sa dégradation est favorisée par la chaleur, la lumière, les matières en suspensions, les métaux lourds et les composés organiques. L’eau oxygénée en forte concentration peut produire des réactions dangereuses et ne doit en conséquence qu’être utilisée qu’en concentration maximale de 35 %[53].
Le peroxyde d’hydrogène et le permanganate de potassium sont des désinfectants moins puissants que le chlore et l’ozone et sont de ce fait peu utilisés. Le peroxyde d’hydrogène n’est pas autorisé en Allemagne pour la désinfection de l’eau potable. L’action désinfectante du permanganate de potassium est fortement dépendante du pH[38].
L’ozone possède une plus puissante capacité désinfectante ainsi que d’oxydation que le chlore ou le dioxyde de chlore. Cela oblige à toujours prendre en compte les réactions complexes que les composés dissous dans l’eau à traiter peuvent engendrer[46]. L’ozone réagit avec le bromure et forme des bromométhane et bromate dont la concentration maximale est limitée à 10 μg/L[46]. Il n’est pas influencé par la température et la présence d’une concentration de 4 à 6 mg/l de matières en suspension n’entrave pas son pouvoir désinfectant[39]. L’ozone est plus efficace que le chlore pour détruire les Légionelles mais il ne permet pas d’obtenir une désinfection résiduelle ce qui est un désavantage majeur par rapport au chlore ou au dioxyde de chlore dans le contrôle de L. pneumophila[38].
L’utilisation des Chloramines pour la désinfection de l’eau potable n’est pas autorisée en Europe. Les résultats d’expériences ci-après proviennent des États Unis d’Amérique.
Les Halamines ne peuvent pas être utilisés pour le traitement de l’eau potable. Les Halamines organiques peuvent être utilisés pour la désinfection contre les L. pneumophila et ce sous de larges conditions. Leur stabilité exceptionnelle les destine en particulier au traitement où cette propriété est requise tel que le traitement de circuit de refroidissement ou d’air conditionné. Les Halamines organiques ne sont pas corrosifs. Les Halamines combinés possèdent un grand potentiel pour le maintien de circuit fermé d’eau de refroidissement vierge de contamination aux Legionella pneumophila[54].
Une étude portant sur 2 ans a observé l’impact du changement de la désinfection de l’eau municipale en désinfection aux Chloramines. On observe une nette diminution des colonisations par les Légionelles. Seuls dans les bâtiments où la température était inférieure à 50 °C on a observé parfois une augmentation des colonisations. Les auteurs recommandent d’étendre l’utilisation des Chloramines pour la désinfection dans le but de diminuer la prévalence des légionelloses aux États-Unis[55]. Une autre étude de quatre mois portant sur 96 bâtiments confirme ces observations[10]. Les Monochloramines sont plus efficaces sur de grands réseaux que le chlore libre et pénètre plus efficacement les bio films riches en amibes[56].
Plusieurs composés organiques libérant des halogènes lorsqu’ils sont mis en solution dans l’eau peuvent être utilisés pour désinfecter celle-ci. Citons le BCDLH, le 2,4-dibromo-5,5- dimethylhydantoin (DBDMH), et le sel de potassium 1.3-dichloro-1,3,5-triazine-2,4,6(1H, 2H, 5H)- trione aussi appelé le dichloroisocyanurate de potassium. Le BCDMH libère de l’acide hypobromeux et de l’acide hypochloreux, le DBDMH, de l’acide hypobromeux seul[38].
L’électrolyse n’est pas un désinfectant à proprement parler mais un processus. L’utilisation d’un processus d’électrolyse engendre la formation d’un mélange de composés chimique dépendant de la qualité de l’eau traitée. Ce procédé électrochimique permet de générer de puissant oxydants autres que le chlore libre tel que l’ozone, H2O2 et OH à des concentrations de 0,3 mg/L et 60 μg/L pour l’ozone et H2O2 respectivement[57]. On distingue deux manières de procéder. La première consiste à électrolyser l’eau à traiter directement, le second consiste à hydrolyser une eau aux caractéristiques connues puis de la doser dans l’eau à traiter ce qui permet d’éviter en particulier les variations dans la formation des produits d’électrolyse dû à la variation de qualité de l’eau brute. Les systèmes de désinfection électrochimique sont cependant décrits comme inadaptés pour garantir la non contamination d’un réseau par les Légionelles[36].
De nombreux désinfectants organiques ont été utilisés dans la lutte contre les Légionelles : cétone hétérocycle (2,2-dibromo-3-nitro-propionamide (DBNPA)), guanidines (polyhexamethylene biguanide (PHMB)), thiocarbamates, aldehydes, amines, thiocyanates, composés organo-tin, amides halogenatées, et glycols halogenatés.
Le glutaraldehyde, (DBNPA), l’isothiazolin (Kathon), le PHMB et le 2-bromo-2-nitropropionamide (Bronopol) présentent une efficacité à des degrés différents. Les plus efficaces étant le DBNPA suivi du glutaraldehyde. Le PHMB, le Bromopol et le Kathon sont moins actifs que ce dernier. Les agents oxydants étant toutefois généralement plus efficaces[38].
L’utilisation d’acide peracétique pour la désinfection ponctuelle d’un hôpital contaminé par les Légionelles a permis d’obtenir des résultats rapidement mais n’a pas empêché la recolonisation rapide du réseau à des taux beaucoup plus élevés qu’avant le traitement quelques jours après. La non-destruction du biofilm, la présence de l’acide peracétique en tant que source de carbone, les probables différences de concentrations en aciers sont des pistes avancées par les auteurs pour tenter d’expliquer ces résultats[58].
La réalisation d’un « choc chloré » permet de désinfecter rapidement une installation hautement contaminée. Pour parvenir à des résultats significatifs, 10 mg/l de chlore libre au minimum (20 à 50 mg de chlore) doivent être utilisés et mesurés en chaque point du réseau et cela pendant au minimum 60 minutes. Conformément à la définition d’une désinfection discontinue, le réseau ne doit pas être utilisé pendant le traitement et être nettoyé jusqu'à retrouver des valeurs d’au maximum 0,3 mg/l avant de pouvoir être réutilisé[36].
Cependant, ces pratiques entraînent une importante production de sous produits de réaction non désirés qui peuvent être notamment préjudiciable aux procédés de traitement des eaux usées et à l’environnement. De plus, le chlore est un élément corrosif au regard des canalisations et ce point ne doit pas être négligé. Enfin, ces méthodes sont rarement efficaces, dans la mesure où elles ne permettent pas d’éliminer les « niches » que constituent le biofilm, les protozoaires et leurs kystes.
La découverte de la problématique des Légionelles à la fin du siècle dernier a permis d’accumuler des connaissances sur les facteurs de risques vis-à-vis de l’apparition de colonies de Légionelles dans les réseaux qui permettent de mettre en lumière les principaux facteurs créant les conditions favorables à l’apparition des Légionelles et les moyens de les minimiser.
La présence de systèmes complexes et étendus de réseaux d’eau chaude crée les conditions nécessaires pour le développement des Légionelles. En effet, les habitations utilisant des systèmes de chauffages instantanés sont vierges de Légionelles tandis que celles équipées de réservoirs de stockage et de boucles de recirculations sont au contraire fréquemment contaminées. Les résultats d’une enquête portant sur 452 habitations montrent, qu’un facteur des plus importants, est la température. Les réseaux d’eau chaude opérant à des températures inférieures à 46 °C étant les plus souvent contaminés[31]. Une autre enquête rassemblant 711 analyses microbiologiques présente les mêmes conclusions[33].
Les réseaux faiblement utilisés ou de manière discontinue, comme les hôtels saisonniers par exemple, sont plus sujets à la colonisation par les Légionelles[11]. L’aspect technique des installations est aussi primordial. Certains dispositifs sont, en effet, plus souvent atteints. Les réservoirs d’eau chaude verticaux sont par exemple plus souvent contaminés que ceux horizontaux (79 % contre 29 %) en raison vraisemblablement d’une plus grande disposition à l’accumulation de dépôts. Il en va de même pour les réservoir de plus de 5 ans[38].
La conformité du réseau doit avant toute désinfection être vérifiée. Et plus encore, une réflexion poussée doit être conduite vis-à-vis de l’installation en elle-même. La lutte contre le développement potentiel des Legionella pneumophila est avant tout la mise en place d’une combinaison de mesures structurelles visant à limiter l’apparition d’un biofilm et la croissance de la biomasse[30].
Le dimensionnement des installations par rapport à leur utilisation est une condition primordiale à la garantie d’une hygiène durable[26],[34]. S’ils ne concordent pas, il est nécessaire, en plus des mesures de préventions des Légionelles de reconsidérer les installations en prenant en compte le besoin réel et les aspects économiques[59].
Dès la conception du système de plomberie, il faut prendre en compte la problématique des Légionelles : les canalisations doivent être les plus courtes possibles, des vannes de régulations doivent être installées dans les systèmes complexes pour contrôler les flux. Il ne doit pas y avoir de zones mortes. Des systèmes anti retour doivent être installés sur les zones de chauffage. Il faut prévoir un système de purge[3]. Les temps de stagnation inévitables doivent être gardés les plus courts possibles[26].
Tous les dispositifs entraînant un mélange et l’apparition d’eau tiède, tels que les vannes de mélange eau chaude/eau froide ou les mitigeurs, doivent être placés le plus près possible des robinets ou poire de douche. Les raccords doivent être régulièrement nettoyés. Les systèmes à risque, comme les robinets diffuseurs qui diminuent la consommation d’eau mais augmente la production d’aérosols, ne doivent pas être installés dans des milieux dits « critiques » comme les hôpitaux[3].
Des mesures de correction du fonctionnement des installations sont, en règle générale, rapidement réalisables et souvent à exécuter en parallèle avec d’autres mesures, comme une désinfection ou un nettoyage par exemple. Les mesures correctives les plus couramment mises en place, concernant le fonctionnement du réseau à proprement parler, sont les suivantes[35] :
La suppression des embranchements morts permet d’obtenir immédiatement des effets sur la colonisation des Legionella[43].
La purification de l’eau des Légionelles par Ultra Violet (UV) ou par filtration peuvent convenir si elles sont employées à proximité du point d’utilisation dans le cas contraire, du fait de leur non-dispersivité, elles ne peuvent pas avoir d’impact sur les bio films et les populations bactériennes[3],[46]. L’utilisation seule de la désinfection UV est insuffisante pour contrôler les L. pneumophila en raison de son faible rayon d’action et des interactions avec les composés de l’eau tels que le biofilm, la turbidité, les matières en suspensions ou encore les dépôts[38]. Une étude a cependant montré qu’une concentration de matières en suspension de 4 à 6 mg/l n’avait pas d’influence sur l’effet biocide de l’irradiation aux ultras violets. Une température de 43 °C n’a également pas eu d’incidence sur l’efficacité des émissions ultras violettes[39].
L’utilisation d’UV peut entrainer la formation de nitrites avec des longueurs d’onde inférieures à 240 nm[36].
Les UV ne peuvent pas détruire les Légionelles à l’intérieur des Amibes. Pour pouvoir détruire toutes les Légionelles, il faut coupler le rayonnement ultra-violet à un rayonnement ultrasonore qui permet de détruire les amibes[36].
Lorsqu’une température de plus de 55 °C n’est pas techniquement atteignable ou n’est pas souhaitée, dans le cadre de conditions particulières, le recours au concept d’Aachner, qui consiste au recours à une désinfection UV sur le point de consommation, peut être envisagé[34].
L’utilisation de filtres stériles est réservée au cas particulier des zones sensibles. Le principe repose sur la filtration de tous les composants contenus dans l’eau à l’aide d’un filtre d’une finesse d’au moins 0,45 μm qui retient donc notamment les micro-organismes tels que les Légionelles[36],[60].
Une alternative à la désinfection peut être de supprimer purement et simplement le réseau d’eau chaude et d’utiliser des systèmes de chauffages décentralisés sur les points d’utilisation. Le cas pratique d’un hôpital de São Paulo au Brésil contaminé par les Legionella pneumophila montre que cette méthode a permis de supprimer durablement la colonisation du réseau et les cas de légionellose notamment en utilisant des douches électriques qui chauffent instantanément l’eau[61].
Le nombre d’occurrences des contaminations de Légionelles dans les réseaux laisse penser que leur impact est sous-estimé[réf. nécessaire]. Cela est premièrement dû à la nécessité de recourir à un test propre aux Légionelles pour détecter leur présence dans un réseau. En effet, les Légionelles n’étant pas d'origine fécale, les paramètres traditionnels de surveillance de la qualité microbiologique ne peuvent pas fournir d’indication de contamination[62]. Leurs concentrations sont, de plus, très variables. L’étude d’un réseau expérimental a montré que les concentrations en Légionelles présentaient parfois des « pics » et qu’une fréquence de surveillance faible rendait très probable leur non-détection[30].
À cela s’ajoute que la méthode de détection des Légionelles est relativement longue puisqu’elle nécessite environ 13 jours avant de pouvoir fournir des résultats confirmés. Cela ne permet pas de répondre au besoin de suivi en continu dans les zones à risques et du contrôle avec un pas de temps précis des effets de mesures de désinfection par exemple. De nouveau procédés sont en développement et permettent d’espérer une amélioration des capacités de suivi des contaminations microbiologiques des installations. La société Vermicon AG a, par exemple, développé le système ScanVIT-Legionella qui repose sur l’observation au microscope à fluorescence du développement des colonies bactériennes colorées par des marqueurs fluorescents spécifiques après trois jours de développement sur une Agar GVPC (glycine vancomycim polymixin cyclohexamide)[63].
La détection par PCR pourrait, à l’avenir, être également amenée à jouer un rôle important dans le contrôle des contaminations des réseaux d’eau potable. Une étude en a démontré la faisabilité[Laquelle ?]. Cette méthode présente l’avantage d’être beaucoup plus rapide que les techniques conventionnelles de mise en culture. Les limitations de la méthode sont la présence ponctuelle d’inhibiteurs dans les réseaux[pas clair] et la non-distinction entre les bactéries mortes et vivantes qui pourrait conduire à surestimer le risque d’infection[64]. La présence d’anticorps chez les usagers d’une installation[pas clair] pourrait aussi servir à la détection de contamination par les légionelles même sans cas avérés de légionellose. Cette présence d’anticorps est corrélée à l’exposition aux Legionella pneumophila mais elle est souvent asymptomatique[22].
Dans le cas d’une désinfection au chlore, l’augmentation de la demande en chlore peut être une indication de contamination biologique. Il apparaît que la concentration en bactéries est proportionnelle à leur demande en chlore. Les bactéries résistantes au chlore présentent une demande en chlore plus importante que celles non résistantes. Cela peut donc être utilisé pour estimer le degré de contamination d’un réseau en incluant les Légionelles qui sont particulièrement résistantes au chlore[65].
Enfin, il semble que les colonisations problématiques par les Légionelles ne soient pas limitées aux réseaux d’eau chaude. En effet, dans un nombre croissant de cas, les Légionelles sont détectées en concentrations élevées également dans les réseaux d’eau froide dont la température dépasse les 20 °C et cela en corrélation avec des cas de légionelloses[66]. Le contrôle des réseaux ne doit donc pas se limiter aux seuls réseaux d’eau chaude.
La sous-estimation de l’impact des Légionelles est également évidente au niveau du diagnostic de la maladie[réf. nécessaire].
L’augmentation des cas de légionellose répertoriés ces dernières années a pour origine non pas une augmentation réelle des cas de légionellose mais est très certainement due à l’amélioration des techniques de détection et leur recours plus systématique[5],[67]. En témoigne l’exemple d’une étude dans un hôpital de San Antonio (Texas) visant à trouver l’origine de l’augmentation du nombre de cas de Légionellose, qui en arrive à la conclusion que cette amplification est la conséquence du recours croissant au test antigène urinaire[68].
Pour le diagnostic d’une légionellose, on effectue le plus souvent un test des anticorps présents dans l’urine des patients mais ce test permet uniquement de détecter les Legionella pneumophila appartenant au sérogroupe 1 qui sont responsables de 90 % des infections, restent 10 %[4].
De nombreux cas de Légionelloses ne sont ainsi certainement pas détectés. Notamment dans les centres de soins longs où les malades n’ont que de faibles réflexes respiratoires et un état mental anormal. Un contrôle régulier des installations d’eau et un dépistage plus systématique des Légionelloses devraient être mis en place dans ces lieux critiques[69]. En raison d’un manque de suspicion de la maladie et, par conséquent, l’absence de test, le nombre de cas de légionelloses est sous-estimé. La mise en place, par le veterans healthcare system, d’une politique agressive de contrôle des infections et d’une politique de prévention incluant un volet « éducation » sous forme de conférences a permis d’obtenir une diminution très significative des cas de Légionelloses[70]. D’autres études rapportent que le contrôle régulier des systèmes de distribution d’eau, suivi, dans les cas le nécessitant, de mesures de désinfection, ainsi que l’utilisation généralisée de détection d’antigènes dans les urines, ont permis de diminuer de manière significative le nombre de cas de Légionellose et d’améliorer significativement le diagnostic de la maladie[67],[71].
La tendance actuelle est à l’augmentation du recours aux détections de Légionelles, en particulier dans les zones dites sensibles qui abritent des personnes à risques.
Par exemple, les Centres américains du contrôle et de préventions des maladies (CDC) recommandent le contrôle régulier des eaux utilisées dans des centres de soins critiques tels que les centres de transplantations, de natalité[60]. De même, l'Agence fédérale pour l'environnement en Allemagne distingue trois types d’établissement avec pour chacun une fréquence et surveillance et mesures correspondant au niveau de contamination : les hôpitaux et centres de soins à hauts risques (tous les six mois), les hôpitaux et centres de soins dit « normaux » (tous les ans), et tous les autres établissements (tous les ans ou trois ans lors de contrôles précédents inférieurs à cent unités formant colonie (UFC) dans 100 ml)[62].
Le nouvel arrêté sur l’eau potable de 2003 (en Allemagne) prévoit le contrôle régulier des installations distribuant de l’eau potable publique (écoles, hôpitaux, centres de soins, maisons de retraite) notamment des Légionelles et l’analyse des anomalies du réseau telles que des défauts du réseau, des mauvais raccordements etc.[59] Le développement du concept de plan de sécurité de l’eau (Water Safety Plan)[3] en tant qu’instrument d’auto-contrôle avec la prise en compte des aspects sanitaires et techniques souligne la prise de conscience d’un surveillance accrue[33],[72].
Des recherches sur la mise au point d'un vaccin existent. Des essais sur des cochons d'inde ont montré un niveau de protection modérément élevé[73].
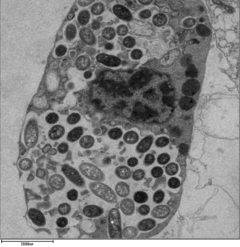
 Legionella pneumophila à Immunofluorescence
Legionella pneumophila à Immunofluorescence Legionella pneumophila est une bactérie intracellulaire facultative parasitant les monocytes humains et certains protistes phagotrophes (ex/ amibes) retrouvés dans les eaux douces.
Legionella pneumophila é unha especie de bacterias gramnegativas, aerobias, pleomórficas, flaxeladas, non formadoras de esporas, do xénero Legionella.[1][2] L. pneumophila é o principal axente causante en humanos da lexionelose ou enfermidade do lexionario.
L. pneumophila é un bacilo ou cocobacilo gramnegativo, non encapsulado cun só flaxelo polar. É aerobio e incapaz de hidrolizar a xelatina ou producir urease. Non é fermentativo. L. pneumophila non ten pigmentación nin autofluorescencia. É oxidase e catalase positiva, e produce beta-lactamase. As colonias de L. pneumophila son cincentas claras cunha aparencia de vidros talaldos con textura. Require cisteína e ferro para crecer. Crece en extracto de lévedo formando colonias "tipo ópalo".
Aínda que L. pneumophila está categorizada como bacteria gramnegativa, tínguese pouco debido ao seu contido sigular de lipopolisacárido da capa externa da membrana externa da súa parede (que é unha bicapa como é típico nas membranas).[3] A base da especificidade dos antíxenos somáticos deste organismo está localizada nas adeas laterais da parede celular. A composición química destas cadeas laterais con respecto aos seus compoñentes e á disposición dos distintos azucres, determina a natureza dos determinantes dos antíxenos somáticos ou do antíxeno O, que son importantes para a clasificación serolóxica de moitas bacterias gramnegativas. Describíronse polo menos 35 serovares de L. pneumophila.
Utilizouse soro para estudos de aglutinación e para a detección directa da bacteria en tecidos utilizando anticorpos etiquetados fluorescentemente. Poden determinarse anticorpos específicos en pacientes polo test de anticorpo fluorescente indirecto. As probas ELISA e de microaglutinación tamén foron aplicadas con éxito.
A lexionela tínguese mal coa tinguidura de Gram, ten tinguidura positiva coa prata, e cultívase en extracto de lévedo carbón vexetal con adición de ferro e cisteína.
L. pneumophila é unha bacteria intracelular facultativa, xa que pode invadir e multiplicarse dentro de amebas no seu medio ambiente, as cales poden así servir de reservorio para L. pneumophila, e proporcionarlle protección ante os estreses ambientais, como a cloración da auga.[4]
Nas rexións endémicas, dun 4% a 5% das pneumonías son causadas por L. pneumophila. As infeccións aumentan no verán. En países como EEUU hai unhas 30 infeccións por L. pneumophila por cada 100.000 residentes e ano.[5]
Nos humanos, L. pneumophila invade e replícase dentro dos macrófagos. A internalización da bacteria nesa célula pode ser potenciada pola presenza de anticorpos e elementos do sistema do complemento, pero isto non é imprescindible. A internalización da bacteria parece ocorrer por medio de fagocitose, pero L. pneumophila pode tamén infectar células non fagocíticas por medio de mecanismos descoñecidos. Describiuse en L. pneumophila unha rara forma de fagocitose coñecida como fagocitose enroscada (coiling phagocytosis), pero esta non depende do sistema de secreción Dot/Icm e foi observada tamén noutros patóxenos.[6] Unha vez no interior da célula, as bacterias quedan rodeadas por un vacúolo membranoso, que non se fusiona cos lisosomas, que doutro modo degradarían a bacteria. Neste compartimento protexido, a bacteria multiplícase.
A bacteira usa un sistema de secreción de tipo IVB coñecido como Dot/Icm para inxectar proteínas efectoras dentro do hóspede. Estes efectores incrementan a capacidade da bacteria de sobrevivir dentro da célula hóspede. L. pneumophila codifica unhas 200 proteínas "efectoras",[7] que son segregadas polo sistema de translocación Dot/Icm para interferir con procesos da célula hóspede e axudar á supervivencia da bacteria. Unha vía fundamental na cal L. pneumophila utiliza estas proteínas efectoras é interferir coa fusión dos "vacúolos que conteñen lexionela" (LCV) cos endosomas do hóspede, e así protexerse da lise.[8] Os estudos de knockout de xenes dos efectores translocados por Dot/Icm indican que son vitais para a supervivencia intracelular da bacteria, aínda que moitas proteínas efectoras se pensa que funcionan redundantemente, porque os knockouts dun só efector raramente impiden a supervivencia intracelular. Este grande número de proteínas efectoras trnaslocadas e a súa redundancia é probablemente resultado de que a bacteria evolucionou en moitos hóspedes protozoos diferentes.[9]
Para que Legionella sobreviva dentro dos macrófagos e protozoos debe crear un compartimento especializado chamado "vacúolo que contén lexionela" (LCV). Por medio da acción do sistema de secreción Dot/Icm, a bacteria pode impedir a súa degradación pola vía endosómica normal e pode así replicarse. Pouco despois da súa internalización, a bacteria recruta especificamente vesículas derivadas do retículo endoplasmático e mitocondrias no LCV á vez que impide o recrutamento de marcadores endosómicos como Rab5 e Rab7. A formación e mantemento dos vacúolos é crucial para a patoxénese, e as bacterias que carecen do sistema de secreción Dot/Icm non son patóxenas e non poden replicarse dentro das células, e a eliminación do efector do Dot/Icm SdhA orixina a desestabilización da membrana vacuolar e non hai replicación bacteriana.[10][11]
Unha vez que está dentro da célula hóspede, Legionella precisa nutrientes para crecer e reproducirse. Dentro dos vacúolos a dispoñibilidade de nutrientes é baixa, e a grande demanda de aminoácidos da bacteria non está cuberta co transporte dos aminoácidos libres que se encontran no citoplasma do hóspede. Para mellorar a dispoñibilidade de aminoácidos, o parasito promove o mecanismo de degradación proteasómica propio do hóspede. Isto xera un exceso de aminoácidos libres no citoplasma das células infectadas por L. pneumophila, que pode utilizarse para a proliferación intravacuolar do microorganismo.
Para obter aminoácidos L. pneumophila utiliza o efector F-Box AnkB, o cal é farnesilado pola actividade de tres encimas do hóspede localizados na membrana dos "vacúolos que conteñen lexionela" (LCV), que son: farnesiltransferase (FTase), encima protease 1 convertedora de Ras (RCE1), e a isoprenil cisteína carboxil metil transferase (IcmT). A farnesilación permite que AnkB se ancore no lado citoplásmico do vacúolo.
Unha vez que AnkB está ancorado na membrana do vacúolo, este interacciona co complexo SCF1 ubiquitina ligase e funciona como unha plataforma para o atraque no vacúolo de proteínas poliubiquitinadas ligadas a K48. A poliubiquitinación ligada a K48 é unha marca para a degradación proteasomal que libera péptidos de 2 a 24 aminoácidos de longo, que son rapidamente degradados a aminoácidos por varias oligopeptidases e aminopeptidases presentes no citoplasma. Os aminoácidos impórtanse ao interior dos "vacúolos que conteñen lexionela" por medio de varios transportadores de aminoácidos como o SLC1A5 (transportador de aminoácidos neutro). Os aminoácidos son a fonte primaria de carbono e enerxía para L. pneumophila, a cal para aproveitalos ten unhas 12 clases de transportadores ABC, aminoácido permeases, e moitas proteases. Os aminoácidos importados utilízaos L. pneumophila para xerar enerxía a través do ciclo do ácido cítrico e como fontes de carbono e nitróxeno.
Porén, a promoción da degradación proteasomal para a obtención de aminoácidos pode non ser a única estratexia de virulencia para obter fontes de carbono e enerxía do hóspede. Os encimas degradativos segregados polo sistema de tipo II poden proporcionar unha estratexia adicional para xerar fontes de carbono e enerxía.
A determinación e publicación da secuencia xenómica completa de tres illados clínicos de L. pneumophila en 2004 serviu para unha mellor comprensión da bioloxía molecular de L. pneumophila en particular e do xénero Legionella en xeral. Nunha análise xenómica comparativa profunda utilizando matrices de ADN para estudar o contido xénico de 180 cepas de Legionella atopouse que había unha grande plasticidade xenómica e unha frecuente transferencia horizontal de xenes. Un maior coñecemento do ciclo de vida de L. pneumophila obtívose ao investigar o perfil de expresión xénica de L. pneumophila en Acanthamoeba, concretamente en A. castellanii, o seu hóspede natural. L. pneumophila mostra un ciclo de vida bifásico e presenta trazos transmisivos ou replicativos segundo os seus perfís de expresión xénica.[2]
A transformación xenética é unha adaptación bacteriana que consiste na transferencia de ADN dunha bacteria a outra a través do medio líquido que as rodea. A transformación é un proceso bacteriano parecido ao sexo.[12] Para que unha bacteria se una a ADN exóxeno, o capte e o recombine co seu cromosoma, esta debe estar nun estado fisiolóxico especial denominado “competencia” (ver competencia natural).
Para determinar que moléculas poden inducir competencia en Legionella pneumophila, probáronse 64 moléculas tóxicas,[13] e só 6 delas, que eran todas axentes que danaban o ADN, causaban unha forte indución da competencia. Tratábase da mitomicina C (que introduce enlaces cruzados entre as fibras do ADN), a norfloxacina, a ofloxacina e o ácido nalidíxico (inhibidores da ADN xirase que causan roturas na dobre hélice), a biciclomicina (causa roturas da dobre hélice) e a hidroxiurea (causa a oxidación de bases do ADN). Estes resultados suxiren que a competencia para a transformación en Legionella pneumophilia evolucionou como resposta aos danos no ADN.[13] Quizais a indución da competencia proporciona unha vantaxe de supervivencia no hóspede natural, como ocorre con outras bacterias patóxenas.[12]
Os macrólidos (azitromicina) ou fluoroquinolonas (moxifloxacina) son o tratamento estándar para as infeccións por Legionella pneumophila en humanos.
Legionella pneumophila é unha especie de bacterias gramnegativas, aerobias, pleomórficas, flaxeladas, non formadoras de esporas, do xénero Legionella. L. pneumophila é o principal axente causante en humanos da lexionelose ou enfermidade do lexionario.
La Legionella pneumophila è un sottile batterio Gram-negativo pleomorfico, flagellato del genere Legionella.[1] La L. pneumophila è il principale agente patogeno di questo gruppo per l'uomo a cui provoca la legionellosi o malattia dei legionari, oppure può provocare una forma più leggera detta febbre di Pontiac.
La L. pneumophila è un batterio non alcool-acido resistente, asporigeno, e non capsulato. Aerobio, non è in grado di idrolizzare la gelatina, produrre ureasi o fermentare sostanze. Il batterio inoltre non è pigmentato o autofluorescente ed è ossidasi e catalasi positivo; produttore di beta lattamasi.
La L. pneumophila è classificata come organismo gram negativo, ma si colora poco perché ha un contenuto unico di lipopolisaccaridi (LPS) nella sua membrana esterna.[2] Sulla catena laterale dell'LPS è posizionato il residuo che dà specificità antigenica a questo organismo. La composizione chimica di queste catene laterali è data dall'unione di diversi residui glicidici che assieme determinano la natura dell'antigene somatico (detto per convenzione: "O"), che è un importante criterio per classificare i batteri gram negativi. Sono riconosciuti almeno 35 differenti sierotipi di L. pneumophila e sono state descritte anche numerose altre specie anch'esse così suddivise.
La sierologia si attua tramite agglutinazione dei batteri nel tessuto e usando anticorpi marcati fluorescenti. Si possono trovare anche gli anticorpi del paziente tramite la sierologia indiretta col metodo ELISA oppure usando i test di microagglutinazione, che sembrano dare buoni risultati.
La L. pneumophila è un parassita intracellulare facoltativo che può invadere le amebe o i macrofagi nell'uomo e usarli per replicarsi. L'internalizzazione dei batteri è favorita dalla presenza di anticorpi e componenti del complemento ma non è obbligatoria. Il ciclo replicativo ha inizio con il legame di una proteina (porina) della membrana esterna ai componenti del complemento con conseguente deposizione del componente C3b sulla superficie batterica; i batteri si legano ai recettori CR3 per il complemento espressi dai fagociti dell'ospite penetrando all'interno della cellula grazie a pseudopodi che avvolgono il batterio e aiutano la fagocitosi. Una volta internalizzato, il microorganismo impedisce la fusione del vacuolo con i lisosomi che altrimenti lo degraderebbero, quindi si moltiplica in questo compartimento protetto. Il batterio usa un sistema di secrezione di tipo IVB conosciuto come Icm/Dot per iniettare proteine effettrici nell'ospite. Questi effettori sono implicati nell'aumentare l'abilità del batterio di sopravvivere nella cellula ospite. Inoltre secerne una metalloproteasi che pesa 39 kDa dentro i fluidi di coltura che è citotossica per alcune linee cellulari coltivabili.
Il patogeno in natura fu isolato la prima volta nel 1976 a un incontro di anziani veterani della Legione Americana che si tenne a Philadelphia in Pennsylvania (da qui il nome legionellosi). L'infezione colpì oltre 200 persone con 34 morti. La trasmissione interumana aerea non è stata dimostrata.[3]
La Legionella pneumophila è un sottile batterio Gram-negativo pleomorfico, flagellato del genere Legionella. La L. pneumophila è il principale agente patogeno di questo gruppo per l'uomo a cui provoca la legionellosi o malattia dei legionari, oppure può provocare una forma più leggera detta febbre di Pontiac.
Legionella pneumophila ir gramnegatīvas aerobas kustīgas baktērijas. Taisnas vai viegli izlocītas nūjiņas ar viciņām; 3 × 0,5—0,7 µm. Izraisa legionelozi jeb "leģionāru slimību". No citām Legionella sugām atšķīrās ar spēju hidrolizēt nātrija hipurātu. Legionella pneumophila izšķir 16 serogrupas. Ir jutīgas pret ultravioletajiem stariem, etilspirtu, fenolu, 3% hloramīna šķīdumu[1].
Legionellas ir izturīgas ārējā vidē, spēj intensīvi vairoties vienšūņos, piemēram, amēbās, turklāt tās var aizsargāt legionellas no dezinficējošo līdzekļu iedarbības. Šo baktēriju lielās pielāgošanās spējas ļauj tām vairoties mākslīgos ūdens rezervuāros, kur tām ir piemērotāki apstākļi nekā dabā.[2].
Legionella pneumophila ir gramnegatīvas aerobas kustīgas baktērijas. Taisnas vai viegli izlocītas nūjiņas ar viciņām; 3 × 0,5—0,7 µm. Izraisa legionelozi jeb "leģionāru slimību". No citām Legionella sugām atšķīrās ar spēju hidrolizēt nātrija hipurātu. Legionella pneumophila izšķir 16 serogrupas. Ir jutīgas pret ultravioletajiem stariem, etilspirtu, fenolu, 3% hloramīna šķīdumu.
Legionellas ir izturīgas ārējā vidē, spēj intensīvi vairoties vienšūņos, piemēram, amēbās, turklāt tās var aizsargāt legionellas no dezinficējošo līdzekļu iedarbības. Šo baktēriju lielās pielāgošanās spējas ļauj tām vairoties mākslīgos ūdens rezervuāros, kur tām ir piemērotāki apstākļi nekā dabā..
Legionella pneumophila is een bacterie die de ziekte legionellose veroorzaakt. De ziekte kan ontstaan wanneer mensen de bacterie inademen, bijvoorbeeld in een douche of via een sproei-installatie.
De griepvariant (ook wel pontiackoorts) is meestal tijdelijk en van doorgaande aard, de veteranenziekte daarentegen is een chronische longaandoening met mogelijk dodelijke afloop. Voorwaarde voor infectie is dat de bacterie door de neus of de mond wordt opgenomen en zich kan vestigen in de longen. De verspreiding gebeurt dan ook door middel van zogenaamde aerosolen, dit zijn kleine waterdruppeltjes die de bacterie kunnen bevatten en ontstaan door turbulente waterbewegingen. Risicogroepen zijn personen met een verminderde weerstand, ouderen en stevige rokers.
Het natuurlijk milieu van Legionella pneumophila is de bodem en het zoetwater, maar meestal in lage aantallen. Bijna alle stammen binnen het genus Legionella zijn polyglot, wat wil zeggen dat ze niet gebonden zijn aan geografische sites maar over heel de wereld verspreid voorkomen. Legionella pneumophila blijkt onder bepaalde gunstige omstandigheden sterk in aantal toe te nemen. Optimale groeiomstandigheden zijn stilstaand water met een temperatuur tussen 25 en 60 °C (optimaal is 37 °C) en de aanwezigheid van biofilm of ander organisch materiaal. Dergelijke omstandigheden blijken veelvuldig voor te komen in door de mens ontworpen warmwatersystemen zoals drinkwaterleidingen, zwembaden, fonteinen, luchtkoelers en hennep-gefitte leidingen. Als het water niet door het hele watersysteem kan stromen, is het mogelijk dat het water langdurig blijft stilstaan in 'dode' hoeken. De bacterie krijgt zo de kans zich te vermeerderen in slijmlaagjes (biofilm) aan de binnenkant van leidingen of in het bezinksel op de bodem van leidingen en reservoirs. Legionellose kan dus voornamelijk gezien worden als een "beschavingsziekte".
Een veel voorkomende preventiemaatregel is hittebehandeling van watersystemen voor desinfectie gevolgd door een spoeling van het distributiesysteem. Hierbij wordt het water verhit tot 60°C of hoger, zodat in principe afdoding van Legionella plaatsvindt. Door de spoeling wordt het afgedood organisch materiaal afgevoerd. In praktijk blijkt het echter zeer moeilijk te zijn om in complexe, industriële watersystemen te komen tot een homogene verhitting van het volledige watersysteem, wegens die zogenaamde 'dode' hoeken, zones waar weinig of geen waterbeweging plaatsvindt. Daarenboven blijkt uit recente wetenschappelijke studies dat Legionella pneumophila in staat is om dood organisch materiaal te benutten voor groei, zodat afdoding zelfs een potentiële stimulatie kan betekenen voor overlevende Legionella. Dit alles maakt de bestrijding van Legionella pneumophila zeer moeilijk.
Ook komt het steeds vaker voor dat de bacterie ook voorkomt in koudwaterleidingen, doordat die bij verkeerde montage door warme schachten worden aangelegd of omdat de warmwaterleidingen er te dicht bij liggen. De temperatuur van het stilstaande water in de koudwaterleidingen wordt hierdoor vaak meer dan 25 °C, waarbij groei van de bacterie reeds kan gaan plaatsvinden.[1]
De rijksoverheid heeft de wet-[2] en regelgeving opgesteld omtrent legionellapreventie.[3]
Voorts staat de zorgplicht legionellapreventie vervat in de 'Drinkwaterwet en -besluit'.[4]
Legionella pneumophila is een zwak kleurende, parasitaire, gramnegatieve, aerobe, niet-spore vormende, ongekapselde staaf, die slechts op speciale selectieve (cysteïne bevattende) media gekweekt kunnen worden. De lange staven komen geregeld voor in ketens, zijn katalasepositief, oxidasepositief, motility positief, lactosenegatief en wanneer de mogelijkheid zich voordoet de bacterie toch op een bloedplaat te kweken geven deze gammahemolyse.
Legionella pneumophila kent een complexe groeicyclus die zich voornamelijk intracellulair afspeelt in protozoa. Bekende protozoale gastheren van Legionella pneumophila zijn Hartmannella Vermiformis en Acanthamoeba castellanii, naast anderen. De bacterie zal zich hierbij laten opnemen door deze protozoa. In een volgend stadium zal ze kunnen verhinderen dat ze wordt verteerd zoals normaal het geval is wanneer bacteriën worden opgenomen door protozoa. Ze zal daarenboven de gastheer gaan gebruiken als omgeving om in te delen, waarna ze na het voleindigen van een aantal delingen naar buiten zal treden in een honderd- tot duizendvoudige concentratie. Een gelijkaardige vermenigvuldigingscyclus gebruikt Legionella om zich te vermenigvuldigen in de longen van zoogdieren na opname. Hierbij worden de alveolaire macrofagen als gastheer gebruikt. Naast deze intracellulaire manier om te vermenigvuldigen heeft Legionella ook de mogelijkheid om te delen door nutriënten uit zijn omgeving op te nemen, afkomstig van dood organisch materiaal.
Binnen Legionella pneumophila onderscheiden we verder een aantal serovars, of types, die niet allemaal even gevaarlijk zijn. Er zijn ten minste 34 serogroepen beschreven; het aantal zal toenemen doordat er doorlopend mutaties optreden.
De eerste gerapporteerde uitbraak dateert van 1976, toen er in Philadelphia zich onder oud-strijders van het American Legion (Amerikaans Legioen) een massale epidemie van longontsteking voordeed. Na onderzoek kon men deze uitbraak relateren aan het voorkomen van bepaalde bacteriën. Deze bacteriën werden Legionella pneumophila genoemd en het genus tot waartoe ze behoren Legionella, naar analogie met de eerste bekende uitbraak.[5] Echter uit later onderzoek is vast komen te staan dat er al uitbraken waren vanaf 1957. Een later vastgestelde uitbraak in 1968 in Pontiac leidde alleen tot griepverschijnselen. Deze milde vorm van legionellose wordt om die reden nog altijd wel Pontiac-koorts genoemd.[6]
De in Nederland bekendste uitbraak was die tijdens de Westfriese Flora (nu Holland Flowers Festival) in Bovenkarspel in 1999. Deze uitbraak staat bekend als de legionellaramp. 206 mensen werden tijdens deze epidemie ernstig ziek, 32 overleden aan de gevolgen van Legionella. Waarschijnlijk waren er echter meer doden, maar deze patiënten waren reeds begraven voordat de ziekte als zodanig herkend was. De besmetting bleek te zijn ontstaan in twee stands van de bijbehorende consumentenbeurs, waar bubbelbaden waren tentoongesteld.
In Murcia, Spanje vond op 22 juli 2001 de grootste uitbraak plaats met 800 betrokken patiënten. Bij 449 van hen werd de bacterie aangetoond, 6 mensen overleden aan de gevolgen. Er werd uitgebreid epidemiologisch onderzoek verricht en de meest waarschijnlijke oorzaak was een aircosysteem in het stadsziekenhuis.
De bacterie kan in alle sanitaire installaties voorkomen. Daarom is een goede installatie met het juiste materiaal belangrijk. Leidingen van koper bieden volgens een studie van KWR Watercycle Research Institute daarbij vanwege de antibacteriële eigenschappen van dit element voordelen boven andere materialen.
Het opkweken van bacteriën in een nieuwe installatie bij het onderzoek was moeilijk, vooral in koperbuizen. De enting van de koperen leidingen moest diverse malen worden herhaald; vijf extra inentingen voor koper tegen één enting voor de andere materialen.
De legionellaconcentraties in het water en in de biofilm waren bij koper tijdens het gehele onderzoek lager dan bij andere materialen, met uitzondering van de onderzoeksfase van 37 °C.
Bij een temperatuur van 25 °C en een huishoudelijk tappatroon konden de legionella’s zich zowel in de biofilm als in de waterfase handhaven bij de materialen roestvast staal (rvs), pvc-c en PEX. Bij koperen buizen was legionellabesmetting aan het eind van de onderzoeksperiode niet meer aantoonbaar.
Bij een temperatuur van 55 °C en een huishoudelijk tappatroon was er geen, of slechts geringe, sterfte van legionella’s in de waterfase bij rvs, pvc-c en PEX. Bij koper echter verdween de bacterie volledig onder deze omstandigheden.
Bij 60 °C was er ook volledige desinfectie bij RVS, pvc-c en PEX.
KWR concludeert uit dit onderzoek dat als men in de NEN 1006 de norm voor woningen aanpast van 55 °C naar 60 °C, het probleem is opgelost, en er volledige desinfectie optreedt bij alle buismaterialen.
Legionella pneumophila is een bacterie die de ziekte legionellose veroorzaakt. De ziekte kan ontstaan wanneer mensen de bacterie inademen, bijvoorbeeld in een douche of via een sproei-installatie.
Legionella pneumophila er ein bakterie av slekta Legionella, som kan forårsaka den dødelege sjukdommen med det same namnet, også kalla legionærsjuke, hjå menneske.
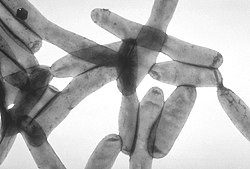
Legionella pneumophila – Gram-ujemna bakteria, pałeczka wywołująca choroby z grupy legioneloz, z których najważniejsze znaczenie mają: choroba legionistów oraz gorączka Pontiac.
Do zakażenia u ludzi dochodzi drogą kropelkową w wyniku inhalacji aerozoli zawierających bakterie Legionella pneumophila. Wnika do makrofagów pęcherzyków płucnych. Powoduje obniżenie odporność komórkową organizmu. Niszczy okoliczne tkanki poprzez wydzielane egzotoksyny.
Bakteria gwałtownie się namnaża w zbiornikach stojącej ciepłej wody (temp. optymalna 35 °C), co ma najczęściej miejsce w: termach, klimatyzatorach czy niektórych typach kąpielisk.
Poza tym w rozpylaczach prysznicowych, kranach, wannach z hydromasażem i fontannach. Legionella pneumophila dobrze znosi wodę chlorowaną.
Środowisko stojącej, zalegającej wody wraz z temp. 35ºC niesłychanie sprzyja rozwojowi bakterii, dlatego zaleca się okresowe nagrzewanie wody w nagrzewnicach wodnych (bojlerach) do temperatury od 60 do 65ºC, w której bakterie giną, po czym wodę należy spuszczać tak długo, aż temperatura zakończenia armatury (końcowego kranu i "słuchawki") osiągnie maksimum.
Legionella pneumophila – Gram-ujemna bakteria, pałeczka wywołująca choroby z grupy legioneloz, z których najważniejsze znaczenie mają: choroba legionistów oraz gorączka Pontiac.
Legionella pneumophila é uma bactéria pleomórfica, flagelada, Gram negativa do género Legionella.
Legionella pneumophila é uma bactéria que ficou conhecida devido a um trágico acidente numa convenção da American Legion [1] em 1976, no Bellevue Stratford Hotel [2], Filadélfia, onde repentinamente 34 participantes faleceram e 221 contraíram uma pneumonia grave. A busca do motivo dessas mortes levou ao conhecimento mais apurado da bactéria, apesar de já ser, na época, uma bactéria conhecida.
Em 2014, ocorreu um surto de Legionella em Portugal que afetou cerca de 375 pessoas, sendo que 12 morreram. Foi confirmado que o surto ocorreu devido a um problema nas torres de refrigeração da empresa Adubos de Portugal. [3]
Legionella pneumophila é uma bactéria ubiquitária e saprófita da água, não fermentadora de lactose, sendo nutricionalmente exigente. É oxidase positiva, catalase positiva e hidrolisa o hipurato. É um patógeno intracelular facultativo, apresenta um sistema de secreção tipo IV. Com este sistema de secreção, a bactéria é capaz de "Invadir" a célula hospedeira, através da transferência de DNA pelo método de conjugação[4].
A infecção pela bactéria ocorre principalmente na inalação de vapor, gotículas de água ou neblina contaminadas com a bactéria, oriundas principalmente de chuveiros domésticos, torres de resfriamento, condensadores evaporativos e bandejas de gotejamento de condensado, sobretudo quando existe algum depósito de água como nos aquecedores por acumulação, fontes decorativas, todo processo que produz aerossol e spray de água.
A Legionella pneumophila multiplica-se no interior dos macrófagos alveolares (dust cells), lesionando as células infectadas por acção de: fosfatases, lipases e nucleases, provocando o recrutamento de novos fagócitos. Há produção de anticorpos e activação subsequente dos macrófagos, que eliminam a bactéria.
•Após a inalação para os pulmões, a L. pneumophila entra nos macrófagos alveolares via coiling, ou por convencional fagocitose, passando a replicar-se no vacúolo especializado.
•Uma proteína da membrana exterior liga-se ao componente do complemento 3 (C3), facilitando o reconhecimento pelos fagócitos, e induzindo poros na membrana do macrófago.
•Outra proteína da membrana exterior (OMP) chamada macrophage invasion potentiator (macrófago potenciador de invasão) (MIP) determina a entrada da célula.
•Quando os nutrientes começam a escassear, a produção de citotoxinas pelas bactérias em stress, levam a ruptura dos macrófagos e o ciclo recomeça
•A secreção de proteases (são enzimas que quebram ligações peptídicas entre os aminoácidos das proteínas) pela L. Pneumophila contribui para o dano dos tecidos.
•A propagação da doença leva o recrutamento de fagócitos oriundos do sangue, mas L. pneumophila é relativamente resistente aos neutrófilos e multiplica-se dentro dos monócitos.
OBS: Em fevereiro de 2016 foi publicado um estudo que existe a possibilidade da Legionella ser transmitida de pessoa para pessoa. Este estudo ainda será mais aprofundado e o mesmo foi feito em Portugal após o caso de 2015.
L. pneumophila pode originar infecções assintomáticas ou sintomáticas.
As infecções sintomáticas podem ser:
Os métodos mais eficientes para o diagnóstico da Legionella pneumophila passam pela Imunofluorescência direta, método menos sensível, ou pela Imunofluorescência indireta, com maior sensibilidade. Métodos menos eficientes incluem:
Como a Legionella não se apresenta como risco razoável em ambientes naturais e também não é facilmente controlada como o são outras bactérias de origem hídrica (tal qual os coliformes), as técnicas tradicionais do saneamento para barrar a contaminação de sistemas de água pela Legionella se mostraram ineficientes. Dessa forma a prevenção da Legionella se dá por meio de um Gerenciamento de Riscos associados a esta bactéria. Pela sua capacidade de persistência nos sistemas de água (não necessariamente sistema de água potável), as estratégias de controle devem ser definidas a partir do sistema como um todo, além das relações entre sistemas, sub-sistemas e sistemas de água no entorno. Isso é feito, normalmente, a partir de uma Avaliação de Risco que aponta primeiramente as vulnerabilidades dos sistemas de água para desenvolvimento da Legionella e posteriormente técnicas e medidas para controlar de modo a que seu risco seja mantido em patamares aceitáveis de segurança. Essa é uma recomendação da Organização Mundial da Saúde[5] e é refletida em diversas legislações, guias e normas técnicas atuais apontam para este sentido, como uma forma de lidar com este risco, tal como no Reino Unido[6], na Espanha[7], nos Estados Unidos[8] e outros. O Brasil possui em desenvolvimento de uma norma técnica neste sentido.
Resumidamente, em caso de detecção de contaminação pela Legionella em sistemas de água, pode-se (mas é necessária uma avaliação técnica), utilizar em grandes quantidades a adição de cloro contínua a longo prazo, ou pela elevação da temperatura da água para temperaturas entre os 60 e os 70 graus Celsius.
O tratamento farmacológico só se aplica à Doença do legionário, já que a Febre de Pontiac ao fim de 1 a 5 dias cura espontaneamente. Como antimicrobiano de primeira linha, deve-se usar eritromicina. Como antimicrobiano de segunda linha, pode-se utilizar a rifampicina, mas nunca em monoterapia.
Legionella pneumophila produz beta-lactamases, sendo resistente aos beta-lactâmicos (nomeadamente a penicilina).
Legionella pneumophila é uma bactéria pleomórfica, flagelada, Gram negativa do género Legionella.
Legionella pneumophila är en av ca 50 legionella-arter.[1] Det är en vattenlevande bakterie som infekterar och reproducerar sig i amöbor.[2] L. pneumophila kan ge upphov till en allvarlig form av lunginflammation som kallas legionärssjukan.[3] Bakterien sprids via vattenånga, och infekterar bakterieätande celler i lungorna.[4]
Legionella pneumophila är en svagt gram-negativ coccobacillus.[4] "Gram-negativ" är en benämning på bakterier som färgas röda av en speciell färgningsmetod som kallas gramfärgning.[5] Bakteriernas cellmembran består av ett lager peptidoglykan. Det är uppbyggt av två sorters molekyler som innehåller socker och proteiner.[6] Utanför peptidoglykanlagret sitter ett ytterlager som innehåller proteiner och giftiga endotoxiner.[5] Endotoxin består av sammansatta fett- och sockergrupper och tål höga temperaturer. När en bakteriecell spricker frigörs de och kan orsaka feber eller vid rikliga mängder en dödlig chock.[7] Coccobacillus betyder att bakterien är i ett stadium mellan coccus och bacillus, den är kort, tjock och har en oval form.[1]
Legionellabakterier finns naturligt i sötvatten i till exempel floder, sjöar och i fuktig jord. De finns även i artificiella miljöer som till exempel i vattenledningar, bubbelpooler och i luftfuktare.[4][8]
För att skaffa skydd och näring brukar bakterien bosätta sig i värdceller (protozoa, ex. amöbor) eller också fäster den sig i biofilmer (ett skikt av mikroorganismer i symbios och de kolhydrater som organismerna bildar[9]) i konstgjorda och naturliga vattenreservoarer.[3] Bakterien klarar höga temperatur- och pH-skillnader och har hittats i fruset vatten och vattenkällor i närheten av vulkaner.[8] Amöbor har en betydande roll i L. pneumophilas förmåga att överleva i dessa extrema miljöer, dels med det fysiska skyddet som amöban utgör, men det har även påvisats att L. pneumophila som fått växa i en amöba har en större motståndskraft jämfört med laboratorieodlade L. pneumophila.[4] Amöborna utgör även ett skydd mot klor som annars används som en effektiv bakteriedödare.[4]
När L. pneumophila har fagocyteras (omslutits av en amöba eller en makrofag) bildas en vesikel (bubbla) av olika beståndsdelar i cellen till exempel mitokondrier, vesiklar eller ribosomer från endoplasmatiska retikulum runt bakterien.[10] Vesikeln skyddar bakterien från lysosomer som vill bryta ner det främmande ämnet. Inuti vesikeln börjar bakterien växa och dela sig om den har tillgång till järn och L-cystein. När näringen i värdcellen har tagit slut antar bakterierna sin virulenta (giftiga) form. De får flageller (svansar) och blir rörliga och giftiga. Värdcellen går i apoptos eller nekros (självdör eller sprängs) och bakterierna släpps ut för att hitta nya värdceller eller biofilmer där de kan få skydd och näring.[4][10]
Legionella pneumophila ansamlas i stillastående vatten.[11] När vattentemperaturen ligger på mellan 20-45° växer och förökar sig bakterien, men då temperaturen understiger 20° avstannar tillväxten.[12] L. pneuomphilas ringa storlek gör att den lätt kan följa med i vattendimma som kallas för aerosol.[4][12] Bakterien sprids till människor genom inandning av kontaminerade aerosoler som finns i luften. Vattendropparna innehåller antingen fria legionellabakterier eller sådana som infekterat amöbor. Aerosoler kan bildas i olika vattensystem exempel i vissa kyltorn, i luftkonditioneringsaggregat och i duschar.[13] Bakterien kan inte sprida sig från människa till människa.[14]
Släktet Legionella upptäcktes efter ett konvent arrangerat av American Legion i Philadelphia år 1976, då många deltagande legionärer blivit svårt sjuka.[2] Krigsveteranerna drabbades av svår lunginflammation och 29 personer dog.[13] Dödligheten var hög eftersom man inte visste orsaken och därför inte hade någon effektiv behandling. Anledningen till att så pass många smittades var hotellets luftkonditionering. Sjukdomen kom efter detta att kallas legionärssjukan på grund av den historiska anknytningen.[15] Cirka sex månader efter utbrottet meddelade två utredare, Joseph McDade och Charles Shepard, från USA:s Centers for Disease Control and Prevention, att de hade hittat orsaken till insjuknandet av legionärerna; en gram-negativ bakterie. Bakterien fick sedan namnet Legionella pneumophila.[16] Det första legionellautbrottet i Sverige var i Västerås år 1979. Sextioåtta personer blev sjuka efter att de hade besökt ett köpcentrum där ett kyltorn på byggnadens tak orsakade utbrottet.[13]
Legionellabakterier kan ge två olika sjukdomar, en influensalik form som kallas pontiacfeber och en lunginflammationsform, legionärssjukan. Legionellosis är ett samlingsnamn för de båda sjukdomarna. Det har påvisats att många människor bär antikroppar mot L. pneumophila utan att veta om att de har drabbats, vilket kan tyda på att många fall av legionellosis aldrig uppdagas.[3] Ålder, rökning och nedsatt immunförsvar är faktorer som ökar risken för att drabbas av allvarlig sjukdom. Män drabbas i högre grad än kvinnor.[2]
Pontiacfebern är en mild form av influensa som inte utvecklar lunginflammation. Den är i regel ofarlig och läker av sig själv efter 2-5 dagar. Vid exponering av L. pneumophila löper man 95 % risk att insjukna.[3][8] Legionärssjukan är en mer allvarlig form av legionellosis som ger inflammation i lungorna. Ca 7-24% av de som insjuknar avlider.[3] De vanligaste symptomen är hosta och andningssvårigheter, allmän sjukdomskänsla, feber, muskelvärk samt problem med mag-tarmkanalen såsom diarré, illamående och i vissa fall kräkningar.[11] På grund av de diffusa symptomen misstas ofta legionärssjukan för vanlig lunginflammation vilket kan leda till felaktig behandling.[8] För att kunna ställa diagnosen används antigentest av urin, blodprov samt bakterieodling av luftvägsslem.[8][17] Legionärssjukan behandlas traditionellt med antibiotika, vanligtvis flourokinoloner (ex. ciprofloxacin) eller makrolider (ex erytromycin). Beta-laktam antibiotika (ex. penicillin), är inte verksamma mot legionärssjukan, men då de är effektiva mot vanlig lunginflammation händer det att patienter som inte testats för legionärssjukan felaktigt får penicillin. Detta kan försena diagnostiseringen av legionärssjukan vilket kan leda till ökad dödlighet.[8] Sen eller utebliven behandling kan leda till nedsatt funktion i olika organ, såsom lungorna och njurarna. I värsta fall påverkas flera organ samtidigt och patienten avlider.[8] Vid tidig behandling bli man oftast fullt återställd, men vissa bieffekter kan ses – både kort- och långvariga. Exempel på kortvariga bieffekter är svaghet, nedsatt kondition och försämrat minne, vilka kan sitta i flera månader. I allvarliga fall av legionärssjukan kan värre bieffekter uppstå som minnesförlust och kvarvarande nervdysfunktion.[8][17]
Som tidigare nämnts sprids inte L. pneumophila mellan personer, och därför koncentreras det förebyggande arbetet på att minska antalet bakterier i vattenkällorna.[3] En viktig del av det förebyggande arbetet utgörs därför av rätt konstruktion av vattenledningar som förhindrar stillastående vatten samt att hålla varmvattentemperaturen över 60 grader, och därigenom motverka bakterietillväxt.[11] Det förebyggande arbetet försvåras av L. pneumophilas förmåga att infektera amöbor därför anser vissa forskare att fokus borde ligga på att förhindra detta intrång.[18] Legionärssjukan är en anmälningspliktig och smittskyddsspårningspliktig sjukdom, vilket innebär att den ska anmälas till landstingets smittskyddsläkare och Smittskyddsinstitutet, dessutom ska tänkbara smittspridningsvägar överses. Då individen smittats i Sverige ska miljökontoret kontaktas.[11]
Årligen påvisas ca 100-150 fall av legionärssjukan i Sverige, ungefär hälften av individerna smittats utomlands. År 2011 registrerades 127 fall i Sverige.[19]
Legionella pneumophila är en av ca 50 legionella-arter. Det är en vattenlevande bakterie som infekterar och reproducerar sig i amöbor. L. pneumophila kan ge upphov till en allvarlig form av lunginflammation som kallas legionärssjukan. Bakterien sprids via vattenånga, och infekterar bakterieätande celler i lungorna.
Legionella pneumophila — рухомі (мають один джгутик) прямі або злегка викривлені паличкоподібні бактерії розміром 3 х 0,5-0,7 мікрон. Грам-негативні, спор і капсул не утворюють. На препаратах розташовуються поодиноко або у невеликих скупченнях.
Ця бактерія — аеробна, зазвичай її вирощують на курячих ембріонах, культурах клітин людини[1] і збагачених селективних поживних середовищах (казеїново-вугільний агар КВА, казєїново-дріжджовий агар, агар BCYE-α). Необхідними для росту компонентами є цистеїн і залізо. Не росте на простих поживних середовищах. Оптимальна температура для росту — 35-37 °C, на селективних поживних середовищах розвивається поволі. Колонії округлі, опуклі з легкою опалесценцією. Утворює β-лактамазу, каталазу, зумовлює гідроліз гіппурата.
L. pneumophila мешкає в теплих прісних водоймищах та є факультативним внутріклітинним паразитом деяких найпростіших[2][3]. У інфузорій роду Tetrahymena при захопленні клітин L. pneumophila не відбувається перетравлення цих клітин, живі L. pneumophila виділяються у навколишнє середовище у вигляді пакетів[4]. У клітинах найпростішого Hartmanella vermiformes лізосома з клітинами L. pneumophila оточується шорстким ендоплазматичним ретикулюмом[5]. При розмноженні поза межами клітини хазяїна, важливу роль в житті L. pneumophila має як планктонна стадія, так і формування біоплівок[6][7]. Бактерія пристосувалася існувати в штучних системах водопостачання, в особливості тих, що підігріваються[8][9], наприклад в системах кондиціонування повітря. L. pneumophila виживає в подібних біотопах багато в чому завдяки здібності до утворення біоплівок[10], а також здатності виживати після термообробки і споживати залишки інших мікроорганізмів, убитих нагріванням[11]. Бактерія також є факультативним внутріклітинним паразитом людини, спричинює легіонельоз.
Геном L. pneumophila представлений кільцевою дволанцюжковою молекулою ДНК. Відомо принаймні три штами з істотними відмінностями в геномі: у L. pneumophila штаму Paris геном складається з 3635495 пар основ і містить 3224 гени[12], у L. pneumophila штаму Lens геном довжиною 3405519 пар основ і містить 3004 генів,[13], а у штаму Philadelphia 1 геном довжиною 3397754 пар основ і містить загалом 2942 генів. Таким чином, геном L. pneumophila відносно пластичний, що може змінювати можливості цього організму до внутріклітинного паразитичного існування[14].
L. pneumophila патогенна для людини, у багатьох випадках при зараженні вона спричинює легіонельоз — сапронозну бактеріальну інфекцію людини. Механізм передачи — повітряний. Джерела зараження, як при усіх сапронозах, немає. Потрапляння збудника йде з абіотичних (неживих) об'єктів — побутових водонагрівальні прилади, систем кондиціонування повітря, тоді як заражена людина не є контагіозною[15][16]. L. pneumophila розмножується всередині макрофагів, уникаючи лізису фагоцитів[17]. Також ця бактерія інгібує супероксиддісмутази моноцитів[18], фаголізосоми людини, наповнені L. pneumophila, зливаються з шЕР[19], крім того, зменшується антиген-презентуюча активність заражених клітин[20]. Крім того, L. pneumophila індукує апоптоз і активацію каспаз[21], та індукує синтез інтерлейкіну-8 епітеліоцитами легенів людини[22]. Фактором патогенності також є здібність до синтезу цитотоксичних глюкозилтрансфераз Lgt[23]. До легіонельозу схильні особи із зниженим імунітетом, є спостереження про зв'язок схильності до легіонельозу із зниженою функцією активації комплемента[24].
Legionella pneumophila
Brenner et al. 1979
Legionella pneumophila (лат.) — грамотрицательная, подвижная палочковидная бактерия рода легионелл, возбудитель легионеллёза («болезнь легионеров»), название получила из-за вспышки заболевания в 1976 году среди делегатов съезда Американского легиона в гостинице, расположенной в Филадельфии. Возбудитель отнесён к III группе патогенности (до 2013 г. относился ко II группе патогенности, т.е. к группе возбудителей особо опасных инфекционных болезней).
Подвижные (имеется жгутик, расположенный монотрихиально) прямые или слегка искривлённые палочковидные бактерии размером 3 х 0,5—0,7 мкм. Грамотрицательные, спор и капсул не образуют. На препаратах располагаются одиночно и небольшими скоплениями.
Факультативный анаэроб, растёт на куриных эмбрионах, культурах клеток человека[1] и обогащённых питательных средах (казеиново-угольный агар КУА, казеиново-дрожжевой агар, агар BCYE-α). Необходимыми факторами роста являются цистеин и железо. Не растёт на простых питательных средах. Оптимальная температура роста 35—37 °С, на искусственных питательных средах развивается медленно. Колонии округлые, выпуклые с лёгкой опалесценцией. Производит ферменты β-лактамазы, каталазу, вызывает гидролиз гиппурата.
L. pneumophila обитает в тёплых пресных водоёмах и является внутриклеточным паразитом некоторых простейших[2][3]. У инфузорий рода Tetrahymena при захвате клеток L. pneumophila не происходит переваривание клеток, живые L. pneumophila выделяются в окружающую среду в виде пакетов[4]. В клетках простейшего Hartmanella vermiformes фагосома с клетками L. pneumophila окружается шероховатым эндоплазматическим ретикулумом[5]. Внутриклеточное размножение L. pneumophila в клетках простейших играет определённую роль в формировании биоплёнок[6][7]. Бактерия приспособилась существовать в системах водоснабжения, в особенности подогреваемых[8][9] (например системах кондиционирования воздуха). L. pneumophila выживает в подобных биотопах благодаря способности к образованию биоплёнок[10], а также способности выживать после термообработки и потреблять остатки других микроорганизмов, убитых нагреванием[11]. Бактерия также является внутриклеточным облигантным паразитом человека, вызывая легионеллёз.
Геном L. pneumophila представлен кольцевой двуцепочечной молекулой ДНК. Известно по крайней мере три штамма с различиями в геноме: у L. pneumophila штамма Paris нуклеоид состоит из 3635495 п.н. и содержит 3224 генов[12], у L. pneumophila штамма Lens нуклеоид длиной 3405519 п.н. и содержит 3004 открытых рамок считывания[13] и у штамма Philadelphia 1 нуклеоид длиной 3397754 п.н. и содержит в общем 2942 генов. Таким образом, геном L. pneumophila достаточно пластичен, и происходят эволюционные изменения L. pneumophila как возбудителя легионеллёза и внутриклеточного паразита простейших[14].
L. pneumophila патогенна для человека, вызывает легионеллёз — сапронозную бактериальную инфекцию человека. Механизм передачи- аспирационный. Источником заражения являются бытовые водонагревательные приборы, системы кондиционирования воздуха, заражённый человек контагиозностью не обладает[15][16]. L. pneumophila размножается внутри макрофагов и дендритных клетках, избегая лизиса при фагоцитозе[17]. Фагосомы этих клеток, наполненные L. pneumophila, сливаются с шероховатым ЭПР и не сливаются с лизосомами, в результате чего бактерия избегает разрушения[18]. Также патоген влияет на антигенпрезентирующую функцию этих клеток[19]. У моноцитов L. pneumophila ингибирует супероксиддисмутазы[20]. У клеток альвеолярного эпителия лёгких L. pneumophila индуцирует активацию каспаз и, как следствие, апоптоз, приводя к гибели клеток, что и вызывает симптомы воспаления лёгких[21]. Возбудитель также индуцирует синтез Интерлейкина-8 эпителиоцитами лёгкого человека[22]. Фактором патогенности также является способность к синтезу цитотоксических глюкозилтрансфераз Lgt[23]. К легионеллёзу предрасположены лица с пониженным иммунным статусом, есть наблюдения о связи предрасположенности к легионеллёзу с пониженной функцией активации комплемента[24].
Legionella pneumophila (лат.) — грамотрицательная, подвижная палочковидная бактерия рода легионелл, возбудитель легионеллёза («болезнь легионеров»), название получила из-за вспышки заболевания в 1976 году среди делегатов съезда Американского легиона в гостинице, расположенной в Филадельфии. Возбудитель отнесён к III группе патогенности (до 2013 г. относился ко II группе патогенности, т.е. к группе возбудителей особо опасных инфекционных болезней).
嗜肺军团菌是一种有鞭毛,革兰氏阴性,军团菌属多形态性的短小球杆菌。[1][2]嗜肺军团菌是一种原发的人类病原体,会引发军团病。
嗜肺军团菌不抗酸,无孢子,无荚膜,类似于杆菌。不能分解明胶、糖类或是尿素,同时,不可参加酵解反应。嗜肺军团菌无色,也非自身荧光。氧化酶与过氧化氢酶测试阳性。β-内酰胺酶阳性。
专性需氧,在自然界可长期存活,如在蒸馏水中可存活100天以上,污水中可存活一年,对热和一般消毒剂敏感。菌落特征为灰白色,有光泽,湿润,圆形,凸起,并有特殊臭味。革兰氏染色不明显,多用镀银法或Giemsa法染色。[3]
虽然是革兰氏阴性的有机体,可是它巨大的感染力是来自于它独特的细胞外膜小叶上包含有脂多糖抗原。[4]在细胞壁侧链上携带有这些特异性菌体抗原的基部。这些与组成糖的化学组成和排列结构有关的侧链,其成分决定了菌体抗原或O-抗原的性质,这在血清学上鉴定多种革兰氏阴型菌有很大作用。现已发现35种血清型,其中不少可再分为数种亚型。
血清不仅用于血液凝集的研究,还可用于直接观察荧光标记过的组织抗体HIHI。患者体内的特殊抗体可以被荧光抗体间接检测。这项测试也已成功应用于酶联免疫吸附法与微量凝集试验。
嗜肺军团菌是一种细胞兼性寄生的细菌,可入侵变形虫,或是人类的巨噬细胞内。该菌的感染力在抗体和血清补体存在下大大提高(但并非绝对需要两者存在)。该菌会因噬菌作用被伪足包裹进入巨噬细胞,之后,菌体被细胞产生的自噬体包裹起来,这却阻止了溶酶体的溶解。在这层保护之下,细菌大量繁殖。该菌利用一种型为IVB的分泌系统分泌的名为Icm/Dot(细胞器运行缺失/细胞内繁殖)宿主入侵效应蛋白。这些效应器可以提升细菌在宿主细胞的存活力。该菌会在培养液里由II型分泌系统产生一种大小约为39kDa的金属蛋白,这种蛋白对某些组织培养的细胞有毒害。II型分泌系统也是完全毒化作用的必需。[1]
1976年,美国宾夕法尼亚州的费城举办了一次退伍军人会议,参加者中超过200人发生肺炎,其中34人遇难。经查明,这次事件的元凶是一种当时尚未发现的细菌——嗜肺军团菌(该病也因此命名为军团病)。这次事件反映了嗜肺军团菌并非小面积的人与人的传染。[5]
2004年,三种类型的嗜肺军团菌的基因序列已被成功测定,这为从分子生物学层次了解嗜肺军团菌及军团菌属铺平道路。对180种嗜肺军团属的DNA序列改变的基因比对检测证实了其基因具有高塑性以及频繁的突变频率。更详细的有关其生活周期的资料是来自于对生活在其自然宿主——卡氏棘阿米巴之中的嗜肺军团菌的基因表达分布的研究。研究发现了嗜肺军团菌的生活周期分为两段,而且深入研究了其可感染、可复制的特性。[2]