pt-BR
nomes no trilho de navegação


Botanical description: This description covers characteristics that may be relevant to fire ecology and is not meant for identification. Keys for identification are available (e.g., [14,74]).
Aboveground description: Giant hogweed is a very large, monocarpic perennial forb that can reach 20 feet (5 m) tall [14,74]. While some references suggest that plants can flower at 2 years old [13,36], field research indicates that the earliest flowering age is 3 years [3,47]. The oldest plant observed in flower on an extremely dry site in the Czech Republic was 12 years old [45]. The majority of research indicates that giant hogweed dies after flowering, although one researcher reportedly observed a postflowering sprout in southern Ontario [33]. Giant hogweed × eltrot hybrids flower for mutliple years [63]. Potential nonmonocarpic behavior is discussed in Vegetative regeneration. For more on flowering, see Seed production.
Giant hogweed produces a single, hollow stem that may be 6 inches (15 cm) wide at the base [36,42,70]. Stems are distinguished from other cowparsnip (Heracleum) species by their purple blotches [14,40] and blisters or bumps with erect hairs [40]. Giant hogweed leaves are alternate, 3-part compound, and enormous. Lower leaves measure up to 10 feet (3 m) long and 5.6 feet (1.7 m) wide. Leaf size decreases up the stem [11,13,14]. At the flowering stage, plants typically have 4 to 6 stem leaves and 3 to 4 basal leaves [70]. Flowers are arranged in compound umbels that may reach 2.5 feet (0.8 m) in diameter [13,40]. Flowers open first on the terminal umbel. Flowers in the outer umbellets open first, and opening progresses inward [63]. Terminal umbels produce perfect flowers, while most flowers on lateral or secondary umbels are male [42,47,63]. Although lower umbels produce mostly male flowers, a review reports that researchers in West Bohemia observed female flower production on late-developing umbels on short basal shoots [47]. Giant hogweed fruits are dry schizocarps measuring 6 to 18 mm long and 4 to 10 mm wide [42].
Belowground description: Typically giant hogweed produces a thick, branched taproot and tightly clustered, fibrous roots [7,45]. Roots extend 18 to 24 inches (45-60 cm) deep. Lateral roots are often finer than vertical roots. Root thickness and branching increase with plant age, resulting in a "multi-taproot system" [70]. The root crown can grow to 6 inches (15 cm) in diameter and becomes lignified when giant hogweed reaches flowering age. Root crowns are often found up to 5 inches (12 cm) below ground ([70], Perrier 2001 as cited in [13]). Root crowns have contraction rings capable of shrinking the area between the crown and the shoot and protecting the hypocotyl from extreme temperatures [41].
Research in Ireland showed that giant hogweed's root system may be modified on shallow soils. In shallow soils, plants lacked a tap root and developed a laterally spreading root system. For information on the effects of shallow soil on plant growth and seed production, see Seed production.
Important note: The sap produced by giant hogweed is toxic and causes photodermatitis. When skin is exposed to sap and the sun, severe skin rashes, blisters, and possibly permanent scarring or staining can occur [48,74]. Giant hogweed sap in the eyes can cause temporary or possibly permanent blindness [35]. Sap is considered most toxic when the plant is in flower [7]. If skin contacts giant hogweed, exposed areas should be sheltered from sunlight and washed with cold water. A physician should be consulted [40]. Burns or blisters often appear within 24 to 48 hours of plant contact [36]. Photo © USDA APHIS PPQ Archive, USDA APHIS PPQ, Bugwood.org
Giant hogweed is a nonnative species currently (2009) restricted to the western and eastern parts of North America. In western North America, giant hogweed occurs in British Columbia, Washington, and Oregon. In eastern North America, giant hogweed occurs from Newfoundland and Nova Scotia west to Ontario and Wisconsin and south to Indiana, Maryland, and New Jersey ([35,36,42], NAPIS as cited in [13]). Giant hogweed is native to the western Caucasus Mountains of Georgia, Azerbaijan, and southern Russia [42].
In 2003, researchers reported that the range of giant hogweed was expanding in Washington, Oregon, and the northeastern United States [11]. In 1992, giant hogweed occurred in 9 Washington counties [60]. As of 2008, giant hogweed populations in Oregon were limited to areas surrounding Portland and Salem [40]. Giant hogweed is widespread in southwestern Ontario, and localized populations occur in southern Quebec, New Brunswick, Cape Breton, and eastern Newfoundland [42]. In New York, giant hogweed occurs in western and central portions of the state [14]. As of 1996, about 40 small giant hogweed populations occurred around Ithaca (Cope, personal communication, as cited in [76]). Scattered giant hogweed populations occur throughout Massachusetts [26]. Plants Database provides a distributional map of giant hogweed. As of this writing (2009), however, the map did not include Wisconsin, Indiana, Ohio, Maryland, New Jersey, Massachusetts, Vermont, New Hampshire, Nova Scotia, or Newfoundland as states or provinces with giant hogweed populations, although several sources [13,35,36,42] indicate that it occurs in these areas.
Introduction to North America: Giant hogweed was likely introduced to North America as a garden "curiosity" because of its extremely large size and impressive flower [42,74] but could have been introduced through spice importation, since its seeds are used in Middle Eastern cuisine [35]. Giant hogweed occurred in North America as early as 1917 [13].
Giant hogweed source populations in western North America were likely planted by horticulturalists [40,48]. On southeastern Vancouver Island, giant hogweed was first collected in 1964 [42], but reports of giant hogweed in southwestern British Columbia were published in the 1930s (Federation of British Columbia Naturalists Newsletter 1978, as cited in [8]). Giant hogweed has been present in Seattle, Washington, since the early 1950s (Hitchcock, personal communication, as cited in [33]). Using details about current giant hogweed habitats in western Washington and northwestern Oregon, researchers predicted that disturbed riparian habitats in the Cascade, Sierran Steppe, and Rocky Mountain ecoregions are susceptible to giant hogweed invasion [43].
In eastern Canada and the United States, giant hogweed was likely introduced as a horticultural plant [23,42]. Giant hogweed was introduced to New York state in about 1917 [23], and reports suggest that it occurred in southern Ontario by the late 1940s or early 1950s [33,74]. As of 1975, giant hogweed populations along Ontario's Saugeen River were described as "firmly established" and "very much at home" [32]. Giant hogweed was first collected from Nova Scotia in 1980 and from Quebec in 1990 [42]. It was first reported in Michigan in 1991, and the nearest known source population was in Ontario [5]. Giant hogweed was first reported in New Brunswick in 2000 [42], in Vermont in 2002, in Maryland in 2003, and in Indiana in 2004 (NAPIS, as cited in [13]).
Local distribution changes: Several studies indicate that giant hogweed is expanding its range in western and eastern North America [11]. Giant hogweed established and spread in a relatively short period of time on Vancouver Island, British Columbia. Within 40 years of its introduction, it spread along a 7.5-mile (12 km) stretch of French Creek. In some areas, populations occur 260 to 330 feet (80-100 m) from the creek's edge [9]. Over 4 years of observations in Seattle, Washington, giant hogweed populations increased in size and number each year [75]. As of 1990, the spread of giant hogweed in New York has been described as "slow but steady" (Hahn, personal communication, as cited in [75]).
In-depth studies of giant hogweed's spread have been conducted in several nonnative European habitats. In the United Kingdom, giant hogweed was planted in the Kew Botanical Garden in 1817 and was first reported as an escaped ornamental in 1828. In the Czech Republic, giant hogweed established in a noncultivated area 15 years after its introduction in 1862 [19,50,54]. Giant hogweed experienced a lag phase that lasted over 80 years in the Czech Republic. By 1943, though, spread was exponential. Major waterways were important to the early spread of giant hogweed. Although 90% of spread was from riparian source populations, spread was more rapid in nonriparian than riparian habitats (P<0.01) [49,56]. Throughout the West Bohemia area of the Czech Republic, researchers estimated giant hogweed spread rates from aerial photos taken between 1947 (before giant hogweed establishment) to 2000. The average aerial spread rate was 1,261 m²/year and ranged from 139 m² to 3,275 m²/year. The average linear spread rate was 10.8 m/year and ranged from 3.8 m to 26.7 m/year. Because linear and aerial spread rates were not highly correlated, researchers suggested that long-distance dispersal events were important to the spread of giant hogweed [34].
Giant hogweed seeds require cold, moist stratification [30], and early spring germination is most common in giant hogweed's nonnative range [3,36,42,44]. High germination percentages are reported from laboratory studies [29,42]. A review reports that germination can occur in the dark, and that giant hogweed germinates well on recent deposits along river banks, in organic matter in woodlands, and in open areas with "adequate" light and moisture [70].
In laboratory tests, giant hogweed germination percentages were as high as 91% [29]. Fifty to eighty percent of seeds collected from overwintering stems in Ontario and Quebec germinated at room temperature in the laboratory (Darbyshire, unpublished data, cited in [42]). For 1,680 seeds collected in the western Czech Republic, germination averaged 91.1% in the laboratory. Germination percentages were not related to seed size or position on the plant (terminal, lateral, or satellite umbels). The largest seeds were produced in terminal umbels and germinated faster than small seeds, but final germination percentages were not different between large and small seeds [29].
In British Columbia, giant hogweed seeds germinate in late winter or early spring (Wall, personal observation, as cited in [42]). In New York, seed germination begins in early spring but may continue throughout the growing season [36]. On 2 sites in Ireland, giant hogweed first emerged in February. Emergence peaked in late April and decreased thereafter [3]. In West Bohemia, the majority of germination occurred after snowmelt, generally in April. No new giant hogweed seedlings emerged after May, and there was no germination in the fall (Pergl and others, unpublished information, as cited in [44]). Fall germination has been observed by researchers in Poland, Ireland, and Scotland [44].
Seeds from cut umbels may still germinate [52]. This is important when considering potential control methods and site clean-up. For more on this topic, see the Spread, Impacts, and Control section.
Stratification: Giant hogweed seeds exhibit morphophysiological dormancy. Embryos of ripe seeds are not fully developed, and dormancy is broken by cold, wet conditions [30]. Almost no seedlings emerged from soils collected in October in northeastern Zealand, Denmark. Emergence was much greater from soils collected in March, suggesting cold temperature exposure increased germination [1]. In the Czech Republic, 99.7% of seeds shed in the fall were dormant, but by spring, only 12% of seeds were dormant [22]. Fresh giant hogweed seeds collected from the Sheffield region of England did not germinate in the laboratory. After 2 months of cold, moist stratification, 40% of seeds germinated. Germination percentages between stratified and fresh seed were significantly different (P<0.001) [16]. A review reports that giant hogweed seeds failed to germinate when dried before exposure to cold temperatures [70].
Temperature: After giant hogweed seeds collected in the Czech Republic were stratified, germination percentages were greatest (93%) at alternating temperatures of 41 and 68 °F (5 and 20°C). At a constant temperature of 43 °F (6 °C), germination was 88%. Germination was poorest at a constant temperature of 72 °F (22 °C). Seeds at low constant temperatures germinated slowly over a long period of time. Stratification was typically successful after 2 months or more at temperatures below 50 ° F (10 °C), and dormancy returned with increasing temperature. Researchers predicted that giant hogweed may produce a fraction of seeds that require multiple seasons to break dormancy [30,31].
Descriptions of giant hogweed habitats in North America are less detailed than those of its nonnative European habitats. Characteristics of invaded European habitats may provide information about the susceptibility of habitats in North America, where giant hogweed is still expanding its range.
Giant hogweed is often described along roadways and waterways in North America, which have been important in the early spread of giant hogweed in Europe (see Spread, Impacts, and Control). Along French Creek on Vancouver Island, giant hogweed initially established on alluvial stream bank soils but more recently, giant hogweed has spread into adjacent woodlands (Wall, personal observation, as cited in [42]). This same pattern was noted in northern Vancouver (Page, personal observation, as cited in [42]). In Washington and Oregon, giant hogweed occurs in riparian areas, disturbed sites, and along roads [11]. In the eastern Midwest, giant hogweed habitats include roadsides, stream banks, railway embankments, and abandoned fields [7]. Giant hogweed occurs in the sandy gravel along roadsides and ditches in eastern Ontario and western Quebec (Darbyshire, personal observation, as cited in [42]). Open woodlands, canals, streams, roadsides, and vacant lots support giant hogweed populations in New England and New York [28,36].
In Europe, giant hogweed is common in unplowed pastures, meadows, riparian areas, and forest clearings in high-humidity areas with nitrogen-rich, basic soils [61], although many soil types are tolerated. During a survey of giant hogweed-invaded habitats in northwestern England, none of the habitat charactersitics measured (altitude, slope, distance from water, bank top width, and water quality) consistently predicted giant hogweed's occurrence. Researchers proposed that either habitat characteristics were too broad or giant hogweed's tolerances too general for good prediction and concluded that "almost all United Kingdom banksides (we)re susceptible to invasion" [10]. Using logistic regression modeling, researchers found that human population density (P<0.0001), low winter temperatures (P=0.002), and moraine clay (P=0.001) significantly predicted the distribution of giant hogweed on a national scale in Denmark. At the regional scale within Denmark, predictive variables were human population density (P<0.0001), alluvial sand cover (P=0.001), and spring precipitation (P=0.01) [37]. In West Bohemia, researchers comparing invaded and uninvaded sites found that giant hogweed did not occur in vegetation types with acidic soils, including peat bogs, birch (Betula spp.) woodlands, and spruce (Picea spp.) forests. Habitat susceptibility increased with increased light availability (P=0.0117), increased soil reaction indicators (P=0.0004), increased dispersal potential (P<0.001), and increased disturbance (P<0.001) [57].
Climate: The climates in giant hogweed's native and nonnative ranges are similar. In the Western Greater Caucasus region, giant hogweed occupies habitats from 160 to 7,200 feet (50-2,200 m) [68]. In this area, January temperatures can range from -33 to 61 °F (-36 to 16 °C) and July temperatures from 27 to 95 °F (-3 to 35 °C). Based on 30 years of data, annual precipitation averaged 34 inches (863 mm) [45]. Several reviews have summarized the prevailing climates in giant hogweed's nonnative range. Plants generally grow best in northern temperate climates [70]. Cold winters are common in giant hogweed-invaded habitats and are likely necessary for successful germination and establishment (Tiley and others 1996, as cited in [13]). Giant hogweed seedlings are frost resistant (Godefroid 1998, as cited in [42]). While moist sites are preferred, moderate summer droughts are also tolerated [70]. In Canada, giant hogweed is considered "most invasive" in cool, moist climates, and populations occur as far north as Kapuskasing, Ontario. Giant hogweed is also found on seashores and tolerates salt spray [42].
During population and growth studies conducted in Germany, giant hogweed suffered high mortality during a hot dry summer, but reproduction and recruitment from drought survivors was high [18]. In the Czech Republic, giant hogweed's distribution was significantly related to January isotherms (P=0.003). Giant hogweed was less common in areas with warm winters. Average June isotherms, annual precipitation, and elevation did not significantly affect giant hogweed's distribution [51]. Distribution was also affected by human population density; for more about this see Spread, Impacts, and Control. When germination, establishment, and growth of giant hogweed were evaluated along elevation gradients in the United Kingdom and the Czech Republic, researchers found that limitations to dispersal explained giant hogweed's distribution better than climate. At all sites tested from 30 to 2,000 feet (10-600 m), more than 80% of giant hogweed seed germinated. Second-year survival of giant hogweed was lowest at the highest-elevation, coldest-climate site but was still almost 30% [77].
Soils: In most reviews, giant hogweed is described on deep, moist soils with nearly neutral pH and moderate to high nutrient content. Soil textures in giant hogweed habitats may be gravels, sands, loams, or clays. Moist soils are preferred, and waterlogged and winter-flooded soils are tolerated but extended periods of inundation are not [13,28,42,70]. Giant hogweed seeds rot quickly on sites inundated for long periods [70]. The pH reported from giant hogweed habitats ranged from 4 to 8.5 [68].
In southern Ontario, giant hogweed is often found on deep, rich, moist soils [33]. In Germany, giant hogweed was most common on loamy soils. Giant hogweed-invaded sites had an average pH of 5.6, experienced rapid nutrient cycling, were well aerated, and received a "good supply" of water [65]. In Edinburgh, Scotland, giant hogweed populations occurred on soils with pH levels ranging from 5 to 9 and organic matter contents ranging from 3.1% to 8.7% [6].
Giant hogweed's importance to wildlife was not noted in its native range, but deer damage was noted on Vancouver Island [42]. Most studies report that cattle, sheep, goats, and pigs eat giant hogweed [70]. Horses do not eat "substantial amounts" of giant hogweed, but sheep and goats "seek out" giant hogweed and prefer it to rough grasses and sedges. Sheep preferentially feed on young foliage but also eat older leaves, stems, and flowers [2]. Farmers near Parksville, British Columbia, indicated that cattle, goats, and/or hogs have reduced giant hogweed's dominance in pastures [42]. For more on the use of livestock to control giant hogweed, see the section on Biological control.
Palatability and/or nutritional value: Information on the digestibility and nutritional quality of giant hogweed is provided in a review by Buttenschon and Nielsen [2]. Giant hogweed plants in Germany had low nitrogen and high phosphorus levels; for more details, see the paper by Otte and Franke [41].
In its native western Caucasus range, giant hogweed occurs primarily
in meadows, clearings, or forest edges (Mandenova 1950, as cited in [22]).
Giant hogweed is common in "alluvial softwood forests" in
foothills and valley bottoms, forest clearings and abandoned grasslands
in the montane zone, and tall herbaceous vegetation in the subalpine zone
of the Western Greater Caucasus region [68].
In its nonnative North American range, giant hogweed is most
common in riparian areas, open woodlands, and abandoned pasture
or agricultural lands [11,28,36,40]. On Vancouver Island, initial
giant hogweed establishment occurred on alluvial stream banks
but soon populations spread into adjacent woodlands (personal observations
by Wall and Page, cited in [42]). Past land use, disturbances, shading,
and other site characteristics are likely more important than habitat
type in determining a site's susceptibility to invasion. For more on
these topics, see the Successional Status
and Site Characteristics sections.
Very few studies reported on the seasonal development of giant hogweed in North America, but seasonal development is described for several nonnative European habitats, which may relate to similar North American climates. In Canada, first-year growth of giant hogweed is considered "slow", but in subsequent years growth begins earlier. In areas with mild winters, such as British Columbia, growth may begin as early as late December. Plants are thought to flower when they have reached a threshold root size. These plants generally have the greatest leaf development in the spring [42]. Flowering dates in Oregon are mid-May to July [40] and in New England are June to July [28].
In Ireland, giant hogweed growth and development were monitored on 7 sites. Maximum stem and leaf growth occurred from mid-May to mid-June, peak flowering occurred in late June, and most seeds had ripened and dispersed by late August [3]. Similar development was reported in a review from the United Kingdom. Overwintering plants began to grow in December. Basal leaves spread up to 20 inches (50 cm) by March, rosettes were 3 to 7 feet (1-2 m) tall by May, flower production peaked in early July, and plants senesced in September or October [70]. In the West Bohemia area of the Czech Republic, giant hogweed had flowers for an average of 36 days and a maximum of 60 days. Flowering began in mid- to late June and was highly synchronous. Within a week, some plants at all 10 monitored sites were flowering [46]. Roots of flowering plants died in mid-summer and by late summer were almost entirely decayed [45].
Giant hogweed flowers are self compatible and pollinated by insects [13]. In an experimental garden in Pruhonice, Czech Republic, fruit production, which ranged from 87.7% to 92.0%, was not significantly different between open-pollinated, manually outcrossed, and manually self-pollinated flowers. Nearly 4% of flowers protected from pollinators set fruit (Perglova, unpublished data, cited in [47]). During controlled studies on giant hogweed plants collected in southeastern Scotland, just 1% of flowers that were self-pollinated within the primary umbel set seed. In the primary umbel, protandry restricted the success of self fertilization. Self-pollination between flowers in the primary umbel and flowers in lower order umbels produced 68% seed set. An average of 64% of cross-pollinated flowers produced seed [63]. Field and garden studies conducted in West Bohemia revealed that male and female flowering phases overlapped for 99% of plants, suggesting that natural self fertilization is likely [46].
Although a review reports that giant hogweed's small, closely arranged, nectar-bearing flowers could be pollinated by any insect visitor [47], the most frequent insects on plants on southern Scotland's River Teriot were Coleopterans, Dipterans, Hemipterans, and Hymenopterans. Forty-eight insect species were caught on giant hogweed flowers [15]. In abandoned grasslands in southern Sealand, Denmark, giant hogweed received nearly 9 insect visits/umbel in 10 minutes of observations. Honeybees (Apis mellifera) were the most common visitors [38].
Spread: In Canada, giant hogweed populations generally establish along roadsides, forest edges, and streams, but populations have spread into adjacent open woodlands, grasslands, and meadows. Researchers suggest that managers monitor these corridors during control operations [42]. Similar corridors were important to the early spread of giant hogweed in Europe. Given that giant hogweed established over a decade earlier in Europe than in North America, recognizing similarities between spread patterns and vulnerable habitats in Europe and North America may improve management and control of this species.
In Edinburgh, Britain, researchers found that giant hogweed spread along rivers, railways, and roadsides. On riverbanks, giant hogweed was mixed with the riparian community. On drier and disturbed sites, giant hogweed often dominated. Researchers suspected that seeds were often dispersed downstream from gardens and established once they settled on the streambank. Dispersal away from the river was likely the result of human activity along transportation routes. Mud trapped in the boots of railway workers and the collection and transport of umbels were considered important to dispersal [6]. In Germany, giant hogweed was most frequent on riverbanks, ditches, roadsides, or paths [67]. Based on regression analyses, the occurrence of giant hogweed decreased with increasing distance from rivers (P=0.0004), increasing distance from agricultural roads (P<0.0001), and increased presence of woody vegetation (P=0.0019) [69]. Giant hogweed was most common in early-seral vegetation. This topic is discussed in Successional Status.
Linear landscape features such as roads, paths, and streams were important to the initial spread of giant hogweed in West Bohemia [34]. With time, giant hogweed became less restricted to the cool climates at high elevations. In 1970, 28.5% of giant hogweed populations were restricted to elevations above 2,000 feet (600 m). In 1990, just 14.7% of populations occurred at elevations above 2,000 feet (600 m) (Pysek 1994, as cited in [54]). When giant hogweed habitats were surveyed, 83.4% of invaded areas were treeless pastures, meadows, or fields. Forests presented a barrier to invasion and "only very rarely" did giant hogweed occur in forest interiors [34]. In the Czech Republic, giant hogweed's distribution was significantly affected by the density of the human population (P=0.01). Giant hogweed was less common in areas with fewer than 60 people/km² [51].
Impacts: In the United States, giant hogweed is a noxious weed. Contact with plant sap can burn, blister, and scar exposed skin. Large plants can restrict the use of and access to rivers, trails, and paths [40,66], and studies indicate that giant hogweed can negatively impact soil dynamics, fisheries, and other species in its nonnative habitats. In one study, however, the presence of giant hogweed had a positive influence on the pollination of an associated species. For additional information on the health effects of toxic giant hogweed sap, see the Important note in the Botanical and Ecological Characteristics section.
Soil dynamics: In Belgium and the Czech Republic, researchers found that soil nutrient content was different on giant hogweed-invaded and uninvaded sites. In central Belgium, carbon mineralization and concentrations of carbon and nitrogen were lower on invaded than uninvaded sites. Researchers suggested that giant hogweed litter may decompose more slowly than that of native species and could decrease organic matter turnover [21]. Conversely, during studies conducted in West Bohemia, researchers indicated that the high production and easy decomposition of giant hogweed biomass increased nutrient concentrations on invaded sites [57]. Direct measurements of giant hogweed decomposition rates would be a good first step to address the apparent contradiction of these studies.
Stream bank dynamics/fisheries: In the western United States, a review notes that dense giant hogweed canopies could shade and eventually replace native riparian species [11,40]. Decreased understory vegetation could increase the potential for stream bank erosion [11]. Studies in Ireland and Scotland have shown that giant hogweed skeletons leave stream banks exposed to erosion during rain or flooding events. When giant hogweed replaces the persistent stream bank graminoids and other perennials, silt deposits can increase to a degree that makes gravel substrates unsuitable for salmon spawning [3,66,71].
Other species: In nonnative European habitats, studies have reported both reduced and increased species richness on sites with giant hogweed. Studies on giant hogweed's effects on native North American habitats are lacking. A review from southern Scotland reported greater species diversity in grasslands with giant hogweed than in uninvaded grasslands. In woodland habitats, species diversity and cover were lower on invaded than uninvaded sites. Researchers suggested shading by giant hogweed may have provided improved establishment conditions for some grassland species [70]. In Germany, researchers found a negative relationship between giant hogweed cover and the number of vascular species (P<0.001, R²=0.07); however, the relationship varied by community type. Species richness was reduced most, by 4.8 species, when giant hogweed occurred in tall herbaceous communities. Researchers noted that these effects were local and that regional native species populations were not endangered [66]. In West Bohemia, giant hogweed-invaded vegetation had 40.5% fewer species than uninvaded vegetation [57].
Pollination/pollinators: In southern Sealand, Denmark, researchers conducted a field study to determine whether or not giant hogweed negatively affected the pollination of a co-occurring species. They found that seep monkeyflower (Mimulus guttatus) received more insect visits when plants were located next to giant hogweed than when plants were located at any distance 30 to 660 feet (10-200 m) away from giant hogweed (P≤0.01). More insect visits, though, did not increase seed production by seep monkeyflowers, which are capable of self pollination. Researchers suggested that giant hogweed may be important to pollinators in species-poor grasslands [38]. Pollinators attracted to giant hogweed are noted in the Pollination and breeding system section.
Control: Integrated control methods and vigilant monitoring may prove most useful in the management of giant hogweed populations. Public education, coordinated efforts, and prioritized treatments are also important to successful control. Studies on the control of giant hogweed in its nonnative European and North American habitats are presented below.
Reviews provide important general information for giant hogweed management. Public education is important to giant hogweed management, not only to minimize health hazards but also to limit transplanting and seed dispersal [42]. Mapping giant hogweed populations before implementing a control program can improve the coordination of management efforts and posttreatment monitoring. Researchers suggest that searches for giant hogweed seedlings should be conducted at all treatment sites for at least 5 years after all plants have been removed [39]. The Forestry Commission in western Europe suggests that recently established giant hogweed populations should receive management priority, and when giant hogweed occurs along a waterway, populations at the uppermost stream should be controlled first [78].
Because giant hogweed reproduces only by seed, produces a short-lived seed bank, and dies after flowering, preventing seed production and depleting the seed bank seem like viable control strategies [42,63]. However, giant hogweed roots remain alive for "many" years if plants are kept from flowering [60]. Some suggest that preventing seed spread and seed production can be more labor intensive and expensive than "aggressive" control efforts [39]. In areas where giant hogweed ×eltrot hybrids are possible, eliminating seed production is an even less viable control strategy, as hybrids often do not die after flowering [63]. The following references provide information about a variety of potentially useful giant hogweed control techniques and methods: [12,13,27].
Fire: For information on the potential use of fire in giant hogweed control efforts, see Fire Management Considerations.
Prevention: In North America, early detection of new giant hogweed populations and prevention of seed dispersal are management priorities. Hotlines exist in Oregon, New York, and New Jersey for reporting suspected giant hogweed sightings [35,36,40]. Giant hogweed seed is often intercepted by Animal and Plant Health Inspection Service personnel (Westbrooks and Preacher 1986, as cited in [76]). At Sea-Tac airport, giant hogweed is one of the most frequently intercepted noxious weed seeds. Seed is typically found in the personal baggage of passengers, often those from Iran, who use the seeds in cooking [62]. As of 2006, Canadians did not classify giant hogweed as a federal noxious weed or prevent its entry into Canada. In parts of British Columbian and Ontario, though, giant hogweed is classified as noxious [42]. As of 2005, giant hogweed was still available for sale in Canadian nurseries (Darbyshire, personal communication, as cited in [42]).
Because the probability of giant hogweed establishment is low in undisturbed grasslands and other undisturbed vegetation types, land managers in Europe attempt to restrict giant hogweed establishment and spread by minimizing disturbances in established vegetation [44].
Physical or mechanical control: Repeated mowing or cutting can reduce or eliminate giant hogweed seed production ([3], Nielsen and others 2005 as cited in [39]). Cultivation could be an effective control method on some sites [78], and hand pulling may be effective for small patches of seedlings [42].
Cutting: Belowground root cutting is the only mechanical control method that reliably killed giant hogweed plants in Scotland [71]. Aboveground stem damage rarely caused mortality but often reduced plant size and/or seed production [3]. In western Europe, plants cut 4 times a year for 2 years were not killed (Rubow 1990, as cited in [39]), but some indicate that frequent cutting may encourage the growth of grazing-tolerant vegetation and provide some competition for resources in giant hogweed stands [39]. It is important to note that stems cut during the flowering stage may still produce viable seed [52]. Some do not recommend mowing, cutting, or weed whacking giant hogweed stands, since exposure to the sap is likely, and regrowth from the taproot is rapid [36].
In western Scotland, giant hogweed plants cut at 2 inches (5 cm) below ground failed to flower, and plants cut at 6-inch (15 cm) depths were killed. Plants cut at ground level produced umbels that averaged 9.8 g (dry weight); uncut plants produced umbels that averaged 227.5 g. Plants cut farther above ground produced significantly fewer flowers and seeds than uncut plants (P<0.001) but more than plants cut below ground [71]. While root cutting may provide some control, the process is labor intensive and if done in a dense stand, will require checks for missed plants [39]. Giant hogweed plants that were cut at ground level in Ireland were not killed but were shorter and produced fewer seeds than uncut plants. Late-May cutting reduced plant heights and seed production more than early March cutting. Uncut giant hogweed plants averaged 96 inches (244 cm) tall and produced an average of 34,113 seeds/plant. Giant hogweed plants cut in late May averaged 50 inches (127 cm) tall and produced 4,281 seeds/plant [3]. Even plants cut in July flowered and produced seed [4].
Timing of cutting treatments can affect potential seed production and future control efforts. Some recommend that managers cut giant hogweed plants in the mid-flowering stage, which reduces seed production but also allows large plants to potentially shade out seedlings. Reduced seedling number should decrease control efforts necessary in the following year (Nielsen and others 2005, as cited in [39]). In the Czech Republic, the majority of plants survived leaf, flower, and leaf and flower removal treatments that occurred in early June (bud stage), mid-June (start of flowering), and early July (start of fruit development). Seeds produced by untreated plants were heavier than those of most treated plants, but lighter seeds germinated as well as or better than the heavier seeds of uncut plants. When umbels were removed in early June, 90% of plants regrew and produced an average of 3,310 fruits/plant. When umbels were removed in mid-June and in early July, 95% and 80% produced an average of 461 and 446 fruits/plant, respectively. Umbels cut from 85% of the plants produced viable seed while detached from the plant. Although germination of seeds from cut umbels was significantly lower than that from intact umbels (P=0.039), researchers calculated that an average of 442 viable seeds/cut umbel were left on treated sites. A maximum of 20%, 30%, and 50% of seeds from umbels cut in early June, mid-June, and early July germinated, respectively. Findings from this study suggest that seeds produced in cut areas may disperse farther, affecting metapopulation dynamics. Disposal of flowering stems on treated sites is important. Burning of cut stems may be the best method of disposal [52,55]. For more on this, see Fire Management Considerations.
Biological control: Control of giant hogweed by insects or pathogens may be unlikely, but several studies suggest that livestock grazing may be useful to manage giant hogweed. Insects and pathogens potentially useful in the biological control of giant hogweed are being investigated [42], but the existence of closely related native cow parsnip species makes their release unlikely [61].
Farmers near Parksville, British Columbia, noted reduced giant hogweed abundance in pastures used by cattle, goats, and/or hogs [42]. Sheep essentially eliminated giant hogweed from a meadow in northeastern Zealand, Denmark. During the grazing study, there were 5 sheep/ha from 1987 to 1989 and 10 sheep/ha from 1990 to 1993. Cover of giant hogweed was as high as 19% in May of 1989 but was 0% in May of 1993. Because a few giant hogweed seedlings emerged on grazed sites with a depleted seed bank, researchers suggested that if a nearby seed source exists, monitoring and grazing treatments should continue after the removal of giant hogweed [1]. After 4 to 5 months of livestock grazing along a stream in Denmark, the density of giant hogweed seedlings (P=0.1) and large flowering plants (P<0.05) was lower, but the density of small vegetative plants was higher on grazed than ungrazed sites (P<0.001) (Sorensen 2002, as cited in [2]).
Guidlines for the use of livestock to control giant hogweed are reported in a review by Buttenschon and Nielsen [2]. Giant hogweed may be controlled best when livestock feed on early growth and are used to deplete nutrients stored in the taproot through either continuous or recurrent grazing. In dense giant hogweed stands, heavy grazing 3 to 4 times/year may be most effective. In less-dense stands, summer grazing is recommended. Animals experienced with giant hogweed grazing can be used to teach inexperienced individuals to feed on giant hogweed and to avoid overeating, which can cause poisoning and/or digestive problems. Dark-skinned and/or densely haired livestock breeds are least susceptible to dermatitis [2].
Chemical control: Several references provide information on the use of chemicals to control giant hogweed: [4,39,78]. The Forestry Commission of western Europe suggests that herbicides are most effective when giant hogweed is growing but before plants become large, which is in April or May [78]. Herbicide treatments applied when plants are large will not likely penetrate the canopy and reach smaller plants [39].
Integrated management: In New York, small giant hogweed populations were successfully managed with repeated digging and herbicide treatments [23]. Researchers suggest that the reestablishment of grasses is important to successful control on treated sites [39].
The majority of giant hogweed seeds germinate within a year of their production; however, a small portion may persist in the soil at least 3 years and perhaps as long as 7 years. A review reports that at least one giant hogweed seed was viable after 15 years of indoor storage, but that in the field seeds did not germinate after 7 years in the soil [13]. After 7 years of sheep grazing in a meadow in Zealand, Denmark, giant hogweed was eliminated from the grazed area and no seedlings emerged from soil samples collected from the grazed sites. Prior to their elimination, plants on grazed sites did not set seed, suggesting that the giant hogweed seed bank may be depleted in less than 7 years [1].
Giant hogweed seeds collected in western Czech Republic and stored in dry conditions for up to 3 years germinated at a significantly lower percentage than fresh seed (P<0.001). For all temperatures tested, 30% to 93% of fresh seed germinated. After a year of storage, 2% to 41% of seeds germinated, and after 3 years of storage, 0% to 9% germinated. In a field experiment, an average of 8.8% of buried giant hogweed seed germinated after a year in the soil, 2.7% germinated after 2 years in the soil, and 1.2% germinated after 3 years in the soil. Researchers noted that, given giant hogweed's prolific seed production, even a low percentage of seed survival would allow for some establishment [31]. After 1 year of burial, most nongerminating seeds had fully developed embryos, although some had only partially developed embryos [30].
Generally, giant hogweed seeds are abundant in the soil near flowering plants. The majority of seeds occur in the top 2 inches (5 cm) of soil. When soil samples were collected from up to 6-inch (15 cm) depths in the Czech Republic, 95% of giant hogweed seeds were recovered from the top 2 inches (5 cm) [22]. A review reports that in a large giant hogweed stand in Germany there were as many as 2,664 giant hogweed seeds per m² [70]. In the Czech Republic, the seed bank was nearly depleted with spring germination. Viable seed density averaged 3,759 seeds/m² in the fall, 2,044 seeds/m² in the spring, and 192 seeds/m² in the summer. Researchers estimated there were 386 million nondormant seeds at the time of spring germination in the largest giant hogweed population, which occupied 1,066,900 feet² (99,121 m²) [22].
While the majority of wind-dispersed giant hogweed seeds fall near the parent plant, long-distance dispersal is often facilitated by water, animals, and people. In western Scotland, 60% to 90% of giant hogweed seeds fell within 13 feet (4 m) of the parent plant (unpublished data, as cited in [69]). During field studies in Ireland, Caffrey [3] found that 95% of seeds fell within 33 feet (10 m) of parent plants, but a few seeds occurred up to 160 feet (50 m) from parent plants. Caffrey suspected that seed found 160 feet (50 m) from seed-producing plants was transported by people. Field observations in Germany showed that 75% of giant hogweed seeds fell within 47 inches (120 cm) of the parent plant. The maximum seed dispersal distance was 33 feet (10 m) [41].
Wind: In a wind tunnel, giant hogweed seeds dispersed a maximum distance of 31 inches (80 cm) when released from a height of 2.3 feet (0.7 m) in wind speeds of 18 feet (5.5 m)/second [6]. Based on observations made in northwestern England, researchers suspected that wind dispersed giant hogweed seed 16 feet (5 m) from the parent plant [10]. When researchers removed leaves from giant hogweed plants in the Czech Republic, plants produced seeds that were lighter than untreated plants. Assuming lighter seeds could be dispersed further by wind than heavier seeds, cutting in giant hogweed stands may affect potential dispersal and metapopulation dynamics [52]. For more on this study, see Physical or mechanical control in the Management Considerations section of this review.
Water: Giant hogweed seeds may float in water for up to 2 days, and transport in waterways and flood water is common. Clegg and Grace [6] found that giant hogweed seeds floated 1.5 to 2 days in moving water and 3 days in stagnant water before sinking. They calculated that seeds could be transported more than 6.2 miles (10 km) in a river with a surface velocity of 0.3 feet (0.1 m)/second. Moravcova (unpublished results, cited in [30]) reported that 6-month-old giant hogweed seeds sank within 8 hours in water. Importance of water to the transport of giant hogweed seed is also discussed in Spread, Impacts, and Control.
Localized winter flooding may also disperse giant hogweed seeds. Giant hogweed was eliminated from a meadow in northeastern Zealand, Denmark, after 7 years of sheep grazing. No giant hogweed seedlings emerged from soil samples collected from grazed sites, but a few seedlings emerged on grazed sites in the field. Researchers thought seed was dispersed from adjacent ungrazed sites by sporadic flooding during the previous wet winter [1]. A review reports that winter floods can detach entire giant hogweed skeletons, transporting entire umbels [70].
Animals: Animals may disperse giant hogweed seed. Although giant hogweed seeds were not taken by birds in Edinburgh, Scotland [6], researchers suggested that giant hogweed populations in Michigan may have resulted from bird dispersal, because dispersal from the nearest source population in Ontario by water was unlikely [5]. Cattle may have dispersed giant hogweed seed, based on observations of invaded sites in northwestern England. Whether seed was transported in hide, hooves, or dung was not discussed [10].
Humans: Through the collection of flowers, movement of soil, intentional plantings, and importation of seed, humans have been important in giant hogweed seed dispersal. In British Columbia, a landowner observed a couple load their truck with dried giant hogweed stalks and umbels and drive away [9]. In north Vancouver, British Columbia, soil movement was important to the introduction of giant hogweed seed (Page, personal observation, as cited in [42]). In New York, giant hogweed has been dispersed by intentional plantings and the collection of dried fruits [36]. During a survey of giant hogweed-invaded sites in northwestern England, researchers suspected seed was transported by equipment or vehicles [10]. A review reports that giant hogweed is a preferred honeybee food and that beekeepers in Europe aided in the dispersal of giant hogweed [13].
Giant hogweed seed is often intercepted by Animal and Plant Health Inspection Service personnel. Seeds are often brought to North America by Middle Eastern tourists, who use the seeds as a spice (Westbrooks and Preacher 1986, as cited in [76]). At Sea-Tac airport, giant hogweed is one of the most frequently intercepted noxious weed seeds. Seed is typically found in the personal baggage of passengers, especially those from Iran [62]. Importance of human activities in the dispersal of giant hogweed is also discussed in the Spread, Impacts, and Control section.
Giant hogweed is a prolific seed producer, but reports of a single plant producing 100,000 seeds [3] are greatly exaggerated [13,47]. In western Caucasus and the Czech Republic, giant hogweed seed production ranged from 10,000 to 46,470 seeds/plant [45,46]. On the River Ayr in western Scotland, the maximum number of flowers on a single large giant hogweed plant was 81,500, and the maximum number of seeds produced by a single large plant was 52,800 [71]. It is likely that reports of 100,000 seeds produced per giant hogweed plant were calculated by doubling the number of flowers produced. Although each female flower is capable of producing 2 seeds, plants also produce a large number of male flowers. Counting all flowers as potential seeds vastly overestimates seed production [47]. Although plants do not produce 100,000 seeds/plant, giant hogweed does have an "enormous reproductive capacity" [46].
Plant age: Giant hogweed plants typically do not flower until 3 years of age. Of 302 flowering giant hogweed plants in western Caucasus and in the Czech Republic, all were at least 3 years old before producing seed. On an extremely dry site in the Czech Republic, flowering was delayed and the majority of plants flowered at 5 to 8 years of age. A single plant reached 12 years old before flowering. Flowering age differed between native and nonnative habitats and with past land use. For more information, see Successional Status.
Site conditions/plant growth: Several studies indicate that as giant hogweed height increases so does seed production. Because plant growth is often dictated by site conditions, relationships between site conditions and seed production should be expected. In Switzerland, giant hogweed plants in lowland habitats were taller and produced about twice as many flowers as those in montane or subalpine habitats (Jakob and others 1998, as cited in [41]). On field sites in Ireland, plant height and seed production were positively correlated (P<0.05). On sites where soil depths were 6 inches (15 cm) or less, giant hogweed averaged 59 inches (149 cm) tall, and seed production averaged 13,884 seeds/plant. On sites with "no soil depth restriction", plants averaged 110 inches (278 cm) tall, and seed production averaged 42,068 seeds/plant. Differences in seed production between the shallowest soil and deepest soil sites were significant (P<0.001). In this area, the researcher reported that a single plant produced 107,984 seeds [3]. Other researchers [13,47] suspect that seed production was estimated by doubling flower production, which would overestimate seed production. On the River Ayr, giant hogweed plants growing in light shade (38.9% of ambient) averaged 11 feet (3.4 m) tall and produced 208 g of seeds that individually weighed 2.25 g. In deep shade (12.6% of a mbient), plants averaged 9.5 feet (2.9 m) tall and produced 101 g of seeds that individually weighed an average of 1.18 g [71]. It is important to note that heavier seeds typically germinate faster than lighter seeds, but final germination percentages of light and heavy seeds are not significantly different (see Germination).
In West Bohemia, giant hogweed flower production was related to plant diameter and flowering date. Earlier flowering dates and increased basal diameters were correlated with increased flower production (P≤0.001). Researchers suggested that pollinators and climate were also important to flower production. Population characteristics and chemical composition of the soil did not significantly affect fecundity [46].
Research and observations suggest that giant hogweed establishment is more likely on open or disturbed sites than on sites with established vegetation, especially grasses. Generally, seedling survival is low and may be even lower on shaded or flooded sites. Pergl and others [44] report in a review that the probability of giant hogweed establishment is very low in undisturbed grasslands and other vegetation types, but that in already invaded sites, the dying parent provides an open site for establishment. In Ireland, giant hogweed establishment is typically greatest on previously disturbed sites [4]. In mid-summer in a dense grassland in the Czech Republic, there were 56 giant hogweed seedlings on a 1-m² plot next to an adult plant that flowered and died in the previous season (Pergl and Perglova, unpublished work, as cited in [44]). In the Czech Republic, the density of giant hogweed seedlings was not related to adult plant density or seed bank density (Pergl, unpublished work, as cited in [44]).
Survival: The percentage of giant hogweed seedlings surviving an entire year is often low. Reports on seedling survival in North America were lacking as of this writing (2009). During field monitoring of 2 Ireland sites, 1.2% to 13.7% of giant hogweed seedlings survived until August of the emergence year [3]. In Germany, survival of giant hogweed seedlings was less than 1% (Huls 2005, as cited in [44]), and from March to June in Scotland, the survival of giant hogweed seedlings and immature plants was about 2.5% (Caffrey 2001, cited in [44]). In the Czech Republic, less than 1% of giant hogweed seedlings survived 1 year. The probability of giant hogweed seedling survival to the next year increased with increasing leaf number and length of the longest leaf (Pergl, unpublished work, as cited in [44]).
Flooded or shaded conditions may decrease the survival of giant hogweed seedlings. Seedlings along a river in Germany did not survive summer flooding [65]. In Scotland, 400 giant hogweed seedlings/m² occurred soon after seed bank germination, but density dropped to 33 seedlings/m² beneath the shading of giant hogweed adults present by mid-summer [70].
Growth rate: Reports about the growth rate of giant hogweed seedlings are conflicting [4,11,70]. Without more information, it is difficult to know if these reports conflict because of regional differences or because of different reference points. In a laboratory study, giant hogweed seedlings grew 0.155 to 0.186 g/g/day. Seedlings grown from seed collected in the terminal umbel grew most rapidly. The relative growth rate of giant hogweed seedlings ranked 34th highest among 117 herbaceous species occurring in the United Kingdom. Giant hogweed seedlings grew at rates similar to those of grasses [44].
Most studies and observations indicate that giant hogweed establishes best in recently disturbed sites dominated by early-seral vegetation. After establishment, populations may spread into more successionally advanced vegetation types. In giant hogweed-invaded sites, full sunlight is common, although giant hogweed also occurs in shaded habitats. Although common on disturbed sites, giant hogweed abundance typically decreases with tilling and repeated mowing. Giant hogweed may grow best on sites that were disturbed prior to its establishment but remain undisturbed after its establishment.
In Germany, the highest density of giant hogweed occurred in areas dominated by early-seral vegetation. Generally, the cover of giant hogweed decreased with increasing successional age of the site. Of the plots invaded by giant hogweed, 71% occurred in abandoned fields, pastures, grasslands, or "other derelict land". Giant hogweed densities were low in managed areas that were grazed or mowed regularly. Densities were much greater on sites where grazing or mowing had been discontinued or occurred irregularly. "Recent" mechanical disturbances occurred on 27% of invaded plots, and periodic flooding occurred on 34% of invaded plots. The number of flowering giant hogweed plants on 25-m² plots was 5 in woodlands, 26 in managed grasslands, and 37 in ruderal grasslands. Researchers noted that fruit production was "strongly reduced" on managed grasslands [65,68].
Giant hogweed population density was higher on grazed pastures than in undisturbed habitats in the Czech Republic, but plants took longer to flower in pastures than on undisturbed sites (P<0.001). In pastures, vegetative plants likely made up a large portion of the population. In giant hogweed's native Caucasus habitats, population density and flowering age were not different between pastures and undisturbed areas. Pastures in the Czech Republic were grazed 3 times/year by sheep, and in Caucasus, grazing was less extensive. The proportion of flowering plants in the youngest age class in unmanaged Czech and Caucasus sites was 89% and 31%, respectively. Differences in the flowering age between unmanaged Czech and Caucasus sites were likely related to elevation differences. Higher elevation sites in the Caucasus region likely experienced a shorter growing period [45].
Population density and flowering age of giant hogweed in native and nonnative pasture and unmanaged habitats [45] Habitat Population density (individuals/m²) Average flowering age (years) Maximum flowering age (years) Native, unmanaged 4.38 4 7 Native, pasture 4.99 5 7 Nonnative, unmanaged 4.58 3 4 Nonnative, pasture 11.17 5 7Shading: In its nonnative North American range, giant hogweed is described in full-sun, part-shade, and full-shade conditions [26,28,33]. While a wide range of shade tolerance is also reported in giant hogweed's nonnative European habitats [4,65], most studies indicate that giant hogweed is more common in full sun or partial shade. In central European beech (Fagus sylvatica) forests in Switzerland and Denmark, giant hogweed "occasionally invades" gaps created by tree fall, but with canopy closure, giant hogweed abundance decreases until it is eventually eliminated (Ravn, unpublished observations, cited in [59]). In Germany, 46% of giant hogweed-invaded sites were classified as full light, 32% as light, 15% as semi-shade, and 7% as shade. Researchers described plant growth as "fair" in partial shade. Giant hogweed did not occur beneath deeply shaded closed-canopy woodlands but did occur beneath sparse canopies, in canopy gaps, and at woodland edges. Shrubs rarely occurred in giant hogweed-invaded sites. Maximum shrub cover in giant hogweed stands was 10% [65].
The scientific name of giant hogweed is Heracleum mantegazzianum
Sommier & Levier (Apiaceae) [20].
Hybrids: In several European countries, low
frequencies of giant hogweed × eltrot (H. sphondylium)
hybrids occurred in areas occupied by both parent species. Artificial
hybrids were easily created, so researchers suspect that selective
insect foraging may limit the occurrence of natural hybrids [15,63].
In North America, researchers suspect that giant hogweed × common
cowparsnip (H. maximum) hybrids are possible, but none have been
reported [42]. Although giant hogweed × eltrot hybrids are possible
in North America, none were reported in the available literature (2009). Hybrids
are discussed more in the Botanical description, Vegetative regeneration, and Control sections of this review.
Most research indicates that giant hogweed dies after flowering and that vegetative regeneration is restricted to damaged plants or hybrids. During extensive studies of giant hogweed in its native Caucasus habitats and in its nonnative habitats in the Czech Republic, all plants were "strictly monocarpic" [45]. In southern Ontario, however, field observations led Morton [33] to suspect that some giant hogweed plants sprouted after flowering. European researchers have suggested that Morton mistook a seedling near a dead stem for a vegetative sprout but acknowledged that perennial species occur within the Heracleum genus and suggested that a perennial giant hogweed growth form may be possible [45,47].
It is generally accepted that giant hogweed hybrids may be perennial and that sprouting occurs when flowering plants are damaged. Giant hogweed × eltrot hybrids, produced when eltrot was the maternal parent, reproduced successfully and did not die after flowering. Hybrids are likely short-lived, however. Naturally occurring hybrids found in southern Scotland in 1977 were not found in 1982 [63]. Damaged giant hogweed plants may sprout following damage and survive until their flowering year [70]. In late June in Germany, giant hogweed cut at the base flowered within 3 weeks of cutting [41]. For more on the survival of damaged plants, see Spread, Impacts, and Control.
El julivert gegant (Heracleum mantegazzianum) és una espècie de planta membre de la família Apiaceae natiu de la regió del Caucas i Àsia central. És una espècie invasora i verinosa que ha provocat més preocupació a l'Europa mitjana i septentrional, a causa de la seva expansió ràpida, de la capacitat que té de modificar els hàbitats, lligada a les seves grans dimensions.[1][2] A Catalunya, una primera infecció s'ha constatat a la vall de l'alt Segre el 2012.
Com el seu nom indica, es distingeix per la seva grandària de dos a cinc metres d'altura. Amb excepció de la seva grandària és semblant a l'Heracleum sosnowskyi i Angelica archangelica. Es distingeix per les seves tiges buides que aconsegueixen els 3-10 cm de diàmetre. Floreix a la fi de l'estiu i produeix llavors seques, el·líptiques, aplanades i molt nombroses (entre 10.000-20.000). És una planta biennal, que nogensmenys en circumstàncies adverses (manca de sol) pot sobreviure fins a set-vuit anys, abans de florir. Després de florir mor.
És una de les més tòxiques del gènere heracleum, que tots produeixen substàncies del grup dels furanocumarines que sota la influència dels raigs utraviolets del sol esdevenen extremament fototòxics per a la pell, tant per a humans com animals. Totes les parts, comprés les parts mortes, i particularment la seba són tòxiques. Després de tocar la planta amb la pell i sota la llum es creen edemes o butllofes que s'assemblen molt a cremades, molt doloroses i que es guareixen molt a poc a poc, en deixar cicatrius. S'aconsella sempre portar vestits i ulleres protectors en tractar les plantes. En cas de contacte no protegit amb la planta, s'ha de cercar assistència mèdica i protegir-se del sol. És tant més perillòs, com que la reacció cutània no és immediata, i que persones que desconeixen la planta força decorativa, no sempre fan la relació de causa a efecte.[3]
És una espècie invasora als Estats Units i Europa occidental. La seva dispersió va tenir diverses raons: inicialment va ser utilitzada com a planta decorativa. També, els apicultors la van promoure, per les seves múltiples flors. Sobretot a Rússia s'ha conreat el julivert gegant com a farratge, en exaltar la seva rapidesa de creixement: amb un rendiment cap a 6-7 tones de farratge (secat) per hectàrea.[4] Aquest ús es va abandonar, com que tenia efectes dolents en el gust i el color de la llet i donava un gust amarg a la carn bovina.[5]
La Unió Europea prepara una reglementació per a inscriure'l a la llista de les espècies de major preocupació.[2] El Govern d'Espanya va inscriure l'Heracleum mantegazzianum al Catàleg espanyol d'espècies invasores l'11 de desembre de 2011 per Reial Decret. El decret prohibeix la introducció al medi natural de tota espècie invasora a tot el territori de l'estat i prohibeix la possessió, el transport, el tràfic i el comerç d'exemplars vius o morts, de restes o de propàguls. Només per a raons d'investigació, salut i securitat de persones, l'administració pot concedir excepcions. El decret també estipula l'estratègia de prevenció i d'erradicació i les sancions en cas de contravenció.[6] A la zona mediterrània encara és rara. A Alemanya ans al contrari, el cost dels danys causats pel julivert gegant per l'erosió a les ribes s'estimen a uns dotze milions d'euros per any.[7]
A Catalunya, un primer fòcus d'infecció s'ha constatat el 2012 a les ribes del riu Segre, probablement provocat per una expansió natural després d'un ús decoratiu en jardins o parcs.[8] Per les seves dimensions, la rapidesa del creixement i les desenes de milers de llavors que produeix és molt eficaç. Com que les fulles comencen a créixer força aviat a l'any, expulsa la vegetació autòctona més tardiva, que ho té difícil sobreviure sota l'ombra dels seus fulls. Necessita molta aigua i la seva expansió a les zones més eixudes del mediterrani es fa sobretot en seguir els llits dels rius.
El control més eficaç es fa per extracció mecànica amb l'arrel, amb millors resultats quan es fa ràpidament a l'inici de la invasió. La mera sega només és eficaç si es repeteix regularment en una mateixa estació, com que l'arrel té molta vigor per tornar generant brots nous. El control amb remugants, s'ha provat ineficaç, com que la carn o la llet obtenen mal gust.[9] Tallar la flor abans que els llavors maduressin, té un efecte contrari, com que el julivert tendeix a recrear brots nous, encara més grans que els brots tallats. El control químic només funciona amb herbicides com el triclopir, d'impacte ambiental baix o el glifosat força tòxic per a l'humà i la fauna, suspecte de provocar càncer quan entra en el circuit alimentari.[10] Quin que sigui el mètode de control utilitzat, només es pot s'apropar del julivert gegant amb un vestit de protecció complet.
El julivert gegant (Heracleum mantegazzianum) és una espècie de planta membre de la família Apiaceae natiu de la regió del Caucas i Àsia central. És una espècie invasora i verinosa que ha provocat més preocupació a l'Europa mitjana i septentrional, a causa de la seva expansió ràpida, de la capacitat que té de modificar els hàbitats, lligada a les seves grans dimensions. A Catalunya, una primera infecció s'ha constatat a la vall de l'alt Segre el 2012.
Com el seu nom indica, es distingeix per la seva grandària de dos a cinc metres d'altura. Amb excepció de la seva grandària és semblant a l'Heracleum sosnowskyi i Angelica archangelica. Es distingeix per les seves tiges buides que aconsegueixen els 3-10 cm de diàmetre. Floreix a la fi de l'estiu i produeix llavors seques, el·líptiques, aplanades i molt nombroses (entre 10.000-20.000). És una planta biennal, que nogensmenys en circumstàncies adverses (manca de sol) pot sobreviure fins a set-vuit anys, abans de florir. Després de florir mor.
Planta verinosa per l'home i els animalsÉs una de les més tòxiques del gènere heracleum, que tots produeixen substàncies del grup dels furanocumarines que sota la influència dels raigs utraviolets del sol esdevenen extremament fototòxics per a la pell, tant per a humans com animals. Totes les parts, comprés les parts mortes, i particularment la seba són tòxiques. Després de tocar la planta amb la pell i sota la llum es creen edemes o butllofes que s'assemblen molt a cremades, molt doloroses i que es guareixen molt a poc a poc, en deixar cicatrius. S'aconsella sempre portar vestits i ulleres protectors en tractar les plantes. En cas de contacte no protegit amb la planta, s'ha de cercar assistència mèdica i protegir-se del sol. És tant més perillòs, com que la reacció cutània no és immediata, i que persones que desconeixen la planta força decorativa, no sempre fan la relació de causa a efecte.
Planta invasoraÉs una espècie invasora als Estats Units i Europa occidental. La seva dispersió va tenir diverses raons: inicialment va ser utilitzada com a planta decorativa. També, els apicultors la van promoure, per les seves múltiples flors. Sobretot a Rússia s'ha conreat el julivert gegant com a farratge, en exaltar la seva rapidesa de creixement: amb un rendiment cap a 6-7 tones de farratge (secat) per hectàrea. Aquest ús es va abandonar, com que tenia efectes dolents en el gust i el color de la llet i donava un gust amarg a la carn bovina.
La Unió Europea prepara una reglementació per a inscriure'l a la llista de les espècies de major preocupació. El Govern d'Espanya va inscriure l'Heracleum mantegazzianum al Catàleg espanyol d'espècies invasores l'11 de desembre de 2011 per Reial Decret. El decret prohibeix la introducció al medi natural de tota espècie invasora a tot el territori de l'estat i prohibeix la possessió, el transport, el tràfic i el comerç d'exemplars vius o morts, de restes o de propàguls. Només per a raons d'investigació, salut i securitat de persones, l'administració pot concedir excepcions. El decret també estipula l'estratègia de prevenció i d'erradicació i les sancions en cas de contravenció. A la zona mediterrània encara és rara. A Alemanya ans al contrari, el cost dels danys causats pel julivert gegant per l'erosió a les ribes s'estimen a uns dotze milions d'euros per any.
A Catalunya, un primer fòcus d'infecció s'ha constatat el 2012 a les ribes del riu Segre, probablement provocat per una expansió natural després d'un ús decoratiu en jardins o parcs. Per les seves dimensions, la rapidesa del creixement i les desenes de milers de llavors que produeix és molt eficaç. Com que les fulles comencen a créixer força aviat a l'any, expulsa la vegetació autòctona més tardiva, que ho té difícil sobreviure sota l'ombra dels seus fulls. Necessita molta aigua i la seva expansió a les zones més eixudes del mediterrani es fa sobretot en seguir els llits dels rius.
ControlEl control més eficaç es fa per extracció mecànica amb l'arrel, amb millors resultats quan es fa ràpidament a l'inici de la invasió. La mera sega només és eficaç si es repeteix regularment en una mateixa estació, com que l'arrel té molta vigor per tornar generant brots nous. El control amb remugants, s'ha provat ineficaç, com que la carn o la llet obtenen mal gust. Tallar la flor abans que els llavors maduressin, té un efecte contrari, com que el julivert tendeix a recrear brots nous, encara més grans que els brots tallats. El control químic només funciona amb herbicides com el triclopir, d'impacte ambiental baix o el glifosat força tòxic per a l'humà i la fauna, suspecte de provocar càncer quan entra en el circuit alimentari. Quin que sigui el mètode de control utilitzat, només es pot s'apropar del julivert gegant amb un vestit de protecció complet.
Planhigyn blodeuol ydy Efwr enfawr sy'n enw benywaidd. Mae'n perthyn i'r teulu Apiaceae. Yr enw gwyddonol (Lladin) yw Heracleum mantegazzianum a'r enw Saesneg yw Giant hogweed.
Mae'r dail gyferbyn a'i gilydd ac mae gan y blodyn 5 petal. Gall dyfu i of 2–5.5 m (6 tr – 18 tr) o uchder.
Dyma ddywed Gabriel Queré am Heracleum mantegazzianum ym mis Mehefin 2010 yng ngefn gwlad o gwmpas Moscow:
Planhigyn blodeuol ydy Efwr enfawr sy'n enw benywaidd. Mae'n perthyn i'r teulu Apiaceae. Yr enw gwyddonol (Lladin) yw Heracleum mantegazzianum a'r enw Saesneg yw Giant hogweed.
Mae'r dail gyferbyn a'i gilydd ac mae gan y blodyn 5 petal. Gall dyfu i of 2–5.5 m (6 tr – 18 tr) o uchder.
Bolševník velkolepý (Heracleum mantegazzianum) je impozantní rostlina z čeledi miříkovitých pocházející z oblasti centrální Asie (Kavkaz a z jihu přilehlé oblasti). Dorůstá několika metrů (až pěti) a jeho bílá květenství – složené okolíky – mohou dosahovat i půl metru v průměru.
V současné době je bolševník velkolepý v mnoha zemích severní polokoule, včetně České republiky, veden jako nebezpečný invazní druh, který je schopen ničit původní ekosystémy na daném území.[2] Fototoxické furanokumariny, které obsahuje, u člověka způsobují těžké fotodermatitidy (dráždí kůži a způsobují vyrážky a puchýře).
Také proto se vůči bolševníku nasazují nejrůznější způsoby boje, včetně postřiků a mechanického odstraňování, a je centrem pozornosti řady výzkumných projektů zaměřených na jeho ekologii a nalezení vhodných metod potlačování jeho výskytu.
Bolševník velkolepý byl vědecky popsán až v roce 1895, a to pod platným názvem Heracleum mantegazzianum.[3] Má však několik synonym, k nimž patří:
Podle některých autorů se za synonyma mohou považovat také následující druhy:
Toto však není potvrzeno. Pokud by tomu tak bylo, pak platným jménem by bylo starší z těchto dvou jmen. V literatuře se také vyskytovalo chybné určení jedinců tohoto druhu jako H. speciosum auct. non Weinmann, který může být v oblasti střední Evropy také jiným, zavlečeným druhem.[4]
Bolševník velkolepý je rostlina impozantního vzrůstu, ve středoevropských podmínkách dorůstá 2–4, někdy až 5 metrů výšky.[3] Jde o dvou- až víceletou rostlinu, která v prvním roce klíčí ze semene zpravidla již v půli února (někdy i dříve), vytváří pouze listy a shromažďuje zásoby v mohutném kořeni. Druhý až pátý rok (ale možná i později – směrodatné je, za jak dlouho se rostlině podaří nastřádat zásoby) pak vytvoří listovou růžici a vyžene mohutnou květní lodyhu s květenstvím. Lodyha je dutá, brázditě žebernatá, narůžověle až fialově skvrnitá, u největších exemplářů se její průměr může blížit až 10 cm.[3][4]
Listy jsou veliké, zvláště přízemní, dosahují nejčastěji délky 50–150 cm.[4] Listy jsou řapíkaté (kromě horních), řapíky jsou oblé bez zřetelného žlábku.[5] Na bázi listu jsou listové pochvy.[4] Jsou střídavé, složené, trojčetné až zpeřeně složené a jednotlivé lístky jsou dále dělené, peřenodílné až peřenosečné, na okrajích dále nerovnoměrně pilovité.[4] Listy se na rostlině odzdola nahoru zmenšují. Horní už jsou o mnoho menší a skoro přisedlé, na bázi s nápadně rozšířenou otevřenou listovou pochvou.[4] Čepel je na líci lysá, na rubu roztroušeně chlupatá.
Květy jsou uspořádány do květenství, kterým je složený okolík. Protože se rostlina větví, je na jedné rostlině těchto složených okolíků více, kdy vrcholový je největší. Mívá nejčastěji 30–50 cm v průměru[4], někdy údajně až přes 1 m v průměru.[zdroj?] Vrcholový složený okolík obsahuje nejčastěji 30–60 okolíčků.[4] Na bázi složeného okolíku je přeslen listenů zvaný obal, listenů obalu je nejčastěji 1–12, jsou kopinaté až čárkovitě šídlovité.[4] Na bázi okolíčku je potom přeslen listenů zvaný obalíček, listenů obalíčku je nejčastěji 8–15 a jsou také kopinaté až čárkovitě šídlovité.[4] Okrajové květy v květenství jsou paprskující,[4] to znamená, že jsou zygomorfní a koruna se nápadně zveličuje směrem vně květenství.[6]
Květní vzorec bolševníku je ✶/↓ K5 C5 A5 Ğ(2). Květy jsou většinou oboupohlavné, někdy v bočních menších okolících i samčí a sterilní, u středu květenství jsou pravidelné (aktinomorfní), zvláště okrajové paprskující květy pak souměrné (zygomorfní). Kališních lístků je 5, jsou srostlé v drobný kališní lem, na okraji se zřetelnými volnými cípy.[4] Korunních lístků je také 5, jsou volné, dělené, což je nápadné nejvíce u zveličelých paprskujících kurunních lístků. Ty jsou hluboce rozdělené na 2 laloky a ve výkrojku je ještě nazpět postavený drobný lalůček.[4] Koruna má sněhobílou barvu, na bázi až slabě žlutavě nazelenalou, poupata mohou být někdy bledě růžová. Tyčinek je 5, jsou volné, prašníky jsou zelenavě žluté.[4] V oboupohlavních květech dozrává nejdříve pyl v prašnících, později blizna, nicméně mezi jednotlivými květy může dojít k překryvu pohlavní zralosti blizen a pylu. K opylení dochází za pomoci hmyzích opylovačů (entomogamie, tedy typ zoogamie), obvykle mezi různými rostlinami, nicméně dochází i k úspěšnému samoopylení (taktéž díky opylovačům) a i jediná osamocená rostlina tedy produkuje klíčivá semena. Gyneceum je srostlé ze 2 plodolistů, semeník je spodní.[7] Čnělky jsou 2 a jsou nasazeny na rozšířené bázi zvané stylopodium.[7] Ve středoevropských podmínkách kvete bolševník velkolepý většinou od půle června až do konce července, někdy až do září.[5]
Plodem je dvounažka, která se rozpadá na 2 merikarpia (plůdky) spojené karpoforem, každé merikarpium obsahuje 1 semeno. Dvounažka je silně zploštělá, na hřbetě žebernatá, 3 střední žebra jsou nitkovitá a navzájem sblížená, 2 postranní (okrajová, marginální) jsou široce křídlatá.[4] Jedna rostlina vyprodukuje obvykle 20 000–30 000 semen (obzvláště vzrostlý jedinec až 100 000), která si uchovávají klíčivost 8 až 12 let (déle než tři roky však přežívá v semenné bance už jen nepatrný zlomek semen, ovšem je nutno mít na paměti, kolik semen rostlina vytvoří a že i jediný jedinec může znovu zahájit invazi). Počet chromozómů je 2n=22.[5]
Je zajímavé, že v oblastech, které se považují za jeho původní areál, dorůstá bolševník velkolepý zhruba 1,5 metru[zdroj?] a není ani zdaleka tak agresívní. Nutno ovšem podotknout, že rostliny rostoucí v předpokládaných oblastech původu jsou podstatně odlišné i pokud jde o genovou výbavu, což bylo patrně způsobeno rozličným křížením a též účelovou selekcí v průběhu šíření a pěstování druhu v okrasných a botanických zahradách a následném zplaňování. Tento fakt značně komplikuje snahu najít vhodného přirozeného nepřítele tohoto bolševníku – pokud se už nějaký najde, zpravidla napadá příliš široké spektrum rostlin čeledi miříkovité.
Kromě bolševníku velkolepého roste v Česku ještě bolševník obecný (Heracleum sphondylium), který se svému příbuznému trochu podobá. Není vyloučeno, že se v místech společného výskytu oba druhy kříží; z Velké Británie a Německa byl již výskyt kříženců Heracleum sphondylium × mantegazzianum hlášen. V některých evropských zemích dochází k invazi dalších tzv. „obřích bolševníků“ podobného vzhledu a vlastností, konkrétně jde o druhy bolševník Sosnowského (Heracleum sosnowskyi) šířící se zejména v Pobaltí a bolševník perský (Heracleum persicum), který soupeří s bolševníkem velkolepým o titul nejobtížnější invazní druh Fennoskandinávie, z globálního hlediska je ale význam těchto invazí mnohem menší.[zdroj?]
Jakožto invazní rostlina osidluje bolševník velkolepý téměř veškerá stanoviště. Šíří se podle cest a vodních toků. Obvykle nejdřív ovládne ruderální stanoviště, kde mu r-stratégové nemohou konkurovat, a s podporou takto vzniklých ohnisek se pak začne šířit i na vlhká a na živiny bohatá stanoviště v okolí, odkud postupně vytlačí konkurenčně silné byliny. Využívá k tomu faktu, že jeho semena vyklíčí velmi brzy na jaře, rychle přerostou většinu rostlin a vytvoří zákryv, který mu poskytuje velkou výhodu. Časem dojde obvykle k vytvoření souvislého porostu, který může pohltit 80 % veškerého slunečního záření a zcela znemožnit ostatním rostlinám růst. Mortalita vzrostlých rostlin je před vysemeněním malá, protože je pro většinu býložravců i parazitů nestravitelná (nepoživatelná).
Ovládne-li bolševník velkolepý nějaký prostor, nelze dost dobře předpokládat, že by se ho příroda v dohledné době sama zbavila a k jeho vytlačení je třeba lidského zásahu. Jeho porost vytváří prostředí nevhodné pro růst většiny rostlin, včetně semenáčků stromů a představuje zdravotní riziko pro zvířata i člověka. V porostu panuje silná úroveň kompetice, prosadí se jen silní jedinci.
Přirozené šíření zajišťují semena roznášená větrem a tekoucí vodou, dále mají význam i semena zachycená na dobytku či pneumatikách. Rychlost šíření je v globálním i regionálním měřítku srovnatelná s nejnebezpečnějšími invazními druhy, v závislosti na podmínkách může docházet ke každoročnímu posunu hranice plochy zarostlé bolševníkem až o desítky metrů.
Bolševník velkolepý byl do Evropy zavlečen z Kavkazu a přilehlých oblastí jako okrasná rostlina. Ačkoliv byl bolševník velkolepý popsán až roku 1895, první spolehlivá informace o introdukci do Evropy pochází již z roku 1817 v londýnské botanické zahradě Kew Gardens. Po deseti letech se však již objevují zprávy o planě rostoucích populacích v hrabství Cambridgeshire. Nato začala samovolná i lidmi zapříčiněná invaze bolševníku velkolepého do celé Evropy, například v ČR byl poprvé vysazen v Lázních Kynžvart v roce 1862.[3]
Pěstovat se bolševník přestal v půli dvacátého století,[3] ale invaze bolševníku velkolepého již v té době zasáhla většinu Evropy. Za centrum invaze lze považovat střed kontinentu. Jako s velmi vážným problémem se s ní potýká Česká republika, Německo, Slovensko, jižní a západní Polsko, Švýcarsko, země Beneluxu, východ a sever Francie, Anglie a Dánsko. Ve Fennoskandinávii (v přírodovědeckém pojetí) a zbytku Švédska soutěží s invazí bolševníku perského. Jen minimální význam má v Pobaltí, kde se s obrovskou převahou prosadil příbuzný druh Heracleum sosnowskyi. Mimo Evropský kontinent se invaze odehrává i v Severní Americe.
V Česku pravděpodobně nechal vysadit první bolševníky kníže Metternich, první záznam o jejich pěstování v parku zámku Kynžvart pochází z roku 1862 (vysazen byl ale patrně mnohem dříve, car Alexandr I. měl darovat semena bolševníku Metternichovi během Vídeňského kongresu, který probíhal v roce 1815). První zplanělé jedince v okolí objevili v roce 1877.[8]
V roce 1907 byl zaznamenán výskyt na severovýchodní Moravě. V roce 1950 bylo známo celkem 9 lokalit jeho výskytu ve volné přírodě. V současné době je jich známo 600 (a podle odborníků jich ve skutečnosti může být až třikrát víc). Jeho rozšíření zpočátku hodně napomáhal fakt, že byl považován za nenáročnou okrasnou květinu. Módní vlna pěstování tohoto bolševníku začala opadat v polovině 20. století, kdy se začaly v západní literatuře objevovat první varovné zprávy o potížích, avšak ještě v 80. letech 20. století, kdy už bylo zřejmé, o jak nebezpečnou rostlinu jde, byl uváděna v některých zahrádkářských publikacích jako nenáročná okrasná rostlina bez jakýchkoliv varování či upozornění na rizika.[9]
Bolševník velkolepý je řazen mezi vůbec nejnebezpečnější invazní druhy na českém území (platí i pro území mnoha dalších států). Podle českých zákonů je majitel pozemku povinen zabezpečit nešíření této rostliny[10], což není vždy dodržováno. Vzhledem ke zdravotním rizikům je nezbytné používat při likvidaci bolševníku vhodný ochranný oděv, který nenasaje a nepropustí nebezpečné šťávy z rostliny, a další ochranné pomůcky, jako jsou ochranné brýle nebo obličejový štít a případně i respirátor.
Mechanické odstranění je nutno provést pokud možno před vysemeněním rostliny (obvykle to znamená nejpozději v první půli května). Jeho účinek je omezený, neboť rostlina má vysokou regenerační schopnost a dokáže znovu vyrůst z kořenů – jednotlivé rostliny je tedy potřeba celé vykopat (ven musí minimálně 10 cm hlavního kořene), rozsekat na kousky a ty zlikvidovat. Pokosení či podobná likvidace pouze dočasně odstraní porost a zabrání dalšímu šíření. Pravidelný pokos (ve středoevropských podmínkách 2–3× za sezónu po dobu několika let) vede nakonec i k potlačení výskytu – nutné ovšem je, aby byl dlouhodobý a naprosto důkladný, aby nedošlo k vysemenění ani jediné rostliny. U jednotlivých rostlin se doporučuje odsekat vykvetlé okolíky (drtivá většina rostlin poté zajde), je ovšem třeba okolíky zlikvidovat, aby pak pohozené na poli setrvačností nevysemenily.
Zajímavou možnost představuje spasení dobytkem – ovce a hovězí dobytek se časem naučí bolševník konzumovat. Poté, co si na něj zvyknou (zpravidla jim nejdříve nechutná), většinou aktivně vyhledávají mladší čerstvé rostliny, které upřednostňují před většinou ostatních rostlin. Osvědčil se i pokos souvislého vrostlého porostu bolševníku a následné opakované spásání dobytkem, který zlikviduje pokusy rostlin o obnovu. Doporučovaná míra spásání je 20–30 ovcí na hektar na jaře, v létě je možno jejich počet snížit až na 5–10, neboť rostliny jsou již opakovanými pokusy o regeneraci vyčerpané a regenerují pomaleji. Nečetné výzkumy v oblasti spásání kozami ukazují, že tato zvířata nejsou pro spásání bolševníku vhodná, neboť nevykazují vůči negativním aspektům působení rostliny dostatečnou odolnost.
Účinný je chemický postřik obsahující glyfosát (např. Roundup-Biaktiv nebo Touchdown) či triclopyr (např. Garlon). Nutno uvážit, že chemický postřik není stoprocentně spolehlivý a je zde nevýhoda jeho nedostatečné selektivnosti. K aplikaci postřiku by mělo docházet pokud možno brzy na jaře, když rostliny dosáhnou výšky zhruba 20–40 cm (asi duben), na konci května je třeba jej zopakovat. Jen minimální nebo žádný účinek má v době kvetení rostliny. Vysoce účinná, ale pracná je metoda aplikace Roundupu injekční stříkačkou do stonku rostliny.
Vzhledem k náročnosti likvidace bolševníku je velice důležitá maximální prevence, spočívající v pečlivé likvidaci všech osamělých předsunutých jedinců, kteří by mohli založit novou enklávu, a v kontrole rizikových stanovišť, kde by se bolševník mohl uchytit.
Při boji s bolševníkem je samozřejmě možné kombinovat více metod jeho ničení. U jednotlivých rostlin se třeba osvědčila likvidace spočívající v odseknutí byliny těsně nad zemí a potření pahýlu stonku silnou koncentrací herbicidu. Vždy je nutno pamatovat na to, že nestačí výskyt rostliny potlačit, nemá-li se celá kalamita opakovat, je nutno vést boj až do posledního bolševníku a i po totálním vítězství je nezbytné ještě minimálně 10 let oblast pečlivě hlídat. Je také vhodné upravit vyčištěné prostranství tak, aby se omezila jeho vhodnost pro nové zaplavení bolševníkem.
Šťáva z lodyh a listů této rostliny obsahuje fototoxické furanokumariny. Ve tmě jen dráždí kůži, na denním světle (respektive na jakémkoliv světle obsahujícím UV složky) způsobují těžké poleptání a zpuchýřnatění pokožky. Je třeba být opatrný a při kosení či jiném mechanickém odstraňování rostlin se vybavit vhodným ochranným oděvem, brýlemi a také respirátorem (zejména pokud je používána ke kosení sekačka, díky které může docházet k rozprášení rostlinných šťáv ve vzduchu). Je velice důležité v oblastech výskytu bolševníku varovat děti a dávat na ně pozor, neboť duté lodyhy rostliny je mohou svádět ke hrám a výrobě různých napodobenin dalekohledů a foukaček, což může vést k minimálně dočasnému znetvoření obličeje, o riziku vážného poškození zraku nemluvě.
Je nutno si uvědomit, že prvotní kontakt s rostlinou a jejími šťávami je bezbolestný, takže např. děti si s ní mohou hrát i několik hodin, aniž by si vůbec uvědomily, jakou škodu si tím způsobují. Fototoxické reakce, které jsou příčinou následných problémů, se aktivují obvykle po 15 minutách osvětlení[3] (závisí ovšem na intenzitě světla a jeho složení). Zánětlivá zranění se objevují po cca 24 hodinách v rozsahu, který je závislý jednak na množství šťáv, kterými byl člověk potřísněn, délky jejich působení a obranyschopnosti poškozeného, jsou velmi bolestivá a velmi těžce se hojí. Účinek rostlinných šťáv dále zvyšuje horko a vlhkost. Jejich pozůstatky, jako jsou pigmentace a jizvy, zůstávají patrné přinejmenším celé měsíce, někdy se objevují dlouhodobější následky v podobě vyšší citlivosti poraněných míst na UV záření (trvají až několik let).[3] Podle některých dermatologů mohou být dlouhodobým následkem občasné vyrážky (často iniciované slunečním zářením).[zdroj?]
U obzvlášť citlivých jedinců mohou už samotné výpary z většího množství pokosených rostlin vyvolat pálení v krku, závratě, nevolnost a slzení.[zdroj?] U těchto lidí se také může stát, že jim ke vzniku zánětů postačí dotek neporaněného listu.[3]
Místa potřísněná šťávou je nutno okamžitě omýt silným dlouhotrvajícím proudem vody a po opláchnutí zabránit přístupu světla vhodným zakrytím.[3] Při poleptání a druhotných příznacích (bolesti hlavy, třes) je nutno po předchozím ošetření vyhledat lékaře.
Pokud pocítíte z výparů této rostliny závratě, pálení očí a jiné nežádoucí účinky, je nejlepší opustit zasažený prostor a přenechat likvidaci bolševníku méně citlivým jedincům, případně použít vhodné ochranné prostředky (kvalitní respirátor). Pokud jsou obtíže většího rozsahu nebo do jednoho dne neustoupí, je třeba taktéž navštívit lékaře.
Celá rostlina obsahuje například různé alkoholy (methanol, ethanol, n-oktanol), karboxylové kyseliny (kyselina kaprinová, kyselina laurinová) či estery (n-hexylbutyrát, n-oktylacetát).[zdroj?]
Nejvýznačnější účinnou složkou obsaženou v celé rostlině jsou však fototoxické furanokumariny obsažené především v plodech; méně pak v listech a jen minimálně ve stonku. Obsah se však mění i v průběhu roku, nejvíce jich rostlina obsahuje v červnu, nejméně v listopadu.[11] K významným furanokumarinům bolševníku patří například angelicin, pimpinellin, isopimpinellin, phellopterin, psoralen, bergapten a isobergapten.[zdroj?]
Bolševník velkolepý (Heracleum mantegazzianum) je impozantní rostlina z čeledi miříkovitých pocházející z oblasti centrální Asie (Kavkaz a z jihu přilehlé oblasti). Dorůstá několika metrů (až pěti) a jeho bílá květenství – složené okolíky – mohou dosahovat i půl metru v průměru.
V současné době je bolševník velkolepý v mnoha zemích severní polokoule, včetně České republiky, veden jako nebezpečný invazní druh, který je schopen ničit původní ekosystémy na daném území. Fototoxické furanokumariny, které obsahuje, u člověka způsobují těžké fotodermatitidy (dráždí kůži a způsobují vyrážky a puchýře).
Také proto se vůči bolševníku nasazují nejrůznější způsoby boje, včetně postřiků a mechanického odstraňování, a je centrem pozornosti řady výzkumných projektů zaměřených na jeho ekologii a nalezení vhodných metod potlačování jeho výskytu.
Kæmpebjørneklo (Heracleum mantegazzianum), ofte skrevet kæmpe-bjørneklo, er en toårig, urteagtig plante. Den kan dog blive flerårig, indtil den får lejlighed til at blomstre. Væksten er kraftig og opret med en hul stængel, der kan være op til 10 cm i diameter. Planten er giftig og fremkalder fotodermatitis, dvs. brandsårsagtige skader, hvor plantesaften rammer huden og derefter bliver belyst af solen.
Kæmpebjørneklo har en stængel med spredte, røde pletter og bærer stive hår. Grundbladene, som dannes det første år, er meget store og dybt indskårne med groft tandede lapper. Blomstringen sker hvert andet år i juni-juli, og den består af endestillede storskærme med flere linjeformede svøbblade. Storskærmen er bygget op af 50-150 småskærme, der hver har nedadrettede småsvøb. De enkelte blomster er hvide og mere eller mindre uregelmæssige. Frugterne er flade og glatte med en ubehagelig lugt. De spirer meget villigt.
Den er naturaliseret overalt i Europa, hvor den invaderer steder med let skygge, vedvarende fugtig jord med et højt indhold af humus og næringsstoffer. Den stammer dog oprindelig fra den nordlige kæde i Kaukasus, hvor den findes i enge, lysninger, skovbryn, skove og ofte langs vandløb. I disse bjerge er der en årlig nedbør på 1.000-2.000 mm og et tempereret, fastlandsklima.
Ved den georgiske landsby Omalo i Tushetidalen, findes den sammen med bl.a. Aquilegia olympica, Dactylorhiza euxina, Echium russicum, engkabbeleje, engnellikerod, hulkravet kodriver, langakset trådspore, Primula luteola og rosenkrave.
Kæmpebjørneklo er i mange lande en indført plante og altså ikke oprindeligt hjemmehørende her. Ofte har planten fået lov til at brede sig uhæmmet, og har dannet tætte bevoksninger, hvorved der skygges for alt andet. Der er flere muligheder for at bekæmpe den:
Kæmpebjørneklo (Heracleum mantegazzianum), ofte skrevet kæmpe-bjørneklo, er en toårig, urteagtig plante. Den kan dog blive flerårig, indtil den får lejlighed til at blomstre. Væksten er kraftig og opret med en hul stængel, der kan være op til 10 cm i diameter. Planten er giftig og fremkalder fotodermatitis, dvs. brandsårsagtige skader, hvor plantesaften rammer huden og derefter bliver belyst af solen.
Der Riesen-Bärenklau (Heracleum mantegazzianum Sommier & Levier, Syn.: Heracleum giganteum Hornem.), auch Bärenkralle, Herkulesstaude oder Herkuleskraut genannt, ist eine Pflanzenart aus der Gattung Bärenklau (Heracleum) innerhalb der Familie der Doldenblütler (Apiaceae). Sie ist eine zwei- bis mehrjährige, wenn unbeeinflusst einmalblühende (hapaxanthe) krautige Pflanze. Ursprünglich stammt sie aus dem Kaukasus und ist in Europa und Nordamerika ein invasiver Neophyt.
Der Riesen-Bärenklau bildet photosensibilisierende Substanzen aus der Gruppe der Furocumarine, die in Kombination mit Sonnenlicht oder auch stärkerem Lampenlicht phototoxisch wirken. Berührungen in Verbindung mit Tageslicht können bei Menschen und anderen Säugetieren zu schmerzhaften Quaddeln und Blasen führen, die schwer heilen und wie Verbrennungen erscheinen (Photodermatitis). Es wird deshalb empfohlen, beim Umgang mit der Pflanze vollständige Schutzkleidung zu tragen, zu der auch ein Gesichtsschutz gehört.
Der Riesen-Bärenklau wurde 2008 zur Giftpflanze des Jahres gewählt.
Verwechslungsmöglichkeiten bestehen in Mitteleuropa vor allem mit den großen einheimischen Doldenblütlern Wiesen-Bärenklau (Heracleum sphondylium) und Engelwurzen (Wald-Engelwurz, Angelica sylvestris und Arznei-Engelwurz, Angelica archangelica).
Der Riesen-Bärenklau wächst als zwei- bis mehrjährig-einmalblühende krautige Pflanze und erreicht als zweitjährige Pflanze oft innerhalb weniger Wochen eine Wuchshöhe bis zu 3 Metern. Das größte bisher gemessene Pflanzenexemplar, das ins Guinness-Buch der Rekorde eingetragen wurde, erreichte eine Wuchshöhe von 3,65 Metern. Der mäßig dicht behaarte und meist purpurn gefleckte Stängel hat an seiner Basis einen Durchmesser von 2 bis 10 Zentimetern. Er besitzt oft zahlreiche große, dunkle oder weinrote Flecken.
Die wechselständig angeordneten Laubblätter sind in Blattstiel und Blattspreite gegliedert und erreichen normalerweise eine Länge von 1 Meter, können jedoch samt Blattstiel auch 3 Meter lang werden. Die Blattspreite kann drei- oder fünf- bis neunteilig fiederschnittig sein. Die seitlichen Blattabschnitte können mehr als 1 Meter lang und mehr als 20 Zentimeter breit sein und sind meist ebenfalls tief geteilt.
Die sehr großen zentralen Blüten-Doppeldolden erreichen häufig einen Durchmesser von 30 bis 50 Zentimetern. Sie sind 30- bis 150-strahlig. Die Dolden einer einzigen Pflanze können bis zu 80.000 Einzelblüten enthalten und bis zu 15.000 Früchte (Doppelachänen mit jeweils zwei Samen) ausbilden. Die äußeren Blüten sind einseitig, vom Zentrum nach außen hin vergrößert (strahlend). Ihr Durchmesser beträgt 1 bis 2 Zentimeter. Der Durchmesser der Blüten im Inneren der Dolden dagegen beträgt nur 4 bis 8 Millimeter. Die Blütenfarbe ist weiß. Die Blütezeit erstreckt sich von Juni bis Juli.
Der Aufbau der Blüte entspricht der Grundform aller Doldenblütler und wird mit folgender Blütenformel beschrieben: ⋆ K 5 C 5 A 5 G ( 2 ) ¯ {displaystyle star K_{5};;C_{5};A_{5};G_{overline {(2)}}} 
Die Achänen sind bei einer Länge von 10 bis 14 Millimetern sowie einem Durchmesser von 6 bis 8 Millimetern oval, flach, und haben aufwärtsgebogene, borstig behaarte Randrippen sowie je vier dunkle Ölstriemen. Nach der Bildung der Achänen stirbt das Pflanzenexemplar ab. Kommt es nicht zur Blüte und zum Reifen der Früchte, kann das Pflanzenexemplar mehrere Jahre leben. Aufgrund der hohen Zahl von Samen ist der Riesen-Bärenklau eine Pflanze mit ausgeprägter Ausbreitungsfähigkeit. Ihre Samen bleiben zudem über mehrere Jahre hinweg keimfähig. Auf die maximale Dauer der Keimfähigkeit kann aufgrund einzelner Erfahrungsberichte bei der Beseitigung von Riesen-Bärenklau-Pflanzen geschlossen werden. Bei zumindest einem Fall entstanden nach einer siebenjährigen Beweidung durch Schafe keine neuen Keimlinge mehr und der Bestand an dem Standort erlosch vollständig.
Die Arznei-Engelwurz kommt an ähnlichen Standorten vor und kann mit dem Riesen-Bärenklau verwechselt werden
Die Chromosomenzahl beträgt 2n = 22.[1]
Die Samen des Riesen-Bärenklaus keimen sehr früh im Jahr aus; zur Aufhebung der Keimruhe benötigen sie eine Frosteinwirkung. Abhängig vom Mikroklima des jeweiligen Standorts kann das bereits Anfang bis Mitte Februar geschehen. Zusammen mit dem starken Wachstum der Pflanzen hat der Riesen-Bärenklau damit gegenüber konkurrierenden Pflanzenarten einen wesentlichen Vorteil. Einjährige Pflanzen erreichen zu Beginn des Monats Mai, wenn die meisten in Mitteleuropa heimischen Pflanzen noch kein stärkeres Längenwachstum aufweisen, bereits eine Höhe von bis zu einem Meter. Die großen Blätter verschatten die übrige Vegetation und behindern damit deren Entwicklung. Ende Juni können ausgewachsene zweitjährige Pflanzen bereits eine Höhe von mehr als 3 Metern erreicht haben.
Die Pflanze speichert Stärke in einer rübenartigen Verdickung an der Basis des Sprosses und den oberen Teilen der Wurzel. Das ermöglicht ihr, sowohl im zweiten Jahr sehr früh auszutreiben als auch nach Rückschnitt erneut nachzutreiben. Der Riesen-Bärenklau kann daher trotz mehrfachen Mähens zur Blüte gelangen. Blüht und fruchtet das Pflanzenexemplar, wird dieses Speicherreservoir aufgebraucht und dieses Exemplar stirbt danach ab.
Der Riesen-Bärenklau zählt zu den stickstoffliebenden Pflanzen, stellt ansonsten aber wenig Ansprüche an den Boden. Lediglich mit sehr sauren Böden kommt er nicht zurecht. Selbst wenn der Samen keimt, sterben Keimlinge in stark saurem Milieu (pH 3,3 und weniger) innerhalb weniger Wochen wieder ab. Zur Bildung von Dolden und damit von Diasporen kommt es nur an sonnigen Standorten. Pflanzen an Standorten mit wenig Sonnenbestrahlung können allerdings mehrere Jahre überleben, ohne zur Blüte zu gelangen.
Die ökologischen Zeigerwerte nach Landolt & al. 2010 sind in der Schweiz: Feuchtezahl F = 3+w (feucht, mäßig wechselnd), Lichtzahl L = 3 (halbschattig), Reaktionszahl R = 3 (schwach sauer bis neutral), Temperaturzahl T = 3+ (unter-montan und ober-kollin), Nährstoffzahl N = 5 (sehr nährstoffreich bis überdüngt), Kontinentalitätszahl K = 4 (subkontinental).[2]
Der Riesen-Bärenklau enthält photosensibilisierende Substanzen sowie ätherische und fette Öle; letztere sind jedoch nur in den Ölstriemen der Früchte vorhanden. Zu den toxischen Komponenten zählen unter anderem die Furocumarine Xanthotoxin, Psoralen und Bergapten. Sie sind in fast allen Pflanzenbestandteilen enthalten. Giftfrei sind, soweit vorhanden, die weiße Innenauskleidung der hohlen Stängel; die Stängel selbst erst dann, wenn sie vollständig abgestorben sind und nur noch das weiße Zellskelett besteht.
Die Pflanze stammt ursprünglich aus dem Kaukasus und wird daher auch als Kaukasischer Bärenklau bezeichnet. Ihr natürliches Verbreitungsgebiet liegt im West-Kaukasus, westlich des Elbrus, wo sie vom Vorland des Gebirges bis in Höhen von 2200 Meter, oberhalb der Waldgrenze, verbreitet ist.[3] In seiner Heimat ist Heracleum mantegazzianum auf Waldrändern und Lichtungen anzutreffen, in Uferzonen und in Bergregionen mit einer jährlichen Niederschlagsmenge von 1000 bis 2000 mm und gemäßigt-kontinentalem Klima mit heißen Sommern und kalten Wintern.[4]
Der Riesen-Bärenklau wurde 1895 erstbeschrieben. Zahlreiche frühere Erwähnungen über Pflanzen in Gärten und Sammlungen, unter den Namen Heracleum giganteum (unter anderem erwähnt in einer als Erstnachweis viel zitierten Samenliste der Kew Gardens von 1817), Heracleum pubescens, Heracleum caucasicum und anderen, sind möglicherweise auf andere riesenwüchsige Bärenklau-Sippen des Kaukasus und umliegender Regionen, der Gattung Heracleum Sektion Pubescentia, besonders wohl Heracleum sosnowskyi, aber auch Heracleum persicum zu beziehen, sodass die frühe Ausbreitung unklar bleibt. Es wird aber allgemein angenommen, dass die Art große Teile Nordwest-Europas noch im 19. Jahrhundert erreichte.[5] Dass die sehr auffällige Pflanze in Europa so spät bekannt wurde, hängt mit der politischen Geschichte des Raums zusammen. Der Westkaukasus, die Heimat der Art, das Siedlungsgebiet der Tscherkessen, war durch die Eroberungskriege Russlands und dessen Dauerkonflikt mit dem Osmanenreich lange Zeit für Forschungsreisende zu riskant und erst nach der „Befriedung“ zugänglich geworden. Nach der Expedition der Botaniker und Pflanzensammler Carlo Pietro Stefano Sommier und Émile Levier im Jahr 1887, die die Pflanze erstmals wissenschaftlich beschrieben, wurde sie rasch als Gartenpflanze über Europa verbreitet.
Als Zierpflanze wird der Riesen-Bärenklau noch zu Beginn des 21. Jahrhunderts gelegentlich in Gärten und Parks verwendet. Dies wird wegen der unerwünschten Eigenschaften dieses invasiven Neophyten fachlich äußerst kritisch gesehen, daher ist seine Hortikultur beispielsweise in der Schweiz verboten worden.
Zur mitteleuropäischen Ausbreitung des Riesen-Bärenklau hat wesentlich beigetragen, dass der Pflanze ein wirtschaftlicher Nutzen unterstellt wurde. Imkern wurde er in der zweiten Hälfte des 20. Jahrhunderts wiederholt als Bienenweide empfohlen. Allerdings sind es – von unterhalb der hohen Dolden jedoch nicht erkennbar – überwiegend Mistbienen und eben nicht Honigbienen, die den offen dargebotenen Nektar aufnehmen. In der Forstwirtschaft verwendete man ihn, weil man mit den im Sommerhalbjahr dichten Beständen dieser Pflanze dem Wild zusätzliche Deckung geben wollte und der Überzeugung war, mit dieser Pflanze Böschungen befestigen zu können. Wegen dieses vermeintlichen wirtschaftlichen Nutzens wurde sie wiederholt in freier Natur angesalbt. In Deutschland ist das allerdings nach des Bundesnaturschutzgesetzes[6] genehmigungspflichtig. Er wurde zudem in die Schwarze Liste der invasiven Neophyten der Schweiz aufgenommen und der Freisetzungsverordnung unterstellt.[7][8]
Der Riesen-Bärenklau ist Anfang des 21. Jahrhunderts in ganz Mitteleuropa (Zentralrussland bis Frankreich, auf den Britischen Inseln, von Norwegen bis Ungarn) und Teilen Nordamerikas verbreitet.[9][10]
Das Spektrum an Standorten in Europa, an denen der Riesen-Bärenklau gedeiht, ist sehr viel größer als im Ursprungsgebiet. Ausgehend von Gärten und Parks sowie insbesondere von Standorten, an denen der Riesen-Bärenklau angesamt wurde, wächst er an Straßenrändern, in Bach- und Flusstälern sowie auf Brachen. Er breitet sich in Europa auch auf trockeneren und wärmeren Standorten aus als in seiner Heimat und ist deshalb nicht nur in der Saumvegetation von Hecken, Waldrändern, Bächen und Flüssen zu finden, sondern auch auf Halden, Ruderalstandorten und in Naturschutzgebieten. Kartierungen der Ausbreitung zeigen, dass die Art mit menschlicher Bevölkerungsdichte, niedrigen Wintertemperaturen und tonigen Moränen korrelierte.[11] Der Riesen-Bärenklau kommt in Deutschland besonders in nitrophilen Saumgesellschaften (Unterklasse Galio-Urticenea) vor.[12]
Sowohl in ihrem neuen als auch in ihrem ursprünglichen Verbreitungsgebiet nutzt sie unterschiedliche Ausbreitungsstrategien. In Europa und Nordamerika ist der Riesen-Bärenklau eine durch Menschen eingeführte Pflanze. Sie wird deswegen auch als hemerochore Pflanze bezeichnet.
Der Riesen-Bärenklau breitet seine Samen überwiegend durch den Wind (Anemochorie) aus. Die Ausbreitungsdistanzen, die dabei, von der Mutterpflanze ausgehend, überwunden werden, betragen bis zu 180 Meter leewärts (gemessen auf einem Mähwiesen-Hang oberhalb von Freiburg-Littenweiler). Die Fähigkeit der Pflanze, schnell große Flächen zu besiedeln, ergibt sich auch aus der Schwimmfähigkeit der Samen von bis zu drei Tagen. Samen einer Pflanze, die am Rand eines Gewässers steht, können so große Distanzen zurücklegen (Schwimmausbreitung, Nautochorie). Durch Hochwasser werden die Samen auch an höher gelegene Uferbereiche geschwemmt.
Untersuchungen von Invasionsbiologen haben am Beispiel der Verbreitung am Bach Auschnippe nördlich von Dransfeld (Landkreis Göttingen) zeigen können, dass offenbar alle Riesen-Bärenklauansiedlungen entlang dieses Baches auf eine in der Mitte von Dransfeld stehende Einzelpflanze zurückgingen. Vom Bach aus eroberte der Riesen-Bärenklau durch Windausbreitung erfolgreich weitere angrenzende Flächen wie Wiesen oder Brachland sowie Weiden.
Zur Ausbreitung der Diasporen trägt auch unbeabsichtigter Transport bei (Agochorie), vor allem durch landwirtschaftliche Fahrzeuge. Als Beispiel führt Kowarik[13] eine Anpflanzung durch einen Imker in der Mitte der 1980er Jahre am Kleinen Drakenberg an. Obwohl an diesem Ort keine Fließgewässer die Ausbreitung des Riesen-Bärenklau förderten, befanden sich 15 Jahre später Pflanzen bis zu 3,5 Kilometer von diesem ursprünglichen Ausbreitungsraum entfernt. Damit war die Art in der Lage, jährlich eine durchschnittliche Distanz von 233 Metern zu überwinden. Die neuen Vorkommen fanden sich überwiegend entlang von Wegen, die durch Kraftfahrzeuge genutzt wurden, sowie entlang von Wildwechseln, die vor allem von Wildschweinen passiert wurden. Letzteres wird als Beleg dafür angeführt, dass Riesen-Bärenklau auch zoochor, also durch Tiere ausgebreitet werden kann.
Diese im blühenden Stadium jahrzehntelang als besonders dekorativ wertgeschätzte Staude wurde seit Anfang des 21. Jahrhunderts als invasiver Neophyt betrachtet[14] und seine Ausbreitung häufig sehr emotional wahrgenommen oder reißerisch in der Presse kommentiert. Diese Reaktion ist teilweise darauf zurückzuführen, dass die Pflanze erhebliche gesundheitliche Risiken in sich birgt und bereits bloße Berührungen ernsthafte gesundheitliche Schädigungen nach sich ziehen können.
Neben gesundheitlichen Gefährdungen durch den Riesen-Bärenklau gibt es noch folgende:
Der vom Riesen-Bärenklau ausgehende ökologische Schaden wird im Vergleich mit anderen invasiven Neophyten wie beispielsweise der Späten Traubenkirsche oder der Gewöhnlichen Robinie eher überschätzt. Die breite öffentliche Wahrnehmung des Riesen-Bärenklaus als problematischer Neophyt resultiert auch aus seiner Auffälligkeit und aus den Risiken für die menschliche Gesundheit.
Seit 2017 ist die Art durch die Europäische Kommission in die Liste invasiver gebietsfremder Arten von unionsweiter Bedeutung aufgenommen, so dass jede Vermehrung, Freisetzung oder Beförderung in der Europäischen Union verboten ist und jeder Mitgliedstaat Maßnahmen zur Erkennung, Überwachung und Bekämpfung zu ergreifen hat[16]. In Deutschland sind entsprechende Maßnahmenpläne der zuständigen Behörden vorbereitet[17].
Bei den Bekämpfungsmaßnahmen wird zwischen großflächigen Beständen und Einzelpflanzen bzw. kleinflächigen Beständen unterschieden.[18] Großflächiger Riesen-Bärenklau-Bestand kann mit Herbiziden bekämpft werden, auf geeigneten Flächen auch durch mehrfaches Mähen und Mulchen, Fräsen oder durch das Beweiden mit Schafen und Ziegen.[19] Gern gefressen wird das Herkuleskraut von den Weidetieren allerdings nicht, sondern ähnlich wie im Falle Japanknöterich nur gezwungenermaßen, durch enges Einpferchen. Noch ungeklärt ist auch die Frage, ob nicht wie beim hochgiftigen Herbstzeitlosen-Kraut im Futter von Nutztieren auch hier ein relevanter Teil der Toxine in Milch und Fleisch übergehen kann. Die Bekämpfung erfolgt im niedrigen Bestand spätestens im April, wobei bei der Anwendung von Unkrautbekämpfungsmitteln ein Sachkundenachweis sowie eine naturschutzbehördliche Ausnahmegenehmigung erforderlich sein können. In den folgenden Jahren genügt eine Nachkontrolle, das Jäten aufkommender Keimlinge (anfangs rundblättrig!) und eventuell eine mechanische Bodenbearbeitung.
Zum Bekämpfen von Einzelpflanzen und kleinen Beständen im Vorfrühling und Frühling wirkt einfaches Abschneiden sofort, aber oft nicht nachhaltig. Sehr wirksam ist das Schneiden von Stängeln mittels Forstsense direkt über dem Boden und anschließendes Bestreichen der verbleibenden Spross-Stümpfe mit einer wirksamen Herbizid-Lösung. Durch Gegendruck sollte der Bekämpfer davor geschützt werden, dass die umstürzende Pflanze auf diesen fällt.
Da die adulte Pflanze vor dem Ausreifen der Früchte Reserven zur erneuten Blütenbildung besitzt, treibt sie später häufig nach und meist auch im Folgejahr wieder aus. Wenn Pflanzenexemplare nach Schnitten weitere ruhende Knospen im oberen Teil der Wurzel austreibt, hilft nachhaltig nur das Ausgraben bzw. Abstechen der Wurzel 15 Zentimeter unter der Oberfläche. Auch später im Jahr können weitere Jungpflanzen austreiben, sodass eine regelmäßige Nachkontrolle und bei Bedarf eine Bekämpfung bis September notwendig wird. Die Jungpflanzen mit rundlichen, ganzrandigen Blättern müssen auch in den folgenden Jahren jedes Mal beseitigt werden.
Guten Erfolg zeigt das Abschneiden und Entsorgen der Samenstände im Sommer. Das Abschneiden des Samenstandes sollte erfolgen, wenn die Mitteldolde bereits grüne (schwere) Früchte ausgebildet hat (etwa ab Mitte Juli), aber bevor die Früchte erste braune Streifen zeigen und auszufallen beginnen.[20] Die nicht samentragenden Nebendolden befinden sich zu dieser Zeit noch in voller Blüte und müssen abgeschlagen werden, um an Ort und Stelle zu vertrocknen. Die samentragenden Dolden reifen nach und werden daher vollständig entsorgt. Die Fruchtstände müssen unbedingt entfernt werden und dürfen nicht in den Kompost gelangen. Sie werden über den Restmüll entsorgt oder vor Ort verbrannt, beispielsweise mittels Langrohr-Gasbrenner.
Die Mutterpflanze kann stehen bleiben und stirbt schon vor dem folgenden Winter ab. Kindel werden nicht gebildet. Der Standort muss in den Jahren danach kontrolliert und das Abschneiden bei Bedarf jedes Mal wiederholt werden. Bei vorliegendem Sachkundenachweis können auch systemisch wirkende Herbizide auf die bodennahen Schnittflächen (Spross- und Blattstiel-Stümpfe) aufgetragen werden.
Zur Beseitigung selbst in kleinem Rahmen sind Handschuhe, Schutzkleidung, Schutzbrille und gegebenenfalls Atemschutz erforderlich. Als Vorsichtsmaßnahme sollte in hohen Beständen eine Astsäge oder -schere mit Teleskopstiel verwendet werden, um Verletzungen durch die oberflächlichen Toxine der stürzenden Pflanzen zu vermeiden. Arbeiten bei bedecktem Himmel und nur schwachem Wind ist empfehlenswert. Die örtliche Naturschutzbehörde erteilt Rat, sorgt für die Beseitigung auf öffentlichen Flächen und unterstützt in einigen Gemeinden auch in Privatgärten. Die Beseitigung sollte mit Vorsicht, Sorgfalt und Sachkunde erfolgen, sodass sichergestellt ist, dass es sich um Riesen-Bärenklau handelt und nicht versehentlich andere Pflanzen, z. B. Engelwurz,[21] zerstört werden.
In und auf der gesamten Pflanze (auch im Wurzelsystem) sind Furocumarine enthalten, die nach Hautkontakt bei anschließender Bestrahlung durch Sonnenlicht, also um mehrere Stunden oder Tage verzögert, phototoxische Reaktionen hervorrufen. Bei empfindlichen Menschen genügt bereits ein einfacher Kontakt mit der Oberfläche der Blätter. Die Reaktionen zeigen sich in Rötungen, Hautentzündungen, Reizungen und in schlimmen Fällen in einer blasenbildenden Dermatitis, die sich mit entzündlichen und schmerzhaften Blasenbildungen äußert. Diese können großflächig sein und Verbrennungen ersten bis zweiten Grades hervorrufen. Die Hautreizungen und Blasen können wochenlang anhaltende nässende Wunden verursachen und mit anhaltenden Pigmentveränderungen einhergehen. Auch Fieber, Schweißausbrüche und Kreislaufschocks können die Folge des Kontaktes mit der Pflanze sein.
Unter Umständen können Reaktionen auch wenige Tage später durch dann auf die betroffene Haut einstrahlendes Sonnenlicht ausgelöst werden. An heißen Tagen werden zudem die Furanocumarine von der Pflanze an die Umgebung abgegeben, und es kann bereits bei einem längeren Aufenthalt unmittelbar neben den Pflanzen zu den oben beschriebenen Erscheinungen oder auch zu Atemnot kommen. Ausgasende Furanocumarine können eine (bis zu drei Wochen anhaltende) akute Bronchitis verursachen.
Bei Arbeiten mit dem Rasentrimmer oder beim Abhacken der Pflanze kann der Pflanzensaft auch durch die Kleidung hindurch Auswirkungen hervorrufen.
Nach Kontakt mit Teilen der Pflanze sollte man Sonne meiden und die betroffenen Hautstellen mit Wasser und Seife, besser mit Spiritus abwaschen. Bei Hautreizungen sollte ein Hautarzt aufgesucht werden. Verwendete Arbeitsgeräte (Sense, Spaten) sollten mit in Spiritus getauchtem Zeitungspapier von oben nach unten abgerieben werden, das Papier danach verbrannt werden. Verwendete Gummihandschuhe sollte man umstülpen und nicht erneut verwenden. Dünne Einmalhandschuhe können von den Furanen innerhalb einer Stunde durchdrungen werden.
Der Riesen-Bärenklau ist in Europa eine verhältnismäßig junge Pflanze, die erst wenig Eingang in die Kulturgeschichte gefunden hat. Eine Ausnahme stellt das Lied The Return of the Giant Hogweed der Progressive-Rock-Band Genesis dar, das satirisch den Riesen-Bärenklau als ernsthafte Gefahr darstellt. So heißt es unter anderem „[…] turn and run, nothing can stop them, around every river and canal their power is growing […]“ (deutsch: „[…] kehr um und lauf, nichts kann sie aufhalten, an jedem Fluss und Kanal wächst ihre Macht […]“). Das Stück erschien 1971 auf dem Album Nursery Cryme.[22]
Im Kinderlied Geht der gute Mond auf seine Reise von Ute Rink wird stattdessen ein idyllisches Bild gezeichnet: „Im Riesenbärenklau / sitzt die Igelfrau / mit ihrem Igelmann – / die beiden schau'n sich zärtlich an.“[23] Im Roman Herr Yamashiro bevorzugt Kartoffeln von Christoph Peters hingegen hatte der Protagonist Ernst Liesegang "in der neusten, fünfundzwanzigbändigen Ausgabe von Meyers Enzyklopädischem Lexikon, die sein Vater vor kurzem angeschafft hatte, vergeblich nach einem Artikel über den Riesenbärenklau gesucht", und da "ihn die Geschwindigkeit, mit der aus der Sumpfkuhle hinter dem Haus seit Mitte Februar neue Blätter und Triebe wuchsen, zunehmend beunruhigt" hatte, beauftragte er mit dessen Entfernung einen pensionierten Experten der schwedischen Forstverwaltung, dem es "in seiner aktiven Zeit nicht gelungen war, die seit anderthalb Jahrzehnten zunehmend verheerende Ausbreitung von Herculeum giganteum in Schweden zu verhindern" und somit beschlossen hatte, "sich dieser Aufgabe von nationaler, ja europäischer Bedeutung über den Tag seiner Pensionierung hinaus zu verschreiben."[24]
Der Riesen-Bärenklau (Heracleum mantegazzianum Sommier & Levier, Syn.: Heracleum giganteum Hornem.), auch Bärenkralle, Herkulesstaude oder Herkuleskraut genannt, ist eine Pflanzenart aus der Gattung Bärenklau (Heracleum) innerhalb der Familie der Doldenblütler (Apiaceae). Sie ist eine zwei- bis mehrjährige, wenn unbeeinflusst einmalblühende (hapaxanthe) krautige Pflanze. Ursprünglich stammt sie aus dem Kaukasus und ist in Europa und Nordamerika ein invasiver Neophyt.
Der Riesen-Bärenklau bildet photosensibilisierende Substanzen aus der Gruppe der Furocumarine, die in Kombination mit Sonnenlicht oder auch stärkerem Lampenlicht phototoxisch wirken. Berührungen in Verbindung mit Tageslicht können bei Menschen und anderen Säugetieren zu schmerzhaften Quaddeln und Blasen führen, die schwer heilen und wie Verbrennungen erscheinen (Photodermatitis). Es wird deshalb empfohlen, beim Umgang mit der Pflanze vollständige Schutzkleidung zu tragen, zu der auch ein Gesichtsschutz gehört.
Der Riesen-Bärenklau wurde 2008 zur Giftpflanze des Jahres gewählt.
Gigantski svinjski korov'(Heracleum mantegazzianum, također poznat pod imenom gigantski kravlji peršun, engleski: Giant Hogweed, dan: Kæmpe Bjørneklo), je biljka iz porodice Apiaceae, porijeklom iz Kavkaza i središnje Azije. Ona može biti i do 2-5 metara (rijetko do 7 m) visoka. Osim veličine, sliči običnom svinjskom korovu (Heracleum sphondylium), Heracleum sosnowskyi ili vrtnoj anđeliki (Angelica archangelica). Fototoksična je i smatra se štetnim korovom u mnogim državama.
Odlikuje se dodatno debelom tamno crvenkasto-ljubičastom stabljikom i pjegavim stabljikama lista koje su šuplje i proizvode čvrste čekinje. Stabljika varira 3 do 8 cm u obimu, povremeno i do 10 cm. Stabljika pokazuje purpurno-crvene pigmentacije s podignutim čvorovima. Svaka ljubičasta mrlja na stabljici okružena je kosom, a tu su i velike krupne bijele dlake na bazi lista stabljike. Biljka ima duboko urezan spoj lišća koji rastu i do 1-1,7 m širine.
Gigantski svinjski korov je kratkotrajna višegodišnja biljka (u trajanju obično između 5-7 godina) s čvornatom žiličastom stabljikom koja oblikuje i daje pupoljke svake godine. Njegovo cvijeće je u svojoj završnoj godini od kasnog proljeća do sredine ljeta, s brojnim bijelim cvjetovima grupiranih u obliku glave kišobrana koja je do 80 cm (2,5 stope) u promjeru preko svojeg ravnog vrha. Biljka proizvodi 1.500 do 100.000 spljoštenih, 1 cm dugih, ovalnih suhih sjemenki koje imaju široko zaobljena bazu i široka marginalna grebena. Nakon što su sjemenke proizvele nove biljke, stare biljke umiru. Biljke u ranijim fazama rasta jenjavaju u jesen. Visoka mrtva stabla mogu označiti njihova mjesta tokom zime.
Mnoge strane biljke su uvedene u Englesku u 19. stoljeću, uglavnom za ukrasne razloge. Nekoliko njih su postale dominantno agresivne i stvaraju ozbiljne probleme u nekim područjima. Sada je široko rasprostranjena po cijelom Britanskom otoku naročito duž riječnih obala. Po formiranju guste sastojine mogu micati biljke i biljni i životinjski svijet te smanjiti njihov interes. Također se proširio u sjeveroistočnoj i sjeverozapadnoj Americi i središnjoj i istočnoj Kanadi. To je jednako opasna invazivna vrsta u Njemačkoj, Francuskoj i Belgiji, ugrožavajući lokalne vrste biljaka. Uveden je u Francuskoj u 19. stoljeću od strane botaničara a mnogo je cijenjen od strane pčelara.
Gigantski svinjski korov je fototoksička biljka. Njegov sok može uzrokovati fitofotodermatitis (tešku upalu kože), kada je koža izložena suncu ili UV-zrakama. U početku je koža crvena i počinje svrbež. Tada se stvaraju mjehurići u obliku opekotine u roku od 48 sati. Oni formiraju crne ili purpurne ožiljke koji mogu trajati nekoliko godina. Ležanje u bolnici može biti potrebno. Prisutnost i najmanje količine biljnog soka u očima može dovesti do privremenog ili čak i trajnog sljepila. [1] Te su reakcije uzrokovane prisutnošću linearnog derivata furocoumarina u svom lišću, korijenju, stabljikama, cvjetovima i sjemenu. Ove hemikalije mogu ući u jezgru epitelnih ćelija, formirajući veze s DNK, što uzrokuje da ćelije umru. Smeđa boja je uzrokovana proizvodnjom melanina iz furocoumarin. U Njemačkoj, gdje je biljka postala prava smetnja, bilo je oko 16.000 žrtava u 2003. godini.
Djecu treba držati podalje od gigantskog svinjskog korova. Zaštitnu odjeću, uključujući i zaštitu za oči, treba nositi prilikom rukovanjem ili iskopavanjem biljke. Ako je koža izložena, ugroženo područje treba temeljito oprati sapunom i vodom, a izloženu kožu zaštititi od sunca na nekoliko dana.
Američki USDA Forest Service navodi da svinje i goveda mogu jesti gigantski svinjski korov bez prividnog zla.
Eksperimenti su pokazali da ovce vole jesti svinjski korov te se stoga koriste u borbi.
Zbog svoje fototoksičnosti i invazivne prirode, gigantski svinjski korov često se aktivno uklanja. U Velikoj Britaniji po zakonu Divljih vrsta i Zavičajnih Zakona 1981 (Wildlife and Countryside Act 1981) se čini kazneno djelo za sadnju ili uzrokovanje rasta gigantskog svinjskog korova u divljini. [2]
To je također česta biljka na močvarnim područjima Irske, iako opseg njegove opasnosti obično nije poznat tamo.
Svinjski korov je reguliran kao federalni štetni korov od strane vlade SAD-a, te ga je stoga ilegalno uvesti u Sjedinjene Države ili premjestiti međudržavno bez dozvole iz Ministarstva poljoprivrede. [3]
Gigantski svinjski korov se može suzbiti:
• Ubadanjem korijena / iskopavanjem
• Odsijecanjem cvijetova (biljka može ostaviti nekoliko hiljada sjemenki)
• Košenjem
• Preuređenjem zemljišta
• Ispašom
• Špricanjem
• Tekućim dušikom
Gigantski svinjski korov'(Heracleum mantegazzianum, također poznat pod imenom gigantski kravlji peršun, engleski: Giant Hogweed, dan: Kæmpe Bjørneklo), je biljka iz porodice Apiaceae, porijeklom iz Kavkaza i središnje Azije. Ona može biti i do 2-5 metara (rijetko do 7 m) visoka. Osim veličine, sliči običnom svinjskom korovu (Heracleum sphondylium), Heracleum sosnowskyi ili vrtnoj anđeliki (Angelica archangelica). Fototoksična je i smatra se štetnim korovom u mnogim državama.
Odlikuje se dodatno debelom tamno crvenkasto-ljubičastom stabljikom i pjegavim stabljikama lista koje su šuplje i proizvode čvrste čekinje. Stabljika varira 3 do 8 cm u obimu, povremeno i do 10 cm. Stabljika pokazuje purpurno-crvene pigmentacije s podignutim čvorovima. Svaka ljubičasta mrlja na stabljici okružena je kosom, a tu su i velike krupne bijele dlake na bazi lista stabljike. Biljka ima duboko urezan spoj lišća koji rastu i do 1-1,7 m širine.
Gigantski svinjski korov je kratkotrajna višegodišnja biljka (u trajanju obično između 5-7 godina) s čvornatom žiličastom stabljikom koja oblikuje i daje pupoljke svake godine. Njegovo cvijeće je u svojoj završnoj godini od kasnog proljeća do sredine ljeta, s brojnim bijelim cvjetovima grupiranih u obliku glave kišobrana koja je do 80 cm (2,5 stope) u promjeru preko svojeg ravnog vrha. Biljka proizvodi 1.500 do 100.000 spljoštenih, 1 cm dugih, ovalnih suhih sjemenki koje imaju široko zaobljena bazu i široka marginalna grebena. Nakon što su sjemenke proizvele nove biljke, stare biljke umiru. Biljke u ranijim fazama rasta jenjavaju u jesen. Visoka mrtva stabla mogu označiti njihova mjesta tokom zime.
Mnoge strane biljke su uvedene u Englesku u 19. stoljeću, uglavnom za ukrasne razloge. Nekoliko njih su postale dominantno agresivne i stvaraju ozbiljne probleme u nekim područjima. Sada je široko rasprostranjena po cijelom Britanskom otoku naročito duž riječnih obala. Po formiranju guste sastojine mogu micati biljke i biljni i životinjski svijet te smanjiti njihov interes. Također se proširio u sjeveroistočnoj i sjeverozapadnoj Americi i središnjoj i istočnoj Kanadi. To je jednako opasna invazivna vrsta u Njemačkoj, Francuskoj i Belgiji, ugrožavajući lokalne vrste biljaka. Uveden je u Francuskoj u 19. stoljeću od strane botaničara a mnogo je cijenjen od strane pčelara.
Is e odharan mòr a theirear ri Heracleum mantegazzianum a tha na lus san teaghlach Apiaceae. Bidh e a' fàs mar as trice cho àrd ri 2 - 5.5 meatair (6 troigh 7 òirleach - 18 troigh 1 òirleach). Air a choltas, tha suaip aig an odharan mhòr ris an odharan (Heracleum sphondylium), ri Heracleum sosnowskyi no ri Angelica archangelica. Buinidh an t-odharan mòr don cheàrn Chabhcasach agus do mheadhan na h-Àisia, ach chaidh a thoirt a-steach do Bhreatann mar lus òrnaideach san 19mh linn.
Tha snodhach an odharain mhòir a' losgadh craiceann dhaoine agus ag adhbharachadh builgeanan, eàrran buan, agus doille - ma thig e an lùib nan sùilean.
Ainmean Gàidhlig Lusan, Joan W. Clark and Ian MacDonald, 1999
Is e odharan mòr a theirear ri Heracleum mantegazzianum a tha na lus san teaghlach Apiaceae. Bidh e a' fàs mar as trice cho àrd ri 2 - 5.5 meatair (6 troigh 7 òirleach - 18 troigh 1 òirleach). Air a choltas, tha suaip aig an odharan mhòr ris an odharan (Heracleum sphondylium), ri Heracleum sosnowskyi no ri Angelica archangelica. Buinidh an t-odharan mòr don cheàrn Chabhcasach agus do mheadhan na h-Àisia, ach chaidh a thoirt a-steach do Bhreatann mar lus òrnaideach san 19mh linn.
Tha snodhach an odharain mhòir a' losgadh craiceann dhaoine agus ag adhbharachadh builgeanan, eàrran buan, agus doille - ma thig e an lùib nan sùilean.
Li paxhnåde do Cocaze u adjeyante paxhnåde, c' est come ene grande paxhnåde ki pout crexhe 3 metes hôt.
No d' l' indje e sincieus latén : Heracleum mantegazzianum
C' est ene plante ki s' kisseme foirt åjheymçint. Gn a disk' a 100.000 grinnes so tchaeke pî. Cwand ele vént foirt sipesse, ele sitofe les ôtes plantes.
Ele n' a pont d' maladeyes ni d' formagnants.
Elle a stî apoirtêye e l' Mîtrinne Urope, pu e l' Urope coûtchantrece, a pårti des pays do Cocaze (si birce biyolodjike) come fleur di djårdén.
El Walonreye, elle est rwaiteye come ene evayixhante indje.
Elle åreut vnou el Beldjike del Swisse dins les anêyes 1930. On nd a bråmint cåzé e 2007, pask' end aveut yeu dipus k' i n' faleut dins les teréns del comene d' Oû-Djåce.
Si on toutche li seuve del plante, tot l' råyant, metans, et k' on va å solea dins les djoûs ki shuvèt, on pout atraper do fotosinsiûlijhaedje.
Come c' est ene plante ki va discone li biyovaryîsté. C' est po ça k' elle a stî markêye so ene noere lisse di riskeusès plantes vinowe d' ôte pårt.
Ele edure bråmint des touwe-crouwås.
Ele fåt råyî cwand elle est co tote pitite, tot metans des wants et des berikes po s' waeranti des spitaedje di s' seuve.
Li paxhnåde do Cocaze u adjeyante paxhnåde, c' est come ene grande paxhnåde ki pout crexhe 3 metes hôt.
No d' l' indje e sincieus latén : Heracleum mantegazzianum
D'Risebiereklo[1] (Heracleum mantegazzianum Somm. & Lev.) ass eng zwee- bis méijähreg Planz aus der Famill vun den Doldenblütler (Apiaceae). Se kënnt ursprénglech aus dem Kaukasus an ass an Europa an Nordamerika en etabléierten Neophyt.
D'Risebiereklo ka fir de Mënsch geféierlech ginn. Duerch eng Beréierung vun der Planz gëtt d'Haut fir zirka 2,5 Stonnen staark photosensibiliséiert duerch Furanocumarinen, déi an allen Deeler vun der Planz ze fanne sinn. Wann d'Haut der Sonn oder eng aner ultravioletter Stralungsquell ausgesat ass, kann dat zu schwéiere Verbrennunge féieren (bis zum 2. Grad), déi ënner Ëmstänn nëmme ganz lues heelen.
D'Risebiereklo ass zu Lëtzebuerg invasiv an an alle Regioune verbreet, virun allem laanscht d'Flëss, an ass a voller Expansioun.[2] D'Aart gouf 1935 fir d'éischt vum Edmond Joseph Klein a sengem Virgäertchen um Boulevard Grande-Duchesse Charlotte an der Stad als botanesch Kuriositéit gezillt.[3]
D'Aart gëllt als exzellent Beieweed a gëtt dowéinst dacks vu lëtzebuergesche Beienziichter ausgeséit, obwuel et gesetzlech verbueden ass, zur Ausbreedung vu friemen Aarten an der Gréngzon beizedroen.
D'Risebiereklo (Heracleum mantegazzianum Somm. & Lev.) ass eng zwee- bis méijähreg Planz aus der Famill vun den Doldenblütler (Apiaceae). Se kënnt ursprénglech aus dem Kaukasus an ass an Europa an Nordamerika en etabléierten Neophyt.
Хуырзæнк[1] кæнæ билбатыхъ[2], дыгуронау билбатук кæнæ билбатуг (лат. Heracleum mantegazzianum, уырыс. Борщевик Мантегацци) у сæнчы хуыз.
Хуырзæнк кæнæ билбатыхъ, дыгуронау билбатук кæнæ билбатуг (лат. Heracleum mantegazzianum, уырыс. Борщевик Мантегацци) у сæнчы хуыз.
Heracleum mantegazzianum, commonly known as giant hogweed,[2][3][4][5] is a monocarpic perennial herbaceous plant in the carrot family Apiaceae. H. mantegazzianum is also known as cartwheel-flower,[3][4][5] giant cow parsley,[6] giant cow parsnip,[7] or hogsbane. In New Zealand, it is also sometimes called wild parsnip (not to be confused with Pastinaca sativa) or wild rhubarb.[4]
Giant hogweed is native to the western Caucasus region of Eurasia. It was introduced to Britain as an ornamental plant in the 19th century, and has also spread to other areas in Western Europe, the United States, and Canada.[2] Its close relatives, Sosnowsky's hogweed and Persian hogweed, have similarly spread to other parts of Europe.
The sap of giant hogweed is phototoxic and causes phytophotodermatitis in humans, resulting in blisters and scars. These serious reactions are due to the furanocoumarin derivatives in the leaves, roots, stems, flowers, and seeds of the plant. Consequently, it is considered to be a noxious weed in many jurisdictions.[2]
The species name mantegazzianum refers to Paolo Mantegazza (1831–1910), Italian traveller and anthropologist.[8]
Giant hogweed typically grows to heights of 2 to 5 m (6 ft 7 in to 16 ft 5 in).[2] Under ideal conditions, a plant can reach a height of 5.5 m (18 ft 1 in).[9][10] The leaves are incised and deeply lobed. A mature plant has huge leaves, between 1–1.5 m (3 ft 3 in – 4 ft 11 in) wide,[11] and a stout, bright green stem with extensive dark reddish-purple splotches and prominent coarse white hairs, especially at the base of the leaf stalk. Hollow, ridged stems vary from 3–8 cm (1–3 in) in diameter, occasionally up to 10 cm (4 in) in diameter and can grow to more than 4 m (13 ft) high. Dark red spots on the stem each surround a single hair.[12] The umbrella-shaped inflorescence, called a compound umbel, may be up to 100 cm (3 ft 3 in) in diameter across its flat top. The flowers are white or greenish white and may be radially symmetrical or strongly bilaterally symmetrical (zygomorphic).[10] The fruits are schizocarps, producing seeds in dry, flattened, oval pairs.[10]: 825 Each seed is approximately 1 cm (1⁄2 in) in length, with a broadly rounded base and broad marginal ridges, tan in color with brown lines (so-called oil tubes) extending 3⁄4 of the length of the seed.
The life cycle of giant hogweed consists of four phases:[13]
During the first few years of growth, the leaves and stem of a pre-flowering plant die over the winter. In the spring, the plant grows back from its root. In other words, the giant hogweed is a herbaceous perennial.
A giant hogweed plant usually produces a flowering stalk in 3–5 years,[2][14] but plants may take up to eight years to flower if conditions are unfavorable. In the Czech Republic, a single plant reached twelve years old before flowering.[15] In any case, when the plant finally flowers, it does so between June and July (in the northern hemisphere).
Seeds are typically produced in August. A single flowering plant will produce 20,000 seeds on average[16][14] with seed production varying between 10,000 and 50,000 seeds per plant.[15]
Giant hogweed is a monocarpic perennial,[14][9][10] that is, after a mature plant flowers and produces seed, the entire plant dies. During the following winter, tall dead stems mark the locations where the flowering plants once stood.
The seeds are dispersed short distances by wind, but can travel longer distances by water, animals, and people. Most seeds (95%) are found in the top 5 cm (2 in) of the soil within a few meters of the parent plant. Seeds may stay alive in the seed bank for more than five years.[15][16]
A seed deposited in the seed bank is initially dormant. Dormancy is broken by the cold and wet conditions of fall and winter, and so freshly deposited seeds lie dormant until at least the following spring, at which time approximately 90% of the previously dormant seeds will germinate.[14][9] The rest remain dormant in the seed bank.
Seeds normally result from cross-pollination between two or more plants but self-pollination is also possible. More than half the seeds produced by self-pollination will germinate and give rise to healthy seedlings.[14] Hence a single isolated seed may give rise to a colony of new plants.
The various species of the genus Heracleum are similar in appearance, but vary in size.[9] H. mantegazzianum is among the tallest, typically reaching 4 m (13 ft) high (and sometimes more than 5 m or 16 ft high), whereas Heracleum species native to Western Europe, such as ordinary Hogweed (H sphondlylium), or North America, such as the cow parsnip (H. maximum), rarely exceed 3 m (10 ft) high.[9][11][14] There are considerable differences in the size of the umbel, leaves, and stem of H. mantegazzianum as well.
The following table compares Heracleum mantegazzianum and Heracleum maximum feature by feature:
Other plant species in the family Apiaceae have features somewhat similar to those of the giant hogweed (H. mantegazzianum). Examples:
Many more species exist; in Europe, over 20 species are found of the genus Heracleum alone.[14]
None of these reach a similar size, but many are phototoxic.
Some other species, such as the abovementioned Heracleum sosnowskyi and Heracleum persicum, do reach similar sizes, and are equally noxious as a result.
Heracleum mantegazzianum is native to the western Caucasus region of Eurasia.[2] Because of its impressive size, giant hogweed was brought to Europe and North America as an ornamental plant and garden curiosity.
The following historical information[14][17][18][15] grew out of the European Giant Alien Project, which began in 2005.
Heracleum mantegazzianum was first described in scientific literature in 1895 but by that time more than a dozen European countries had already imported the plant as an "ornamental curiosity". The introduction of Heracleum mantegazzianum was first recorded in Great Britain in 1817 when it was put on the seed list at the Kew Botanic Gardens in London. By 1828, the first natural population was recorded, growing wild in Cambridgeshire, England.
The spread of Heracleum mantegazzianum throughout Europe continued unabated until the middle of the 20th century, at which time the dangers of giant hogweed had become more widely known. Despite the warnings, however, the plant continued to be used by gardeners, beekeepers, and farmers (for cattle fodder) for another 50 years. Heracleum mantegazzianum was finally de-listed by the Royal Horticultural Society of Great Britain in 2002.
During the 20th century, giant hogweed was transported to the United States and Canada for display in arboreta and Victorian gardens. The earliest recorded planting in North America was in 1917, in gardens near Highland Park in the city of Rochester, New York.
By 1950, giant hogweed had appeared in southern Ontario, and within a quarter century, the plant was firmly established in Ontario. It was first collected from Nova Scotia in 1980 and Quebec in 1990. Giant hogweed was still available for sale in Canadian nurseries as late as 2005.
On the west coast of North America, Heracleum mantegazzianum appeared in Oregon, Washington, and southwestern Canada but it is not clear how the species found its way into this region. First reports of giant hogweed in British Columbia were published in the 1930s.
Giant hogweed is native to Russia and was further distributed during the late 1960s, later spreading extensively on its own throughout Russia and eastern Europe.[2]
Giant hogweed is widespread throughout western and northern Europe, especially along terrains such as coastal areas and riverbanks.[2] By forming dense stands, it can displace native plants and reduce wildlife habitats.[2][19] It has spread in the northeastern and northwestern United States, and southern Canada and is an invasive species across western Europe;[2] in sites where it has settled, it overtakes the local native species, Heracleum sphondylium.[19]
In Canada, the plant occurs in most provinces, except in the prairies.[2] It has been seen in Quebec since the early 1990s.[20] The plant's spread in Ontario began in the southwest and was seen in 2010 in the Greater Toronto Area and Renfrew County near Ottawa.[21]
In the United States, giant hogweed occurs in Maine, Wisconsin and south to Indiana, Michigan, Maryland, and New Jersey.[22][15][23] In June 2018, it was reported growing in Virginia and North Carolina.[24][25] The plant is federally listed as a noxious weed in the US.[22]
Giant hogweed is widespread in Russia and the Baltic states, and present in eastern Europe.[2]
The sap of the giant hogweed plant is phototoxic. Contact with the plant sap prevents the skin from being able to protect itself from sunlight, which leads to phytophotodermatitis, a serious skin inflammation.[26] A phototoxic reaction can begin as soon as 15 minutes after contact with the sap. Photosensitivity peaks between 30 minutes and two hours after contact but can last for several days.[14][9] Authorities advise that all humans (especially children) should stay away from giant hogweed.[27][28][29] Protective clothing, including eye protection, should be worn when handling the plant. Parts of the body that come into contact with the sap of giant hogweed should be immediately washed with soap and cold water, and further exposure to sunlight should be avoided for at least 48 hours.[14][19][26] Other Heracleum species, such as the cow parsnip (Heracleum maximum), are likewise phototoxic, and hence similar caution is advised. Owing to physical similarities to Queen Anne's lace, giant hogweed and its relatives are sometimes mistaken as harmless plants.[30]
Because of its phototoxicity and invasive nature, giant hogweed is often actively removed. The European Union funded the Giant Alien project to combat the plant.[31][32][33] On August 2, 2017, it added the species to its List of Invasive Alien Species of Union concern,[34] thus placing restrictions on keeping, importing, selling, breeding and growing it and requiring governments to detect and eradicate it throughout the EU. In the United Kingdom, the Wildlife and Countryside Act 1981 makes it an offence to plant or cause giant hogweed to grow in the wild.[19][35]
In the United States, hogweed is regulated as a federal noxious weed by the U.S. government, and is illegal to import into the United States or move interstate without a permit from the Department of Agriculture.[36] The USDA Forest Service states pigs and cattle can eat it without apparent harm.[37] The New York State Department of Environmental Conservation has had an active program to control giant hogweed since 2008.[38] In 2011, Maine state horticulturists, describing the plant as "Queen Anne's lace on steroids", reported that it has been found at 21 different locations in Maine, with the number of plants ranging from one to a hundred.[39]
The 1971 album Nursery Cryme by the progressive rock group Genesis contains a song called 'The Return of the Giant Hogweed'. The darkly-humorous lyrics[40] describe an attack on the human race by Heracleum mantegazzianum, long after the plant was first 'captured' and brought to England by a Victorian explorer.
In Season 10 Episode 3 "Ghosts" (first aired October 20, 2019) of the AMC television series The Walking Dead, the character Aaron is attacked by "walkers" that have hogweed flowers growing from their decomposing bodies. Aaron comes into close contact with the hogweed, rendering him unable to properly see, and more susceptible to harm.[41]
In her 1985 novel "Curse of the Giant Hogweed", popular mystery author Charlotte MacLeod places her established character Peter Shandy and his colleagues in a fantasy version of Wales to investigate Giant Hogweed endangering Britain's hedgerows.[42]
{{cite journal}}: CS1 maint: multiple names: authors list (link) Heracleum mantegazzianum, commonly known as giant hogweed, is a monocarpic perennial herbaceous plant in the carrot family Apiaceae. H. mantegazzianum is also known as cartwheel-flower, giant cow parsley, giant cow parsnip, or hogsbane. In New Zealand, it is also sometimes called wild parsnip (not to be confused with Pastinaca sativa) or wild rhubarb.
Giant hogweed is native to the western Caucasus region of Eurasia. It was introduced to Britain as an ornamental plant in the 19th century, and has also spread to other areas in Western Europe, the United States, and Canada. Its close relatives, Sosnowsky's hogweed and Persian hogweed, have similarly spread to other parts of Europe.
The sap of giant hogweed is phototoxic and causes phytophotodermatitis in humans, resulting in blisters and scars. These serious reactions are due to the furanocoumarin derivatives in the leaves, roots, stems, flowers, and seeds of the plant. Consequently, it is considered to be a noxious weed in many jurisdictions.
Heracleum mantegazzianum es una megaforbia (hierba gigante) miembro de la familia Apiaceae nativo de la región del Cáucaso y Asia central.
Se distingue por su tamaño, pues alcanza 2 a 4 m de altura. Con excepción de su tamaño es semejante al Heracleum sosnowskyi y Angelica archangelica. Se distingue por sus tallos huecos que alcanzan los 3-10 cm de diámetro. Florece a finales del verano y produce semillas secas, elípticas, aplanadas y muy numerosas (entre 1.500-100.000).
Potencialmente fototóxica, produce severas urticarias y decoloraciones de la piel cuando, tras haber tomado contacto con sus vellosidades, los rayos ultravioletas del Sol inciden sobre la misma. A estas urticarias se agregan ampollas de agua similares a quemaduras, las mismas pueden aparecer dentro de las primeras 48 horas con un color rojizo.
En caso de contacto no trate de curarse usted mismo, contacte a su médico, explique claramente que se trata de esta planta, evite completamente el contacto con el sol en las heridas.
Es considerada una especie invasora en Estados Unidos, Alemania, Inglaterra, España, Francia, Noruega, Estonia, Bélgica e Irlanda.
Debido a su potencial colonizador y constituir una amenaza grave para las especies autóctonas, los hábitats o los ecosistemas, esta especie ha sido incluida en el Catálogo Español de Especies Exóticas Invasoras, regulado por el Real Decreto 630/2013, de 2 de agosto, estando prohibida en España su introducción en el medio natural, posesión, transporte, tráfico y comercio.[1]
Algunas tribus de América del Norte consumen los tallos tiernos de la planta pelados y hervidos.
Heracleum mantegazzianum fue descrita por Sommier & Levier y publicado en Nuovo Giornale Botanico Italiano, n.s. 2(2): 79–81. 1895.[2]
Heracleum mantegazzianum es una megaforbia (hierba gigante) miembro de la familia Apiaceae nativo de la región del Cáucaso y Asia central.
Hiid-karuputk (Heracleum mantegazzianum) on sarikaliste sugukonda kuuluv õistaim.
Hiid-karuputk on Euroopa suurim sarikaline. Ta on kiire kasvuga ning võib kasvada kuni 7 meetri kõrguseks[viide?]; enamasti on taime kõrgus siiski 3...5 meetrit. Eestis on hiid-karuputk naturaliseerunud võõrliik, mis toodi Kaukaasiast silo- ja meetaimena koos Sosnovski karuputkega, ning on praeguseks laialt levinud.
Taim kasvab peamiselt jõgede ja ojade kallastel ning söötis maadel.
Putke varred võivad kasvada kuni 10 cm jämeduseks. Lehed on sügavalt 3...5-hõlmalised; lehe laius ulatub tihti üle ühe meetri. Hiid-karuputk õitseb juulist septembrini. Sarika läbimõõt on 50...80 cm.
Hiid-karuputke mahl sisaldab fototoksiini. Kui see satub nahale ning seejärel päikese kätte, tekib äge nahapõletik.
Hiid-karuputke leidub Eestis hajusalt[1].
Hiid-karuputk (Heracleum mantegazzianum) on sarikaliste sugukonda kuuluv õistaim.
Hiid-karuputk on Euroopa suurim sarikaline. Ta on kiire kasvuga ning võib kasvada kuni 7 meetri kõrguseks[viide?]; enamasti on taime kõrgus siiski 3...5 meetrit. Eestis on hiid-karuputk naturaliseerunud võõrliik, mis toodi Kaukaasiast silo- ja meetaimena koos Sosnovski karuputkega, ning on praeguseks laialt levinud.
Taim kasvab peamiselt jõgede ja ojade kallastel ning söötis maadel.
Putke varred võivad kasvada kuni 10 cm jämeduseks. Lehed on sügavalt 3...5-hõlmalised; lehe laius ulatub tihti üle ühe meetri. Hiid-karuputk õitseb juulist septembrini. Sarika läbimõõt on 50...80 cm.
Hiid-karuputke mahl sisaldab fototoksiini. Kui see satub nahale ning seejärel päikese kätte, tekib äge nahapõletik.
Hiid-karuputke leidub Eestis hajusalt.
Kaukasianjättiputki (Heracleum mantegazzianum)[3] on sarjakukkaiskasvien (Apiaceae) heimoon kuuluva suurikokoinen myrkyllinen kasvi, jonka nesteet aiheuttavat esimerkiksi iho- tai silmäkosketuksessa vakaviakin palovammamaisia kudosvaurioita. Se voi kasvaa jopa kuusi metriä korkeaksi. Laji kasvaa luonnonvaraisena Aasiassa, mutta se on levinnyt vieraslajina Eurooppaan ja Amerikkaan.[4] Suomessa lajin levittäminen pihojen ulkopuolelle on lailla kielletty.[5]
Kaukasianjättiputki on yleensä noin 1,5–3 metriä korkea ruoho. Kaukasianjättiputken varsi on ontto ja hyvinkin paksu, paksuus voi olla jopa 5–10 senttimetriä. Varressa on myös karheita karvoja ja punaisia laikkuja.[6]
Kaukasianjättiputken kukinto on hyvin suurikokoinen, jopa 15–25 senttimetriä leveä kerrannaissarja,[7] jossa pikkusarjoja voi olla jopa 50–100. Kukka on valkoinen ja 1–2,5 senttimetriä leveä. Kukassa on viisi hedettä ja emiö on yhdislehtinen ja kaksiluottinen. Pääsarjojen suojuslehdet varisevat aikaisin, mutta pikkusarjojen suojuslehdet ovat pysyviä. Kukasta kypsyvä hedelmä on noin yhden senttimetrin mittainen, soikea ja kaksilohkoinen. Yksi kasvi voi tuottaa kerralla jopa 50 000 siementä. Kaukasianjättiputken kukkiminen ajoittuu elo–syyskuulle.[6]
Kaukasianjättiputken ruodilliset lehdet ovat suuria: lehtilapa voi olla jopa yhden metrin mittainen. Lehdet ovat päältä kaljuja, mutta niiden alapinnalla voi olla tiheästikin karvoja.[6]
Kaukasianjättiputki on lyhytikäinen kasvi, sillä sen elinikä on yleensä vain noin kaksi vuotta. Kaukasianjättiputki kukkii vain kerran ja kuolee kukittuaan. Kasvi on kuitenkin hyvin lisääntymiskykyinen, koska yksi yksilö voi tuottaa jopa 50 000 siementä. Siemenet säilyvät hyvin maan alla ja muodostavat erittäin herkästi kasvustoja, jos siemenistä itää edes pieni osa.[6]
Jättiputket ovat hyvin kilpailukykyisiä ja niitä esiintyy monenlaisille kasvupaikoilla, kuten metsissä, pelloilla ja rannoilla. Jättiputken parhailla kasvupaikoilla syntyy ns. jättiputkimetsiä, joiden alueelta jättiputket tukahduttavat kaiken muun kasvillisuuden. Etenkin vesistön varrella jättiputkella on hyvät mahdollisuudet levitä eteenpäin, koska vesi kuljettaa jättiputken siemeniä helposti uusille kasvupaikoille.[8]
Kaukasianjättiputkea käyttävät ravinnokseen ainakin seuraavat lajit: koiranputkilattakoi (Agonopterix heracliana), Cavariella theobaldi, Depressaria pastinacella, Euleia heraclei, isokuonokärsäkäs (Liophloeus tessulatus), putkikärsäkäs (Lixus iridis), Melanagromyza heracleana, Nastus fausti, koiranputkilude (Orthops basalis), Phaedon tumidulus ja porkkanakärpänen (Psila rosae).
Kaukasianjättiputkella on myös sukulaislaji persianjättiputki (H. persicum syn. H. laciniatum), joka on noin kaukasianjättiputken mittainen, hieman pienempi, mutta useammin monivuotinen ja myös monivartinen. Persianjättiputken varsi on myös tasaisen punaruskea, kun taas kaukasianjättiputken varsi on laikukkaan punainen.[6]
Suomeen uhkaa levitä myös kolmas jättiputkilaji, armenianjättiputki (H. sosnowskyi).[9] Tätä lajia esiintyy mm. Karjalassa ja Baltian maissa, ja sen leviäminen Suomeen tulisi estää.[7]
Luonnonvaraisena jättiputket kasvavat Länsi-Kaukasuksen vuoristoissa.[6]
Kaukasianjättiputki on myrkyllinen ja tuottaa furanokumariineihin kuuluvia yhdisteitä, joista pääasiallinen on angelisiini, ja joita löytyy kaikista kasvin osista, mutta erityisesti lehdistä.[10] Jos kasvin nesteitä joutuu silmiin, voivat ne aiheuttaa jopa sokeuden, ja hengitettynä henkeä uhkaavan hengitysteiden umpeen turpoamisen. Iholla aineet aiheuttavat punertavuutta ja tulehdusta. Vesi ja erityisesti UVA-valo (kuten Auringon valo) voimistavat oireita ja näihin yhdistettyinä laaja altistus voi aiheuttaa vakavia palovammoja muistuttavia haavoja, jotka usein vaativat sairaalahoitoa ja voivat johtaa pysyviin arpiin altistuneilla alueilla.[11] Aineiden valon vaikutuksesta aiheuttamaa ihovauriota kutsutaan fytofotodermatiitiksi.[12]
Välittömät oireet alkavat 15 minuutin kuluttua altistuksesta ja ovat voimakkaimmillaan 30–60 minuutin kuluttua. 1 päivän kuluttua iho alkaa punertaa ja siihen kertyy turvottavia nesteitä.[13] Nämä jälkioireet ovat 2 päivän kuluttua pahimmillaan[11] ja 3–5 päivän jälkeen voi ilmetä altistusalueen ihon tummentumista (hyperpigmentaatiota). Alue pysyy tummana jopa kuukausia tai 6 vuotta.[4] Alue voi olla altistuksen jälkeen vuosienkin ajan yliherkkä UV-valolle[13] ja alueelle voi olla suurentunut riski saada myöhemmin syöpä.[10]
Kaukasianjättiputki tuotiin Eurooppaan koristekasvina jo 1800-luvulla, mutta sen torjuminen aloitettiin vasta vähän aikaa sitten. Koska kaukasianjättiputki muodostaa tiheitä kasvustoja, sen hävittäminen Euroopasta ei ole välttämättä enää mahdollista.[14] Kasvi on kaksivuotinen, kerran kukkiva ja sen siemenet voivat säilyä maassa jopa yli 10 vuotta.[15] Siksi sen hävittäminen on hankalaa. Kasvin torjunta on helpointa aloittaa heti nuorista kasvustoista. Suomessa luonnonsuojelulain 43 §:n mukaan jättiputkea ei saa levittää luontoon.[5]
Hävittäminen kannattaa tehdä käyttäen vähintään silmä- ja hengityssuojia[6] sekä hanskoja, ja mieluiten pilvisenä päivänä jolloin maanpinnalle saapuva Auringon valo on heikompi.[15] Kaikkein herkimmät ihmiset saattavat saada oireita jopa jättiputken voimakkaasta hajusta.[6] Lehdet ja varret voi kompostoida. Juurakot ja kukinnot tulee polttaa tai toimittaa jätesäkeissä sekajätekeräykseen poltettavaksi. Niitä ei pidä laittaa kompostiin, puutarhajätteen keräykseen tai jättää luontoon leviämisriskin takia.[16]
Niittäminen ei tapa jättiputkea, mutta toistuva niitto vähentää sen kasvua eikä kasvi pääse tuottamaan siemeniä. Kasvi voidaan myös kitkeä katkaisemalla sen pääjuuri maanpinnan alapuolelta. Leviämistä voi estää katkaisemalla kukinnon ennen siementen valmistumista ja huolehtimalla siitä etteivät kukinto ja siemenet pääse maahan. Torjuntaa voi tehdä myös torjunta-aineella kasvin vihreille lehdille. Tuloksekkainta torjunta-aineen käyttö on matalaan kasvustoon. Tarvittaessa kasvuston voi ensin niittää ja sitten käyttää torjunta-ainetta. Parhaimman tehon torjunta-aineella saa kun se ruiskutetaan kasvin lehdille.[5]
Kaukasianjättiputki (Heracleum mantegazzianum) on sarjakukkaiskasvien (Apiaceae) heimoon kuuluva suurikokoinen myrkyllinen kasvi, jonka nesteet aiheuttavat esimerkiksi iho- tai silmäkosketuksessa vakaviakin palovammamaisia kudosvaurioita. Se voi kasvaa jopa kuusi metriä korkeaksi. Laji kasvaa luonnonvaraisena Aasiassa, mutta se on levinnyt vieraslajina Eurooppaan ja Amerikkaan. Suomessa lajin levittäminen pihojen ulkopuolelle on lailla kielletty.
Heracleum mantegazzianum
La Berce du Caucase ou Berce de Mantegazzi (Heracleum mantegazzianum), est une espèce de plantes herbacées de la famille des Apiaceae. La sève de cette Berce est phototoxique. De plus, cette espèce est considérée en Europe et en Amérique du Nord (particulièrement au Québec) comme invasive.
Le nom botanique du genre, Heracleum, est dédié au héros Hercule, par allusion au port robuste de la Berce. L'épithète spécifique mantegazzianum est donnée à cette plante par les botanistes Sommier et Levier en 1895, en hommage à Paolo Mantegazza, anthropologue et explorateur italien[1].
Cette Berce a été « découverte » en 1880 dans la vallée de Klioutsch (Caucase) par les botanistes Émile Levier et Stefano Sommier[2] et scientifiquement décrite en 1895, mais recensée parmi d'autres graines en Grande-Bretagne (aux jardins botaniques royaux de Kew) dès 1917, et fut introduite comme plante ornementale dans les jardins britanniques dans la décennie suivante, pour se répandre très vite à l'état sauvage dans une grande partie de l'Europe. Elle a été introduite sur le continent américain en 1917 pour des raisons horticoles et répertoriée pour la première fois au Québec en 1990[3].
La Berce du Caucase mesure 2 à 5 mètres de hauteur. Ses feuilles sont divisées en 1 à 3 folioles profondément découpées et dentées. Elles mesurent souvent plus d'1 m, et peuvent atteindre 3 m en longueur (avec le pétiole) et jusqu'à 1,5 m de largeur. La tige principale, creuse (avec un diamètre de 4 à 10 cm), est plus ou moins cannelée, vert clair, teintée de nombreuses taches pourpres (rouge framboise à violettes), et hérissée de poils rudes, épars lorsqu'elle est jeune[4]. Son diamètre extérieur est de 3 à 8 centimètres (jusqu'à 10 cm)[réf. souhaitée].
La tige porte une inflorescence constituée par une ombelle principale au centre, d'environ 20 cm de diamètre (jusqu'à 50 cm), composée de 50 à 150 rayons qui portent chacun une ombellule. Cette ombelle principale qui apparaît mi-juin à mi-juillet, est entourée par un nombre variable d'ombelles satellites moins grandes, généralement positionnées plus hautes que l'ombelle principale lorsqu'elles sont à maturité. L’inflorescence entière peut atteindre une largeur d'1,5 m. Il peut y avoir une ou deux inflorescences supplémentaires moins importantes sur des branches auxiliaires. Les fleurs blanches, parfois roses, sont hermaphrodites au centre de l'ombelle, mâles sur le pourtour. La pollinisation est entomogame. Les fruits sont des akènes à dissémination anémochore[5].
Berces du Caucase du Jardin botanique alpin La Jaÿsinia
Berce du Caucase des Jardins de Valloires.
Elle est originaire des étages forestiers des montagnes de l'ouest du Caucase (Géorgie, Russie).
Elle préfère croître sous climat pluvieux et humide, ou à défaut sur des sols frais à humides. Son habitat type correspond à des ourlets externes médioeuropéens, eutrophiles, mésohydriques[5].
C'est une plante très rustique face au froid, qui se montre envahissante jusqu'au nord de la Scandinavie, les graines nécessitent d'ailleurs une période de gel en hiver pour pouvoir germer. Elle a besoin de sols plutôt riches pour soutenir sa forte croissance. C'est une plante de lumière mais elle supporte très bien un ombrage partiel. Elle se plait notamment aux lisières et dans les clairières des bois (ourlets forestiers), dans les zones humides et le long des cours d'eau (mégaphorbiaies). C'est une plante pionnière qui envahit en premier lieu des milieux rudéraux perturbés et abandonnés par l'homme : friches, terrains vagues, bords de routes. Elle revêt certains aspects d'hémérochorie.[réf. souhaitée]
Heracleum mantegazzianum a été introduite en Europe occidentale essentiellement comme plante ornementale dans les jardins, mais aussi pour ses qualités mellifères pour l'apiculture. Elle est désormais considérée comme une espèce invasive dans de nombreux pays d'Europe où elle s'est parfaitement acclimatée et trouve des conditions très semblables à celles de son milieu d'origine. Elle se multiplie et se répand si le milieu lui est accueillant. Chaque pied en fleur produit jusqu'à plusieurs dizaines de milliers de graines, et ces graines peuvent rester en dormance durant sept ans dans le sol. Les graines sont peu dispersées par le vent (généralement pas à plus de quelques mètres, jusqu'à cent mètres par vent fort), elles sont plus souvent dispersées par l'eau le long des rivières (notamment lors des crues), par les véhicules le long des routes (par temps humide) et dans la terre emportée par les engins de chantier et agricoles. Dans les milieux colonisés, elle peut théoriquement causer localement une perte de biodiversité par le couvert dense et continu qu'elle peut créer, qui étouffe et remplace la végétation plus basse préexistante, bien que ces atteintes à la biodiversité restent très modérées et localisées, difficiles à évaluer, et moins alarmantes que celles causées par d'autres plantes invasives telles que la renouée du Japon. Elle remplace surtout par endroits des plantes rudérales très communes et non menacées. La faune sauvage herbivore (cervidés, sangliers, lapins, rats musqués, ragondins, etc) et le bétail domestique apprécient beaucoup consommer cette plante, comme les autres Berces, surtout quand les feuilles sont encore jeunes et tendres, et peuvent plus ou moins en limiter les populations. De nombreux insectes et autres invertébrés autochtones la consomment également, mais sans entraver fortement son développement. Les préoccupations principales qu'induit cette plante résident principalement dans sa phototoxicité pour l'homme[6].
La Berce du Caucase est également invasive en Amérique du Nord, dont le Québec[3], où elle trouve des milieux très favorables à son expansion.
Depuis 2017, la Berce du Caucase est inscrite dans la liste des espèces exotiques envahissantes préoccupantes pour l’Union européenne[7]. Cela signifie qu'elle ne peut pas être importée, cultivée, commercialisée, plantée, ou libérée intentionnellement dans la nature, et ce nulle part dans l’Union européenne[8].
Il existe deux autres espèces de Berces géantes invasives en Europe. Heracleum sosnowskyi, originaire du Caucase central et oriental, qui est une espèce à peine un peu moins grande et difficile à distinguer de Heracleum mantegazzianum. Elle a été introduite en grande quantité en Europe de l'Est dans plusieurs pays de l'ex-Union soviétique (Russie, pays baltes) car elle y a été cultivée à grande échelle comme plante fourragère pour le bétail. Cette espèce semble encore pratiquement absente en Europe de l'Ouest. Heracleum persicum est une autre espèce semblable mais moins grande, qui envahit la péninsule scandinave essentiellement, où elle a été introduite comme plante médicinale et ornementale tout comme Heracleum mantegazzianum[9]. Ces trois espèces sont phototoxiques.
Heracleum sosnowskyi et Heracleum persicum sont elles aussi inscrites depuis 2016 dans la liste des espèces exotiques envahissantes préoccupantes pour l’Union européenne[7].
Il ne faut pas confondre ces espèces invasives avec la Berce commune, Heracleum sphondylium, une espèce autochtone et abondante en Europe qui affectionne les mêmes milieux, et qui peut sporadiquement se montrer envahissante en tant que mauvaise herbe. C'est une espèce très proche et très semblable en apparence mais bien plus petite, elle dépasse rarement deux mètres de haut (elle mesure généralement entre 50 et 150 cm) et son ombelle principale comprend moins de 35 rayons, alors que celle de la Berce du Caucase en a généralement plus de 50. La tige et le pétiole de la Berce commune n'ont pas les nombreuses taches pourpres caractérisant la Berce du Caucase. Elle est couverte de poils blanchâtres assez raides, même sur les feuilles, alors que les poils de la Berce du Caucase sont localisés uniquement sur la tige, le pétiole et le rachis de la feuille. Les feuilles de H. sphondylium sont parfois simplement lobées, plus souvent divisées en 5-7 larges folioles aux contours anguleux, plus dentés que chez H. mantegazzianum[10]. La Berce commune est considérée en Europe comme une plante comestible, bien qu'elle présente les mêmes propriétés de phototoxicité, mais plus modérément (elle est en cause dans la majorité des cas de dermite des prés).
En Amérique du Nord, dont le Québec, la Berce du Caucase peut être confondue avec la Berce laineuse, Heracleum maximum, espèce autochtone commune qui peut parfois atteindre 3 m de haut (généralement moins), mais nettement moins imposante que la Berce du Caucase. Elle aussi est phototoxique.
L'angélique sauvage (Angelica sylvestris) et l'angélique vraie (Angelica archangelica) peuvent être assez grandes, et sont parfois confondues avec les grandes Berces invasives, bien qu'elles soient bien moins massives et s'en différencient aisément par leurs feuilles nettement composées de folioles.
La Berce du Caucase produit des furocoumarines, dont la xanthotoxine, présentes dans la sève. La sève est incolore avec une odeur agréable assez caractéristique due à la furocoumarine. Elle est phototoxique : la réaction se déclenche seulement lorsque la peau imprégnée est exposée à la lumière, notamment aux rayonnements solaires. Si l'on n'expose pas à la lumière la zone touchée pendant plusieurs jours, la réaction ne se déclenche pas[3]. Elle provoque des inflammations et des brûlures de la peau pouvant aller jusqu'au second degré[réf. nécessaire]. Les cloques provoquées peuvent atteindre la taille d'une pomme de terre. Les séquelles de la phototoxicité de la sève n'apparaissent qu'après plusieurs heures et peuvent dans certains cas laisser des traces qui persistent des années.
Un simple contact avec la plante intacte n'est pas dommageable[11]. C’est l'imprégnation de la peau par la sève claire et aqueuse, abondante dans les fruits, les feuilles ou les tiges, survenant dès lors que la plante est blessée, coupée ou froissée, qu'il faut éviter.
En dehors de leur phototoxicité au niveau cutané, les furocoumarines ne sont pas particulièrement toxiques pour l'homme à l'ingestion. De nombreuses plantes cultivées, dont des fruits et légumes très courants, en contiennent d'ailleurs aussi en quantités plus ou moins importantes (chez les apiacées cultivées, en particulier le panais et le céleri, mais aussi la carotte, le persil et le fenouil, ainsi que chez les rutacées, dont tous les agrumes et la rue, et dans d'autres familles tel le figuier chez les moracées, etc), et ces plantes ont parfois une sève tout aussi phototoxique. Ce qui rend la Berce du Caucase relativement dangereuse est la quantité notable de sève qu'elle peut libérer lorsqu'on la cueille ou qu'on débroussaille, pouvant causer des brûlures assez étendues.
Si la sève touche la peau, il faut l'éliminer le plus rapidement possible, en évitant d'étendre la surface de la zone touchée : appliquer un papier absorbant sur la peau aux endroits où se trouve la sève (ne pas frotter), laver au savon, puis rincer abondamment à l'eau les endroits atteints. Par la suite, éviter l'exposition de la zone touchée à la lumière durant plus de 48 heures, le temps de la disparition de l'effet photosensibilisateur. « Si les yeux sont atteints, les rincer abondamment à l'eau claire puis porter des lunettes de soleil pour réduire leur exposition à la lumière et consulter un médecin immédiatement. En cas de contact important, ou si un enfant est atteint, consulter sans tarder un médecin ou le centre anti-poison pour tout conseil approprié »[2].
L'éradication de la Berce du Caucase nécessite le port d'un équipement approprié. Consulter des spécialistes avant d'agir.
Les animaux sauvages herbivores ainsi que le bétail domestique de toutes espèces apprécient et consomment assidument cette plante, notamment à son stade jeune, le plus souvent sans aucun problème, et ils constituent un moyen efficace pour la contrôler. Cependant certaines races domestiques à peau très claire et partiellement dénudée y sont sensibles, n'étant pas suffisamment protégées des rayonnements solaires. Ces dernières peuvent présenter des brûlures par photosensibilisation et ne doivent donc pas être utilisées là où croissent des plantes photosensibilisantes telles que les Berces[12].
Cette plante a été très représentée comme élément décoratif par les artistes du mouvement Art nouveau de l'École de Nancy[13].
En anglais, la Berce du Caucase s'appelle « Giant Hogweed ». En 1971, le groupe de rock progressif anglais Genesis crée un morceau intitulé « The Return Of The Giant Hogweed » qui figure sur l’album Nursery Cryme. Ce morceau décrit l’origine, les dangers, la difficulté d’éliminer cette plante et, dans une vision apocalyptique, la présente comme une menace pour l'espèce humaine.
Heracleum mantegazzianum
La Berce du Caucase ou Berce de Mantegazzi (Heracleum mantegazzianum), est une espèce de plantes herbacées de la famille des Apiaceae. La sève de cette Berce est phototoxique. De plus, cette espèce est considérée en Europe et en Amérique du Nord (particulièrement au Québec) comme invasive.
Divovski svinjski korov (lat. Heracleum mantegazzianum), jedna od vrsti roda Heracleum, (porodica Apiaceae). Rasprostranjena je po zapadnoj i srednjoj Aziji, a u Europu je unešena u 19. stoljeću.
To je zeljasta bilkjka koja može narasti do 350 cm visine. velikih je duboko urezanih listova i nazubljenih rubova, dužine i do jedan metar. Stabljika je uspravna, debela i šuplja. Svi dijelovi biljke sadrže furokuramin koji mogu izazvati opekline za koje je potrebna medicinska pomoć. Za svinje je bezopasna a i dobra je medonosna biljka.
Cvate od lipnja do kolovoza sitnim bijelim cvjetovima skupčljenim u polukuglaste cvatove.[1]
Bjarnarkló eða tröllahvönn (fræðiheiti: Heracleum mantegazzianum)[1] er stórvaxin sveipjurt sem upprunnin er í Kákasus og Mið-Asíu. Jurtin getur orðið 2-5 m há og stundum allt að 7 m. Bjarnarkló líkist venjulegri hvönn nema er miklu stórvaxnari.
Bjarnarkló er fjölær og fjölgar sér með rótarskotum. Blómin eru hvít og eru blómsveipirnir allt að 80 sm í þvermál.
Bjarnarkló er talin til ágengra tegunda. Hún hefur verið flutt inn til Evrópu sem skrautplanta en breiðst út í náttúrunni og myndað þéttar breiður þar sem skilyrði eru góð. Bjarnarkló er algeng meðfram árbökkum í Bretlandi. Hún var kynnt í Frakklandi á 18. öld og var þá vel tekið af býræktendum.
Bjarnarkló myndar eiturefni þannig að safi af bjarnarkló getur valdið bruna á hörundi í sólarljósi eða í UV-geislum. Húðin verður rauð og klæjar undir. Börn ættu ekki að vera á svæðum þar sem bjarnarkló vex og nota ætti hlífðarfatnað (líka hlífðargleraugu) ef þarf að grafa upp eða flytja slíkar plöntur. Ef húð kemst í snertingu við safa bjarnarklóar þá á að þvo húðsvæðið vel með sápu og vatni og forðast sólarljós í nokkra daga.
Bjarnarkló eða tröllahvönn (fræðiheiti: Heracleum mantegazzianum) er stórvaxin sveipjurt sem upprunnin er í Kákasus og Mið-Asíu. Jurtin getur orðið 2-5 m há og stundum allt að 7 m. Bjarnarkló líkist venjulegri hvönn nema er miklu stórvaxnari.
Bjarnarkló er fjölær og fjölgar sér með rótarskotum. Blómin eru hvít og eru blómsveipirnir allt að 80 sm í þvermál.
Bjarnarkló er talin til ágengra tegunda. Hún hefur verið flutt inn til Evrópu sem skrautplanta en breiðst út í náttúrunni og myndað þéttar breiður þar sem skilyrði eru góð. Bjarnarkló er algeng meðfram árbökkum í Bretlandi. Hún var kynnt í Frakklandi á 18. öld og var þá vel tekið af býræktendum.
Bjarnarkló myndar eiturefni þannig að safi af bjarnarkló getur valdið bruna á hörundi í sólarljósi eða í UV-geislum. Húðin verður rauð og klæjar undir. Börn ættu ekki að vera á svæðum þar sem bjarnarkló vex og nota ætti hlífðarfatnað (líka hlífðargleraugu) ef þarf að grafa upp eða flytja slíkar plöntur. Ef húð kemst í snertingu við safa bjarnarklóar þá á að þvo húðsvæðið vel með sápu og vatni og forðast sólarljós í nokkra daga.
Il pànace di Mantegazza[1] o di Mantegazzi o panace gigante (Heracleum mantegazzianum Sommier & Levier, 1895) è una pianta della famiglia delle Apiaceae, originaria del Caucaso.
La sua nomenclatura si deve ai botanici Emile Levier e Stefano Sommier, come omaggio all'amico antropologo Paolo Mantegazza.[2]
Il panace di Mantegazza è stato importato in Europa dal Caucaso alla fine del XIX secolo, come pianta ornamentale.[3] Dal 1950, a partire dai giardini privati, la pianta si è diffusa e inselvatichita insediandosi nei prati, sulle rive dei fiumi e nei luoghi incolti, sia in pianura, sia a quote più elevate.
Produce ogni anno da 1 500 a 100 000 semi, i quali conservano la capacità di germinare per circa 7-15 anni[4] e si propagano nel raggio di 50-100 metri con il vento e ad ulteriore distanza attraverso i corsi d'acqua o attaccati al pelo degli animali. Non genera stoloni, mentre il fittone nella sua parte superiore ha una elevata forza rigenerativa.[5]
La pianta è in grado di diffondersi con estrema rapidità ed è considerata, in particolare nelle isole britanniche e nell'Europa orientale, una delle specie più dannose. La sua pericolosità è legata principalmente alla tossicità cutanea e oculare della sua linfa, innescata dalla fotoesposizione, e alla capacità di minacciare la biodiversità provocando il deperimento e la distruzione della vegetazione indigena. Per tali motivi è ritenuta una pianta "indesiderata" e fa parte delle cosiddette "specie aliene invasive".[6][7]
In Italia, dove varietà differenti di Heracleum sono ampiamente diffuse, il panace di Mantegazza si trova in Piemonte, Valle D'Aosta, Liguria occidentale, nell'estremo settentrionale della Lombardia e, secondo altre fonti, anche in Veneto, Trentino-Alto Adige e Friuli-Venezia Giulia, specialmente nel nord della provincia di Udine.[8] Segnalazioni sporadiche sono state riportate anche a Cremona, nel Bresciano, nella Bergamasca e in Val Camonica.[9]
La pianta è erbacea e di grandi dimensioni, con vigorosi fusti cavi spesso cosparsi di macchie rosse. Può arrivare a 2-5 metri di altezza, raramente fino a 7. Le foglie sono profondamente lobate, a tre o cinque segmenti con divisioni meno profonde, i fiori sono di color bianco o verde-giallastro, organizzati in infiorescenze ombrelliformi che raggiungono 50 cm di diametro mentre i frutti sono lunghi 10–14 mm e larghi 6–8 mm, obovati, bordati da peli irti. La fioritura ha luogo da giugno ad agosto.[10]
Rispetto ad altre specie della stessa famiglia, il panace di Mantegazza presenta alcune caratteristiche inconfondibili:
Al tatto, in presenza o in seguito a irradiazione solare diretta o raggi UV, provoca gravi infiammazioni della pelle con estese lesioni bollose che possono lasciare cicatrici permanenti. A volte può essere necessario il ricovero in ospedale. Piccole quantità di linfa negli occhi possono causare cecità temporanea o anche permanente. Queste reazioni sono dovute alla presenza nelle foglie, nei fiori, nei semi, nel tronco e nella radice di furanocumarine in grado di penetrare nel nucleo delle cellule epiteliali dell'epidermide e legarsi al loro DNA, uccidendole.
In caso di necessità di maneggiare o estirpare il panace, devono essere utilizzati guanti e vestiti protettivi incluse protezioni per gli occhi. In caso di contatto con la pelle è necessario lavare accuratamente la sede colpita con acqua e sapone o con alcool ed evitare assolutamente l'esposizione solare per molti giorni, o addirittura settimane. I bambini vanno tenuti rigorosamente lontani dal panace di Mantegazza.
La pianta costituisce anche una minaccia per la biodiversità poiché tende a formare facilmente popolamenti densi e, grazie alle grandi foglie che generano una densa ombra, causa il deperimento e la distruzione della vegetazione indigena.
A causa della fototossicità e della sua natura invasiva, il panace di Mantegazza è spesso oggetto di campagne nazionali di rimozione attiva, specie nei paesi europei in cui la sua diffusione rappresenta un problema reale (Regno Unito, Germania, Belgio, Svizzera e Scandinavia); in Germania ad esempio vengono spesi annualmente circa 44 milioni di euro per combattere specie aliene invasive tra cui proprio il panace di Mantegazza;[11]
A seconda delle linee guida di lotta alla diffusione di questa pianta, sono descritte essenzialmente due metodiche di eradicazione:
Metodica di eradicazione consigliata in Svizzera: recidere la parte superiore della radice (a una profondità di 10–15 cm) o tagliare le piante al livello del suolo al momento della fioritura, utilizzando adeguate protezioni. Le piante dovrebbero di preferenza essere rimosse dai giardini. Non diffondere né i semi né le piante. Bruciare le piante e le radici o consegnarle ai servizi di incenerimento dei rifiuti; non gettare nel compost e non consegnare ai servizi di raccolta dei rifiuti verdi. Segnalare agli uffici cantonali per la protezione della natura le nuove stazioni negli ambienti naturali protetti e nelle loro vicinanze.
Metodica di eradicazione suggerita nel Regno Unito: la pianta non dovrebbe essere abbattuta ma spruzzata a intervalli ripetuti con erbicidi come ad esempio 2,4-D, TBA, MCPA e dicamba che però sono poco efficaci nel combattere le radici. Il glifosato (Roundup) è considerato il più efficace, ma è pericoloso per le altre specie perché poco selettivo. In ogni caso, data la resistenza e possibilità dei semi di germinare anche dopo 15 anni, dopo il trattamento è necessario un lungo monitoraggio delle zone a rischio.[12]
Il panace di Mantegazza e i problemi causati dalla sua rapida diffusione nel Regno Unito hanno ispirato il testo di un brano del gruppo rock britannico Genesis: The Return of the Giant Hogweed, dall'album Nursery Cryme del 1971 (giant hogweed è appunto il nome comune del panace in inglese). La storia di fantasia immagina uno scenario apocalittico in cui la pianta si propaga a dismisura fino a minacciare l'intera razza umana, contro la quale si vendica per essere stata trapiantata in terre lontane a scopo puramente estetico.[13]
Il pànace di Mantegazza o di Mantegazzi o panace gigante (Heracleum mantegazzianum Sommier & Levier, 1895) è una pianta della famiglia delle Apiaceae, originaria del Caucaso.
La sua nomenclatura si deve ai botanici Emile Levier e Stefano Sommier, come omaggio all'amico antropologo Paolo Mantegazza.
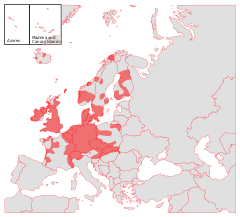
Mantegacio barštis (Heracleum mantegazzianum) – salierinių (Apiaceae) šeimos žolinių augalų rūšis. Kilusi iš šiaurės vakarų Kaukazo, dabar paplitusi Vakarų ir Šiaurės Europoje, Čekijoje, Lenkijoje.
Tai labai stambus, vešlus augalas, užaugantis iki 6 m aukščio (didžiausias iš visų salierinių). Stiebas tvirtas, 5-10 cm skersmens, purpurinis arba su purpurinėmis gyslomis. Lapai iki 3 m skersmens, suskaidyti į 3-5 dalis. Žiedynas – sudėtinis skėtis, sudarytas iš 30-150 lankų. Žiedai balti, ant vieno augalo jų gali būti iki 80 tūkst. Žydi birželio-rugpjūčio mėnesiais. Mantegacio barštis panašus į Sosnovskio barštį, tik didesnis ir siauresniais lapais.
Mantegacio barštis – agresyvus invazinis augalas, piktžolė. XIX a. atvežtas į Didžiąją Britaniją kaip dekoratyvinis augalas, vėliau pradėtas auginti kitose Europos šalyse, JAV. Sparčiai plinta upių pakrantėse, šiukšlynuose, pakelėse. Nereiklus dirvai, augimo sąlygoms. Augalo sultys nuodingos, turi furanokumarinų, sukeliančių sunkius odos nudegimus.
Mantegaca latvānis (latīņu: Heracleum mantegazzianum Sommier et Levier) ir latvāņu ģints augs, kas Latvijā ievests un kultivēts kā krāšņumaugs. Tā dzimtene ir Kaukāzs. Auga stublājs sasniedz 3 metru garumu. Lapas ļoti lielas, nepāra plūksnainas vai lineāri lancetiskas, asi smailas. Stublājs ar rupjiem matiņiem. Ziedu čemurs līdz 1 metru plats. Ziedi balti, ziedkopas ļoti lielas. Zied jūnijā, jūlijā. Pavairojas ar sēklām. Tāpat kā citiem invazīvajiem latvāņiem, arī Mantegaca latvāņa sula var radīt ādas apdegumus.[1]
Mantegaca latvānis (latīņu: Heracleum mantegazzianum Sommier et Levier) ir latvāņu ģints augs, kas Latvijā ievests un kultivēts kā krāšņumaugs. Tā dzimtene ir Kaukāzs. Auga stublājs sasniedz 3 metru garumu. Lapas ļoti lielas, nepāra plūksnainas vai lineāri lancetiskas, asi smailas. Stublājs ar rupjiem matiņiem. Ziedu čemurs līdz 1 metru plats. Ziedi balti, ziedkopas ļoti lielas. Zied jūnijā, jūlijā. Pavairojas ar sēklām. Tāpat kā citiem invazīvajiem latvāņiem, arī Mantegaca latvāņa sula var radīt ādas apdegumus.
De reuzenberenklauw (Heracleum mantegazzianum) is een vaste plant[1] uit de schermbloemenfamilie (Apiaceae). Het aantal chromosomen is 2n = 22.
In de 19e eeuw is de reuzenberenklauw uit Zuidwest-Azië als tuinplant in Europa geïntroduceerd. In de Benelux is deze exoot volledig ingeburgerd. De reuzenberenklauw wordt anno 2010 steeds vaker in verstedelijkt gebied aangetroffen en, mede om de schadelijke werking van het sap van deze plant op huid en ogen, in toenemende mate als een probleem ervaren. Sinds 2 augustus 2017 is in alle landen van de Europese Unie bestrijding van de plant verplicht, en verhandelen ervan verboden, omdat de soort toen werd opgenomen op de Unielijst van invasieve soorten.[2][3]
De plant heeft klauwvormige bladeren. Ze is verwant aan de gewone berenklauw, maar veel groter. Nog sterker gelijkende verwante soorten zijn Sosnowsky's berenklauw en Perzische berenklauw, die in andere landen van Europa invasieve soorten zijn.
De reuzenberenklauw kan, afhankelijk van de groeiplaats, in de lente in een paar maanden tijd uitgroeien tot een hoogte van 4 meter. Afhankelijk van de groeiplaats zullen de zaailingen na een of meerdere jaren de bloeifase bereiken. Het eerste jaar blijft de plant laag (50 cm), het jaar erop is hij meestal volgroeid, en bloeit van juni tot augustus met een variabel aantal samengestelde schermen vol witte bloemetjes. Na de bloei sterft de plant af.
De plant is vooral te vinden langs wegen en op plaatsen die niet begraasd of bewerkt worden. De plant komt veelal voor op ruderale terreinen met verstoorde, voedselrijke grond.
Omdat de reuzenberenklauw zo kiemkrachtig is en met zijn bladeren al het licht voor andere planten wegneemt, wordt de soort beschouwd als een onkruid. In gebieden die niet begraasd worden drukt de invasieve soort alle andere planten weg; daar komt bij dat hij in de Benelux naast grote grazers en schapen geen natuurlijke belagers kent.
De reuzenberenklauw is eetbaar, vooral schapen zijn er dol op.
De plant kan grote schade toebrengen aan de huid en aan de ogen omdat het sap furocoumarinen bevat, die voor mensen sterk fototoxisch zijn. Blootstelling aan zonlicht na contact met het sap kan na 24 uur rode jeukende vlekken veroorzaken, die gevolgd worden door zwelling en blaarvorming (fytofotodermatitis). Het letsel kan eruitzien als een brandwond en het kan twee weken duren voordat het genezen is. Als litteken kan er een bruinverkleuring optreden.
Wanneer het sap in de ogen komt, kan dit tot blindheid leiden.
In 2017 registreerde het Belgische Antigifcentrum 28 letselgevallen na contact met de reuzenberenklauw.[4]
De grote afmetingen, exotische afkomst en fototoxiciteit maken de plant tot een dankbaar onderwerp voor nieuwsberichten.[5][6]
Het effect van contact met het plantenvocht in combinatie met zonlicht kan ernstig zijn door het veroorzaken van brandwonden, en is vergelijkbaar met de gevolgen van contact met carbolineum. Als voorzorg bij de bestrijding van de plant wordt aanbevolen volledig gekleed te gaan met beschermende kleding. Bij mechanische bestrijding wordt een veiligheidsbril gebruikt.
Tot de mechanische bestrijdingsmethoden behoort het uitsteken van jonge planten, het herhaald maaien in combinatie met het handmatig schoffelen, om te voorkomen dat de plant in bloei komt of tot zaadvorming overgaat.
Biologische bestrijdingsmethoden zijn begrazing, behandeling met schimmels, met aaltjes bij de ondergrondse delen, of met kevers bij de bovengrondse delen.
In oorspronkelijk verspreidingsgebied blijkt het aaltje de wortels te belagen en kever de bovengrondse delen.
In Nederland wordt in het voorjaar een schimmel toegepast. Na anderhalf jaar is de reuzenberenklauw ter plaatse verdwenen.[7][8]
De reuzenberenklauw (Heracleum mantegazzianum) is een vaste plant uit de schermbloemenfamilie (Apiaceae). Het aantal chromosomen is 2n = 22.
In de 19e eeuw is de reuzenberenklauw uit Zuidwest-Azië als tuinplant in Europa geïntroduceerd. In de Benelux is deze exoot volledig ingeburgerd. De reuzenberenklauw wordt anno 2010 steeds vaker in verstedelijkt gebied aangetroffen en, mede om de schadelijke werking van het sap van deze plant op huid en ogen, in toenemende mate als een probleem ervaren. Sinds 2 augustus 2017 is in alle landen van de Europese Unie bestrijding van de plant verplicht, en verhandelen ervan verboden, omdat de soort toen werd opgenomen op de Unielijst van invasieve soorten.
Kjempebjørnekjeks (Heracleum mantegazzianum) er ein to-årig urt i skjermplantefamilien. Den kan verta opptil fire meter høg, og er svært hardfør. Spreiingsevna gjer at den ofte hemmar eller utkonkurrerar annan plantevekst. Den breier seg ofte langs vegkantar, bekkekantar og eng og er ganske vanleg på Austlandet og nordover mot Trøndelag.
Safta frå planta er giftig, og gjev ved eksponering under sollys hudreaksjonar på utsette område (fytofototoksisk reaksjon). Dette gjev seg vanlegvis utslag i rauda, kløde, svie, eksem og i vondaste fall store blemmer (tredjegrads forbrenning) då giftstoffa gjer huda ømfintleg for UV-strålar. Denne ømfintlegheita kan halda fram i inntil eit år etter eksponering.
Ved nedklipping bør ein ha på seg verneutstyr, og dessutan huske på å vaska kutteredskapar av metall etter bruk, då safta verkar oksiderande.
Kjempebjørnekjeks kan vera vanskeleg å skilja frå Tromsøpalme (Heracleum tromsoensis).
Planta er naturalisert overalt i Europa, der den invaderar stadar med lett skugge, vedvarande fuktig jord med eit høgt innhald av humus og næringsstoff. Den stammar endå opphavleg frå den nordlege fjellkjede i Kaukasus, der den finst i snever, lysningar, skogbryn og ofte langs vannløp. Desse områda har ein årleg nedbør på 1000–2000 mm og eit temperert, kontinentalt klima. Ved landsbyen Omalo i Tushetidalen i Georgia finst den saman med m.a. Aquilegia olympica, Dactylorhiza euxina, Echium russicum, Bekkeblom, Enghumleblom, Marianøkleblom, Brudespore, Primula luteola og Tanacetum coccineum.
Kjempebjørnekjeks er ei innført plante og difor ikkje opphavleg heimehøyrande i Noreg. Di verre har planta spreidd seg uhemma og har danna tette bevoksninger, der dei skuggane for alt anna. Dette har ført til at mange meiner at den bør utryddast, og mange kommunar har sett planar i verk for bekjempelse av kjempebjørnekjeks.
Kjempebjørnekjeks kan verta med kjempa mot:
Kjempebjørnekjeks (Heracleum mantegazzianum) er ein to-årig urt i skjermplantefamilien. Den kan verta opptil fire meter høg, og er svært hardfør. Spreiingsevna gjer at den ofte hemmar eller utkonkurrerar annan plantevekst. Den breier seg ofte langs vegkantar, bekkekantar og eng og er ganske vanleg på Austlandet og nordover mot Trøndelag.
Safta frå planta er giftig, og gjev ved eksponering under sollys hudreaksjonar på utsette område (fytofototoksisk reaksjon). Dette gjev seg vanlegvis utslag i rauda, kløde, svie, eksem og i vondaste fall store blemmer (tredjegrads forbrenning) då giftstoffa gjer huda ømfintleg for UV-strålar. Denne ømfintlegheita kan halda fram i inntil eit år etter eksponering.
Ved nedklipping bør ein ha på seg verneutstyr, og dessutan huske på å vaska kutteredskapar av metall etter bruk, då safta verkar oksiderande.
Kjempebjørnekjeks kan vera vanskeleg å skilja frå Tromsøpalme (Heracleum tromsoensis).
Kjempebjørnekjeks (Heracleum mantegazzianum) er en to-årig urt i skjermplantefamilien. Den kan bli inntil fire meter høy, og er svært hardfør. Spredningsevnen gjør at den ofte hemmer eller utkonkurrerer annen plantevekst. Den brer seg ofte langs veikanter, bekkekanter og enger og er ganske vanlig på Østlandet og nordover mot Trøndelag.
Saften fra planten er giftig, og gir ved eksponering under sollys hudreaksjoner på utsatte områder (fytofototoksisk reaksjon). Dette gir seg vanligvis utslag i rødme, kløe, svie, eksem og i verste fall store blemmer (andregrads forbrenning) da giftstoffene gjør huden ømfintlig for UV-stråler. Denne ømfintligheten kan vedvare i inntil et år etter eksponeringen.
Ved nedklipping bør man ha på seg beskyttelsesutstyr, samt huske på å vaske kutteredskaper av metall etter bruk, da saften virker oksiderende.
Kjempebjørnekjeks kan være vanskelig å skille fra tromsøpalme (Heracleum tromsoensis).
Planten er naturalisert overalt i Europa, hvor den invaderer steder med lett skygge, vedvarende fuktig jord med et høyt innhold av humus og næringsstoffer. Den stammer dog opprinnelig fra den nordlige fjellkjede i Kaukasus, hvor den finnes i eng, lysninger, skogbryn og ofte langs vannløp. Disse områdene har en årlig nedbør på 1000-2000 mm og et temperert, kontinentalt klima. Ved landsbyen Omalo i Tushetidalen i Georgia finnes den sammen med bl.a. Aquilegia olympica, Dactylorhiza euxina, Echium russicum, Bekkeblom, Enghumleblom, Marianøkleblom, Brudespore, Primula luteola og Tanacetum coccineum.
Kjempebjørnekjeks er en innført plante og derfor ikke opprinnelig hjemmehørende i Norge. Dessverre har planten spredt seg uhemmet og har dannet tette bevoksninger, hvorved de skygger for alt annet. Dette har ført til at mange mener at den bør utryddes, og mange kommuner har satt planer i verk for bekjempelse av kjempebjørnekjeks.
Kjempebjørnekjeks kan bekjempes med:
Kjempebjørnekjeks (Heracleum mantegazzianum) er en to-årig urt i skjermplantefamilien. Den kan bli inntil fire meter høy, og er svært hardfør. Spredningsevnen gjør at den ofte hemmer eller utkonkurrerer annen plantevekst. Den brer seg ofte langs veikanter, bekkekanter og enger og er ganske vanlig på Østlandet og nordover mot Trøndelag.
Saften fra planten er giftig, og gir ved eksponering under sollys hudreaksjoner på utsatte områder (fytofototoksisk reaksjon). Dette gir seg vanligvis utslag i rødme, kløe, svie, eksem og i verste fall store blemmer (andregrads forbrenning) da giftstoffene gjør huden ømfintlig for UV-stråler. Denne ømfintligheten kan vedvare i inntil et år etter eksponeringen.
Ved nedklipping bør man ha på seg beskyttelsesutstyr, samt huske på å vaske kutteredskaper av metall etter bruk, da saften virker oksiderende.
Kjempebjørnekjeks kan være vanskelig å skille fra tromsøpalme (Heracleum tromsoensis).
Barszcz Mantegazziego, barszcz kaukaski, barszcz mantegazyjski (Heracleum mantegazzianum) – gatunek rośliny z rodziny selerowatych (Apiaceae). Pochodzi z regionu Kaukazu. Rozprzestrzeniony został początkowo jako roślina ozdobna w zachodniej części Europy i w Ameryce Północnej, gdzie rozprzestrzenił się jako gatunek inwazyjny. W Polsce po raz pierwszy notowany w drugiej połowie XX w. We florze Polski ma status kenofita. Jest kontrolowany, ale bez powodzenia[3]. Blisko spokrewniony z równie kłopotliwym gatunkiem inwazyjnym, jakim jest barszcz Sosnowskiego.
Naturalny zasięg obejmuje zachodnią część pasma górskiego Wielkiego Kaukazu, gdzie występuje w ziołoroślach od górnej granicy lasu (2200 m n.p.m.) po niziny rozpościerające się na północny-zachód i na południowy-wschód od pasma górskiego. W północno-zachodniej części zasięgu barszcz rośnie w ziołoroślach towarzyszących lasom łęgowym w dolinie rzeki Kubań i nad jej lewostronnymi dopływami, także na stanowiskach ruderalnych i na odłogach[4].
Barszcz Mantegazziego sprowadzony został do Europy Zachodniej co najmniej na początku XIX wieku. Jego obecność w Królewskich Ogrodach Botanicznych w Kew w Londynie odnotowana została w 1817. W 1828 pierwszą zdziczałą populację w Anglii stwierdzono w hrabstwie Cambridgeshire[5]. W XIX wieku gatunek występował już w 14 krajach zachodnio- i północnoeuropejskich. Wszędzie przyczyną jego rozprzestrzeniania było wprowadzanie tego gatunku jako ozdobnego do ogrodów botanicznych oraz do parków i terenów zieleni przy posiadłościach ziemskich[5]. W latach 70. i 80. XX wieku gatunek ten opisywany jest jako rozprzestrzeniający się w prowincji Ontario w Kanadzie oraz w stanie Nowy Jork w USA[6]. Współcześnie jest inwazyjny także w Nowej Szkocji i Quebecu na wschodzie Kanady oraz w Kolumbii Brytyjskiej na zachodzie, a także w stanach Maine, Connecticut, Pensylwania, Michigan i Illinois w północno-wschodnich USA oraz w stanach Waszyngton i Oregon na północnym zachodzie[7][8]. W Ameryce Północnej jego zasięg pozostaje jednak ograniczony do niewielkich obszarów, jego trend rozprzestrzeniania się oceniany na wysoki i średni[7]. W Stanach Zjednoczonych gatunek wymieniony jest na federalnej liście uciążliwych chwastów, w wielu stanach jest rośliną zakazaną i podlega obowiązkowi zwalczania[8]. Gatunek zawleczony został także do Australii i Nowej Zelandii[2].
Na terenie Polski pierwsze doniesienia o tym gatunku odnotowane zostały w latach 70. XX wieku w zachodniej części kraju[9]. Problemem w precyzyjnym określeniu rozprzestrzenienia tego gatunku jest to, że bywa nierozróżniany od podobnego barszczu Sosnowskiego[10]. Uznaje się, że barszcz Mantegazziego jest w Polsce rzadszy, występuje głównie w południowo-zachodniej części kraju, częściej niż barszcz Sosnowskiego spotykany jest w miastach, gdzie sadzony był jako roślina ozdobna[9]. Ponieważ nazwy tych gatunków uznawane były za synonimy, rzeczywisty stan rozprzestrzenienia obu tych gatunków pozostaje niejasny nie tylko w Polsce, ale także w innych krajach, zwłaszcza tam gdzie oba te gatunki współwystępują[9].
We wszystkich częściach rośliny, w tym we włoskach gruczołowych na łodygach i w liściach oraz w korzeniach, znajduje się olejek eteryczny zawierający m.in. związki kumarynowe (furanokumaryny). Związki te pełnią funkcję obronną – chronią roślinę przez owadami i patogenami[9]. Zawartość furanokumaryn jest zmienna u różnych roślin[5]. Zawartość i skład olejku eterycznego ulega także zmianom w trakcie sezonu wegetacyjnego. Poza wymienionymi związkami w jego skład wchodzą m.in. także: alfa-pinen, beta-pinen, kamfen, mircen, limonen, ocymen[14].
W obszarze naturalnego zasięgu jest gatunkiem występującym w różnych zbiorowiskach ziołoroślowych, wykształcających się na polanach śródleśnych i w innych miejscach otwartych, nasłonecznionych, o wysokiej wilgotności powietrza, na żyznych i próchnicznych glebach. Rośnie w towarzystwie innych wysokich na 2–3 m roślin zielnych, przy czym w zbiorowiskach tych nigdy nie jest gatunkiem dominującym i jego udział rzadko przekracza 25%[4].
Mandenowa w 1950 zaliczyła barszcz Mantegazziego wraz z dziesięcioma innymi gatunkami do sekcji Pubescentia w obrębie rodzaju Heracleum (później powiększoną przez innych badaczy o dwa kolejne gatunki)[12], która została w badaniach molekularnych potwierdzona jako grupa monofiletyczna (wszystkie taksony pochodzą od wspólnego przodka)[15]. Zdaje się to potwierdzać hipotezę o autochtonicznym pochodzeniu gatunku, który zróżnicować się miał w rejonie Kaukazu w trzeciorzędzie. Według alternatywnej koncepcji gatunek miałby być reliktem europejskiej flory trzeciorzędowej, który skolonizował rejon Kaukazu podczas plejstocenu[4] i tam się zachował.
W kontekście wczesnej (początek XIX wieku) obecności w uprawie w Europie zachodniej, zaskakująca jest data odkrycia gatunku w naturze – 1890 rok. Ponieważ zachodnia część Kaukazu pozostawała dla badaczy w XIX wieku długi czas niedostępna z powodu konfliktów zbrojnych, uważa się, że okazałe barszcze pozyskiwane w rejonie Kaukazu reprezentują raczej barszcz Sosnowskiego[12]. Rośliny spotykane w kolekcjach i parkach nazywano Sphondylium pubescens Hoffm. (Hoffmann, 1814), Heracleum giganteum Spr., a później Heracleum pubescens (Hoffm.) M. Bieb. (Marschall von Bieberstein, 1819). W każdym razie pierwszy botaniczny opis gatunku opublikowali Stefano Sommier i Emile Levier w 1895.
Jako agresywna roślina inwazyjna, barszcz Mantegazziego jest zwalczany w Polsce i innych krajach, w których jest gatunkiem obcym. Metody zwalczania i zasady bezpieczeństwa są analogiczne, jak w przypadku barszczu Sosnowskiego. W Niemczech na walkę z barszczem Mantegazziego oraz usuwanie skutków związanych ze złym wpływem na zdrowie człowieka wydaje się rocznie od 6 do 21 milionów €[16].
Barszczowi Mantegazziego poświęcony jest utwór zespołu Genesis pt. "The Return of the Giant Hogweed", zamieszczony na albumie Nursery Cryme z 1971 roku.
Barszcz Mantegazziego, barszcz kaukaski, barszcz mantegazyjski (Heracleum mantegazzianum) – gatunek rośliny z rodziny selerowatych (Apiaceae). Pochodzi z regionu Kaukazu. Rozprzestrzeniony został początkowo jako roślina ozdobna w zachodniej części Europy i w Ameryce Północnej, gdzie rozprzestrzenił się jako gatunek inwazyjny. W Polsce po raz pierwszy notowany w drugiej połowie XX w. We florze Polski ma status kenofita. Jest kontrolowany, ale bez powodzenia. Blisko spokrewniony z równie kłopotliwym gatunkiem inwazyjnym, jakim jest barszcz Sosnowskiego.
A Heracleum mantegazzianum contém furocumarinas (psoralenos) que produzem mudanças na estrutura celular da pele, reduzindo a sua proteção contra os efeitos da radiação UV. Estas podem ser liberadas a partir da planta simplesmente roçando-a. A exposição à luz do sol após o contato provoca erupções severas na pele e/ou bolhas e queimaduras, cujos efeitos já começam poucas horas após o contato. Mesmo em dias nublados produzem novas queimaduras.
Dependendo da extensão do contato, a vítima pode sofrer um avermelhamento da pele, queimaduras e bolhas que necessitam de tratamento hospitalar.
A radiação ultravioleta A (UVA) ativa substâncias químicas conhecidas como psoralenos, que ocorrem naturalmente em várias plantas, não só está planta como muitas outras, com destaque por exemplo para a Figueira. Na presença de UVA ocorre a conjugação de psoralenos com o DNA das células epidérmicas, inibindo a replicação do DNA e causanso a interrupção do ciclo celular. A fotossensibilização mediada pelos psoralenos também causa uma alteração na expressão de citocinas e receptores de citocinas. Os psoralenos interagem com RNA, proteínas e outros componentes celulares e modificam indiretamente proteínas e lipídios por meio de reações mediadas por oxigênio singuleto ou pela geração de radicais livres. Os linfócitos infiltrantes são fortemente suprimidos, com efeitos variáveis em diferentes subconjuntos de células T. Todos estes mecanismos estão na origem de reacções de fotossensibilidade, predominantemente fototoxicidade (basicamente uma queimadura facilitada), que se usada em ambiente e doses controlados pode ser utilizada como uma variedade muito útil e eficaz de fototerapia (Psoraleno+ UVA = PUVA). Por outro lado a exposição inadvertida, acidental, à seiva de plantas rica em psoralenos, pode conduzir, mediante exposição à luz solar, ao desenvolvimento de graves reações de fototoxicidade (potenciação de queimadura), que são muitas vezes designadas de fito(planta)foto (luz)dermatite, caracterizada por lesões inflamatórias, por vezes bolhosas, nas áreas de contacto, muitas vezes desenhando padrões bizarros, mediante o tipo de contato com as plantas. Lesões que após a fase inflamatória inicial desenvolvem hiperpigmentação residual post-inflamatória que pode levar meses a regredir. A "Dermatite dos prados" de quem vai fazer piqueniques ao campo e se senta ou deita em cima de plantas cuja seiva é rica em psoralenos, e a "Dermite em berloque" (fotosensibilizaçao a perfumes contendo fotossensibilizantes, como a essência de bergamota) são outros exemplos de reacções de fotossensibilidade aos psoralenos. A fitofotodermatite surge muitas vezes em contexto profissional, ao estar-se a proceder à poda de Figueiras, à luz do sol e sem medidas adequadas de fotoprotecçao (camisas de manga comprida e luvas,bem como chapéu), sendo uma causa frequente de recurso a consultas urgentes de dermatologia no Verão.
Em alguns casos, ocorre uma alteração permanente na pigmentação da pele.
Atualmente, a Heracleum mantegazzianum está sendo discutida. Há discussões em que se afirma que os casos apontados são exagerados e que muitas outras plantas são mais perigosas. Esse ponto de vista parece ser contrário às conclusões de um estudo realizado em 1996 na Suíça com 29 relatos de intoxicação por plantas. Dentro desses casos, 18 relatos para a Heracleum mantegazzianum merecem destaque por terem produzidos consequências "sérias" e que se tornaram a segunda planta mais perigosa (só a Atropa belladona, beladona, é mais perigosa).[carece de fontes?]
Fonte: http://www.thepoisongarden.co.uk/atoz/heracleum_mantegazzianum.htm
Boľševník obrovský (Heracleum mantegazzianum) je rastlina z čeľade zelerovité (Apiaceae).
Pochádza z centrálnej Ázie (Kaukaz a z juhu priľahlé oblasti). V súčasnosti je to v Európe a Severnej Amerike významný invázny druh.
Na Slovensku a v mnohých ďalších krajinách severnej pologule je vedený ako obzvlášť nebezpečný druh,[1] ktorý je schopný ničiť pôvodné ekosystémy na danom území. Navyše môže ohroziť ľudské zdravie, pretože obsahuje rôzne fototoxické furanokumaríny, ktoré u človeka spôsobujú ťažké fotodermatitídy.
Boľševník obrovský bol vedecky popísaný až v roku 1895, a to pod platným názvom Heracleum mantegazzianum.[2] Má však niekoľko synoným, ku ktorým patria:
Podľa niektorých autorov sa za synonymá môžu považovať tiež nasledujúce druhy:
Toto však nie je potvrdené. Pokiaľ by tomu tak bolo, potom platným menom by bolo staršie z týchto dvoch mien. V literatúre sa tiež vyskytovalo chybné určenie jedincov tohoto druhu ako H. speciosum auct. non Weinmann, ktorý môže byť v oblasti strednej Európy tiež iným, zavlečeným druhom.[3]
Okrem boľševníka obrovského rastie na Slovensku ešte boľševník borščový (Heracleum sphondylium), ktorý sa svojmu príbuznému trochu podobá. Nie je vylúčené, že sa v miestach spoločného výskytu obidva druhy krížia; zo Spojeného kráľovstva a Nemecka bol už výskyt krížencov Heracleum sphondylium × mantegazzianum hlásený. V niektorých európskych krajinách dochádza k invázii ďalších tzv. „obrích boľševníkov“ podobného vzhľadu a vlastností, konkrétne ide o druhy boľševník Sosnowského (Heracleum sosnowskyi) šíriaci sa hlavne v Pobaltí a Heracleum persicum, ktorý súperí s boľševníkom obrovským o titul najnáročnejší invázny druh Škandinávie, z globálneho hľadiska je ale význam týchto invázií oveľa menší.
Boľševník obrovský je rastlina impozantného vzrastu, v stredoeurópskych podmienkach dorastá 2 – 4, niekedy až 5 metrov výšky.[2] Ide o dvoj- až viacročnú rastlinu, ktorá v prvom roku klíči zo semena spravidla už v polovici februára (niekedy aj skôr), vytvára len listy a zhromažďuje zásoby v mohutnom koreni. Druhý až piaty rok (ale možno aj neskôr – smerodajné je, za ako dlho sa rastline podarí zabezpečiť zásoby) potom vytvorí listovú ružicu a vyženie mohutnú kvetnú byľ so súkvetím. Byľ je dutá a naružovalo až fialovo škvrnitá, pri najväčších exemplároch sa jej priemer môže blížiť až k 10 cm.[2] Listy sú väčšie a ostrejšie vykrajované ako u pôvodného boľševníka borščového (majú 10 – 150 cm² plochy).
Obrovské okolíčnaté súkvetia môžu mať údajne až cez 1 m v priemere a majú bielu, nažltlú alebo jemne ružovú farbu. Kvetný vzorec boľševníka je * K5 C5 A5 G(2). V obojpohlavných kvetoch dozrieva najskôr peľ v peľniciach, neskôr blizna, ale medzi jednotlivými kvetmi môže dôjsť k prekryvu pohlavnej zrelosti blizien a peľu. K opeleniu dochádza za pomoci hmyzích opeľovačov (entomogamia, teda typ zoogamie), obvykle medzi rôznymi rastlinami, ale dochádza aj k úspešnému samoopeleniu (taktiež vďaka opeľovačom) a aj jediná osamotená rastlina teda produkuje klíčivé semená. V stredoeurópskych podmienkach kvitne boľševník obrovský väčšinou od polovice júna až do konca júla. Jedna rastlina vyprodukuje obvykle 20 000 – 30 000 semien (obzvlášť urastený jedinec až 100 000), ktoré si uchovávajú klíčivosť 8 až 12 rokov (dlhšie než tri roky však prežíva v semennej banke už len nepatrný zlomok semien, ale je nutné mať na pamäti, koľko semien rastlina vytvorí a že aj jediný jedinec môže znova zahájiť inváziu).
Je zaujímavé, že v oblastiach, ktoré sa považujú za jeho pôvodný areál, dorastá boľševník obrovský zhruba do 1,5 metra a nie je ani zďaleka tak agresívny. Je však potrebné podotknúť, že rastliny rastúce v predpokladaných oblastiach pôvodu sú podstatne odlišné aj pokiaľ ide o génovu výbavu, čo bolo zrejme spôsobené rozličným krížením a tiež účelovou selekciou v priebehu šírenia a pestovania druhu v okrasných a botanických záhradách a následnom splaňovaní. Tento fakt značne komplikuje snahu nájsť vhodného prirodzeného nepriateľa tohto boľševníka – pokiaľ sa už nejaký nájde, spravidla napáda príliš široké spektrum rastlín čeľade mrkvovité.
Ako invazívna rastlina osídľuje boľševník obrovský takmer všetky stanoviská. Šíri sa pozdĺž ciest a vodných tokov. Obvykle najskôr ovládne ruderálne stanovisko, kde mu r-stratégovia nemôžu konkurovať, a s podporou takto vzniknutých ohnísk sa potom začne šíriť aj na vlhké a na živiny bohaté stanoviská v okolí, odkiaľ postupne vytlačí konkurenčne silné byliny. Využíva k tomu fakt, že jeho semená vyklíčia veľmi skoro na jar, rýchle prerastú väčšinu rastlín a vytvoria zákryv, ktorý mu poskytuje veľkú výhodu. Časom dôjde obvykle k vytvoreniu súvislého porastu, ktorý môže pohltiť 80 % všetkého slnečného žiarenia a celkom znemožniť ostatným rastlinám rast. Mortalita vyrastených rastlín je pred vysemenením malá, pretože je pre väčšinu bylinožravcov aj parazitov nestráviteľná (nepožívateľná).
Ak ovládne boľševník obrovský nejaký priestor, nemožno dosť dobre predpokladať, že by sa ho príroda v dohľadnom čase sama zbavila a k jeho vytlačeniu je potrebný ľudský zásah. Jeho porast vytvára prostredie nevhodné pre rast väčšiny rastlín, vrátane semenáčov stromov a predstavuje zdravotné riziko pre zvieratá aj človeka. V poraste panuje silná úroveň kompetície, presadia sa len silní jedinci.
Prirodzené šírenie zaisťujú semená roznášané vetrom a tečúcou vodou, ďalej majú význam aj semená zachytené na dobytku či pneumatikách. Rýchlosť šírenia je v globálnom aj regionálnom meradle porovnateľná s najnebezpečnejšími inváznymi druhmi, v závislosti na podmienkach môže dochádzať ku každoročnému posunu hranice plochy zarastenej boľševníkom až o desiatky metrov.
Boľševník obrovský bol do Európy zavlečený z Kaukazu a priľahlých oblastí ako okrasná rastlina. Aj keď bol boľševník obrovský popísaný až v roku 1895, prvá spoľahlivá informácia o introdukcii do Európy pochádza už z roku 1817 v londýnskej botanickej záhrade Kew Gardens. Po desiatich rokoch sa však už objavujú správy o divo rastúcich populáciách v grófstve Cambridgeshire. Nato začala samovoľná aj ľuďmi zapríčinená invázia boľševníka obrovského do celej Európy, napríklad v Česku bol prvýkrát vysadený v Lázniach Kynžvart v roku 1862.[2]
Pestovať sa boľševník prestal v polovici dvadsiateho storočia,[2] ale invázia boľševníka obrovského už v tom čase zasiahla väčšinu Európy. Za centrum invázie možno považovať stred kontinentu. Ako s veľmi vážnym problémom sa s ňou stretáva Slovensko, Česko, Nemecko, južné a západné Poľsko, Švajčiarsko, krajiny Beneluxu, východ a sever Francúzska, Anglicko a Dánsko. V Škandinávii súťaží s inváziou Heracleum persicum. Len minimálny význam má v Pobaltí, kde sa s obrovskou prevahou presadil príbuzný druh boľševník Sosnowského. Mimo Európskeho kontinentu sa invázia odohráva aj v Severnej Amerike.
Boľševník obrovský sa zaraďuje medzi vôbec najnebezpečnejšie invázne druhy na slovenskom území (platí aj pre územia mnohých ďalších štátov), napr. podľa českých zákonov je majiteľ pozemku povinný zabrániť šíreniu tejto rastliny[4], čo nie je vždy dodržiavané. Vzhľadom na zdravotné riziká je nevyhnutné používať pri likvidácii boľševníka vhodný ochranný odev, ktorý nenasaje a neprepustí nebezpečné šťavy z rastliny, a ďalšie ochranné pomôcky, ako sú ochranné okuliare alebo tvárový štít a prípadne aj respirátor.
Mechanické odstránenie je nutné vykonať pokiaľ možno pred vysemenením rastliny (obvykle to znamená najneskôr v prvej polovici mája). Jeho účinok je obmedzený, pretože rastlina má vysokú regeneračnú schopnosť a dokáže znovu vyrásť z koreňov – jednotlivé rastliny je teda potreba celé vykopať (von musí minimálne 10 cm hlavného koreňa), rozsekať na kúsky a tie zlikvidovať. Pokosenie či podobné likvidácie len dočasne odstránia porast a zabránia ďalšiemu šíreniu. Pravidelný pokos (v stredoeurópskych podmienkach 2 – 3x za sezónu po dobu niekoľkých rokov) vedie nakoniec aj k potlačeniu výskytu – nutné však je, aby bol dlhodobý a úplne dôkladný, aby nedošlo k vysemeneniu ani jednej rastliny. U jednotlivých rastlín sa odporúča odsekať vykvitnuté okolíky, je však potrebné okolíky zlikvidovať, aby potom pohodené na poli zotrvačnosťou nevysemenili.
Zaujímavú možnosť predstavuje spásanie dobytkom – ovce a hovädzí dobytok sa časom naučí boľševník konzumovať. Potom, čo si naň zvyknú (spravidla im najskôr nechuti), väčšinou aktívne vyhľadávajú mladšie čerstvé rastliny, ktoré uprednostňujú pred väčšinou ostatných rastlín. Osvedčil sa aj pokos súvislého porastu boľševníka a následné opakované spásanie dobytkom, ktorý zlikviduje pokusy rastlín o obnovu. Doporučovaná miera spásania je 20 – 30 oviec na hektár na jar, v lete je možno ich počet znížiť až na 5 – 10, lebo rastliny sú už opakovanými pokusmi o regeneráciu vyčerpané a regenerujú pomalšie. Zriedkavé výskumy v oblasti spásania kozami ukazujú, že tieto zvieratá nie sú pre spásanie boľševníka vhodné, lebo nevykazujú voči negatívnym aspektom pôsobenia rastliny dostatočnú odolnosť.
Účinný je chemický postrek obsahujúci glyfosát (napr. Roundup-Biaktiv alebo Touchdown) či triclopyr (napr. Garlon). Chemický postrek však nie je stopercentne spoľahlivý a je tu nevýhoda jeho nedostatočnej selektívnosti. K aplikácii postreku by malo dochádzať pokiaľ možno skoro na jar, keď rastliny dosiahnu výšky zhruba 20 – 40 cm (asi apríl), na konci mája je potreba ho zopakovať. Len minimálny alebo žiadny účinok má v čase kvitnutia rastliny. Vysoko účinná, ale prácna je metóda aplikácie Roundupu injekčnou striekačkou do stonky rastliny.
Vzhľadom na náročnosť likvidácie bolševníka je veľmi dôležitá maximálna prevencia, spočívajúca v starostlivej likvidácii všetkých osamelých predsunutých jedincov, ktorí by mohli založiť novú enklávu, a v kontrole rizikových stanovísk, kde by sa boľševník mohol uchytiť.
Pri boji s boľševníkom je samozrejme možné kombinovať viac metód jeho ničenia. U jednotlivých rastlín sa napr. osvedčila likvidácia spočívajúca v odseknutí byliny tesne nad zemou a potrenie pahýľa stonky silnou koncentráciou herbicídu. Vždy je nutno pamätať na to, že nestačí výskyt rastliny potlačiť ak sa nemá celá kalamita opakovať, ale je nutné viesť boj až do posledného boľševníka a aj po totálnom víťazstve je nevyhnutné ešte minimálne 10 rokov oblasť starostlivo strážiť. Je tiež vhodné upraviť vyčistené priestranstva tak, aby sa obmedzila jeho vhodnosť pre nové zaplavenie boľševníkom.
Šťava z bylí a listov tejto rastliny obsahuje fototoxické furanokumaríny. V tme len dráždia kožu, na dennom svetle (respektíve na akomkoľvek svetle obsahujúcom UV zložky) spôsobujú ťažké poleptanie a spľuzgiernatenie pokožky. Je potrebné byť opatrný a pri kosení či inom mechanickom odstraňovaní rastlín sa vybaviť vhodným ochranným odevom, okuliarmi a tiež respirátorom (hlavne pokiaľ je používaná na kosenie kosačka, prostredníctvom ktorej môže dochádzať k rozprášeniu rastlinných štiav vo vzduchu). V oblastiach výskytu boľševníka je veľmi dôležité dávať pozor na deti, pretože duté byle rastliny ich môžu zvádzať k hrám a výrobe rôznych napodobenín ďalekohľadov a fúkačiek, čo môže viesť k minimálne dočasnému znetvoreniu tváre, o riziku vážneho poškodenia zraku nehovoriac.
Je nutné uvedomiť si, že prvotný kontakt s rastlinou a jej šťavami je bezbolestný, takže napr. deti sa s ňou môžu hrať aj niekoľko hodín, aby si vôbec uvedomili, akú škodu si tým spôsobujú. Fototoxické reakcie, ktoré sú príčinou následných problémov, sa aktivujú obvykle po 15 minútach osvetlenia[2] (závisí však na intenzite svetla a jeho zložení). Zápalové zranenia sa objavujú po cca 24 hodinách v rozsahu, ktorý je závislý od množstva štiav, ktorými bol človek znečistený, dĺžky ich pôsobenia a obranyschopnosti poškodeného; sú veľmi bolestivé a veľmi ťažko sa hoja. Účinok rastlinných štiav ďalej zvyšujú teplo a vlhkosť. Ich pozostatky, ako sú pigmentácia a jazvy, zostávajú viditeľné prinajmenšom celé mesiace, niekedy sa objavujú dlhodobejšie následky v podobe vyššej citlivosti poranených miest na UV žiarenie (trvajú až niekoľko rokov).[2] Podľa niektorých dermatológov môžu byť dlhodobým následkom občasné vyrážky (často iniciované slnečným žiarením).
U obzvlášť citlivých jedincov môžu už samotné výpary z väčšieho množstva pokosených rastlín vyvolať pálenie v krku, závraty, nevoľnosť a slzenie. U týchto ľudí tiež k vzniku zápalu môže stačiť dotyk neporaneného listu.[2]
Miesta zasiahnuté šťavou je nutné okamžite omyť silným dlhotrvajúcim prúdom vody a po opláchnutí zabrániť prístupu svetla vhodným zakrytím.[2] Pri poleptaní a druhotných príznakoch (bolesti hlavy, tras) je nutné po predchádzajúcom ošetrení vyhľadať lekára.
Pokiaľ pocítite z výparov tejto rastliny závraty, pálenie očí a iné nežiaduce účinky, je najlepšie opustiť zasiahnutý priestor a prenechať likvidáciu boľševníka menej citlivým jedincom, prípadne použiť vhodné ochranné prostriedky (kvalitný respirátor). Pokiaľ sú ťažkosti väčšieho rozsahu alebo do jedného dňa neustúpia, je taktiež potrebné navštíviť lekára.
Celá rastlina obsahuje napríklad rôzne alkoholy (metanol, etanol, n-oktanol), karboxylové kyseliny (kyselina kaprinová, kyselina laurová) či estery (n-hexylbutyrát, n-oktylacetát).
Najvýznačnejšou účinnou zložkou obsiahnutou v celej rastline sú však fototoxické furanokumaríny nachádzajúce sa predovšetkým v plodoch; menej v listoch a len minimálne v stonke. Obsah sa však mení aj v priebehu roka, najviac ich rastlina obsahuje v júni, najmenej v novembri.[5] K významným furanokumarínom boľševníka patria napríklad angelicín, pimpinellin, isopimpinellin, phellopterin, psoralen, bergapten a isobergapten.
Boľševník obrovský (Heracleum mantegazzianum) je rastlina z čeľade zelerovité (Apiaceae).
Pochádza z centrálnej Ázie (Kaukaz a z juhu priľahlé oblasti). V súčasnosti je to v Európe a Severnej Amerike významný invázny druh.
Na Slovensku a v mnohých ďalších krajinách severnej pologule je vedený ako obzvlášť nebezpečný druh, ktorý je schopný ničiť pôvodné ekosystémy na danom území. Navyše môže ohroziť ľudské zdravie, pretože obsahuje rôzne fototoxické furanokumaríny, ktoré u človeka spôsobujú ťažké fotodermatitídy.
Orjaški dežen (znanstveno ime Heracleum mantegazzianum) je strupena kobulnica, ki lahko zraste od dva do štiri metre v višino. Izvira s Kavkaza in srednje Azije. V Evropo so ga prinesli kot okrasno trajnico. Zanimiva je zaradi velikih listov in orjaških kobulastih socvetij.
Njena zasaditev ima vsaj dva nezaželena učinka:
Strupen rastlinski sok orjaškega dežena vsebuje furanokumarine in na koži, ki je izpostavljena soncu, povzroča pekoče in boleče izpuščaje. Ti se pogosto razvijejo v trdovratne mehurje, ki se zelo počasi zdravijo. Rastlinski sok, ki zaide v oči, pa lahko povzroči začasno ali celo trajno slepoto.
V Sloveniji poleg orjaškga dežena uspevajo še domorodne vrste deženov; med njimi je splošno razširjen navadni dežen. Domače vrste so bistveno manjše, od orjaškega dežena pa se razlikujejo tudi po nazobčanosti listov ter dlakavosti listnih pecljev in stebel.
Orjaški dežen prištevamo med tujerodne invazivne rastlinske vrste. K nam so ga prinesli s Kavkaza. Orjaški dežen povzroča nevšečnosti v več evropskih državah.
V Sloveniji so do zdaj zabeležili le nekaj rastišč te strupene rastline v naravi. Najbolj znano je rastišče v bližini ljubljanskega botaničnega vrta, kjer gre že za precej velik sestoj, znani pa so tudi podatki iz okolice Gorenje Blato,Maribora, Kočevja in Bleda.
Orjaški dežen (znanstveno ime Heracleum mantegazzianum) je strupena kobulnica, ki lahko zraste od dva do štiri metre v višino. Izvira s Kavkaza in srednje Azije. V Evropo so ga prinesli kot okrasno trajnico. Zanimiva je zaradi velikih listov in orjaških kobulastih socvetij.
Njena zasaditev ima vsaj dva nezaželena učinka:
s pomočjo krilatih plodov se širi z vrtov v okolico, kjer se lahko ustali in oblikuje velike, težko prehodne sestoje; rastlina je zelo strupena.Jätteloka (Heracleum mantegazzianum), eller jättebjörnloka, är en art i familjen flockblommiga växter som förekommer naturligt i Kaukasien i sydvästra Asien. Jättelokan odlas ibland som prydnadsväxt och spreds som en sådan till Europa och Nordamerika. Numera ses den i nyintroducerade områden som en invasiv art och i andra områden som ett besvärligt ogräs.
Saften från växten är fototoxisk. När hud som kommit i kontakt med saften utsätts för solljus eller ultraviolett ljus ger det fototoxisk dermatit. Först blir huden röd och kliar kraftigt, inom två dygn bildas blåsor. Blåsorna ger lila eller svarta ärr, som i ovanliga fall kan bestå i många år. Sjukhusvård kan behövas.
Reaktionen orsakas av furanokumarin i blad, rötter, stam, blommor och frön.
Jättelokan betraktas numera i områden där den ej är ursprunglig som en invasiv art och i och med dess giftighet görs i många områden försök att bekämpa växten och förhindra dess spridning i Europa[3] och Nordamerika.[4]
Ett sätt att bekämpa jättelokan är att klippa ner den. Jättelokan bygger under sitt första år upp en kraftig rotstam och går först under andra året i blom under rik frösättning. Ett bestånd kan bekämpas rent mekaniskt på så sätt att blomställningar skärs av i syfte att förhindra all föryngring av beståndet, men detta kräver planlagd, noggrann uppföljning så att inga mogna frön kvarstår och bekämpningen måste pågå oavbrutet under två till tre år innan den sista plantan försvunnit. Gamla frön kan gro efter så lång tid som sju år i mark, så övervakning av växtplatsen behövs.
Om blomställningarna skärs av tidigt förhindras frösättning snabbt och effektivt även om blomställningarna lämnas kvar på marken. Vid beskärning i ett senare skede måste blomställningarna samlas upp så att inte fröna skall hamna på marken och gro, något som i hög grad fördyrar och komplicerar bekämpningen. Jättelokan kommer att driva fram en ny (lägre) blomning efter beskärning enligt ovan, och även denna kan hinna gå i frö, varför det är viktigt att bevaka utvecklingen och inte nöja sig med endast ett ingripande per säsong. Då hinner man även att komma åt plantor som är senare med sin första blomning.
Jätteloka (Heracleum mantegazzianum), eller jättebjörnloka, är en art i familjen flockblommiga växter som förekommer naturligt i Kaukasien i sydvästra Asien. Jättelokan odlas ibland som prydnadsväxt och spreds som en sådan till Europa och Nordamerika. Numera ses den i nyintroducerade områden som en invasiv art och i andra områden som ett besvärligt ogräs.
Heracleum mantegazzianum là một loài thực vật có hoa trong họ Hoa tán. Loài này được Sommier & Levier mô tả khoa học đầu tiên năm 1895.[1]
Thường mọc ở dọc bờ sông, ao hồ, trong rừng, dọc đường và trong vườn (do chim hoặc gió mang hạt tới). Chiều cao cây trưởng thành từ 2-5,5 m. Chúng có nguồn gốc tự nhiên từ khu vực Trung Á, nhưng nay đã phát tán ra nhiều nơi khắp châu Âu, Bắc Mỹ, châu Úc và rải rác nhiều nơi trên thế giới. Đây là loài cỏ dại có hại, nguy hiểm.
Thân thẳng, rỗng ở trong, lá hơi giống lá cây đu đủ. Nhưng phía ngoài thân và cành lá có rất nhiều gai nhỏ như sợi tóc, nhọn, dài từ 2–7 cm. Vỏ cây màu xanh nhưng đặc biệt có nhiều đốm màu hơi đỏ tía, loang lổ. Hoa nhỏ màu trắng, kết thành chùm, bán kính chùm hoa có thể tới 30 cm.
Loài này có độc tính cao, đặc biệt khi kết hợp với ánh sáng mặt trời và có thể gây ra ở người và thú sự phát ban đau đớn và phồng rộp như "hiện tượng đốt", và chậm lành.
Lưu ý an toàn: Nếu người hoặc súc vật chạm vào thì sẽ gây sưng, nóng, đỏ, đau rát, sau đó phồng rộp lên, chảy nước, ngang với bị bỏng độ 1-2. Bị nặng có thể gây sốt, vã mồ hôi, tim đập nhanh, thở gấp (đặc biệt nếu bị ở mắt có thể gây mù)... Trong trường hợp này nên đưa ngay bệnh nhân tới bác sĩ hoặc bệnh viện để được chữa trị sớm. Nếu phát hiện cây này cần cảnh báo và cẩn thận khi diệt trừ (tránh tiếp xúc trực tiếp, mọi thành phần của cây từ rễ, thân, lá, hoa quả... đều chứa độc tính).
Heracleum mantegazzianum là một loài thực vật có hoa trong họ Hoa tán. Loài này được Sommier & Levier mô tả khoa học đầu tiên năm 1895.
Thường mọc ở dọc bờ sông, ao hồ, trong rừng, dọc đường và trong vườn (do chim hoặc gió mang hạt tới). Chiều cao cây trưởng thành từ 2-5,5 m. Chúng có nguồn gốc tự nhiên từ khu vực Trung Á, nhưng nay đã phát tán ra nhiều nơi khắp châu Âu, Bắc Mỹ, châu Úc và rải rác nhiều nơi trên thế giới. Đây là loài cỏ dại có hại, nguy hiểm.
Thân thẳng, rỗng ở trong, lá hơi giống lá cây đu đủ. Nhưng phía ngoài thân và cành lá có rất nhiều gai nhỏ như sợi tóc, nhọn, dài từ 2–7 cm. Vỏ cây màu xanh nhưng đặc biệt có nhiều đốm màu hơi đỏ tía, loang lổ. Hoa nhỏ màu trắng, kết thành chùm, bán kính chùm hoa có thể tới 30 cm.
Loài này có độc tính cao, đặc biệt khi kết hợp với ánh sáng mặt trời và có thể gây ra ở người và thú sự phát ban đau đớn và phồng rộp như "hiện tượng đốt", và chậm lành.
Lưu ý an toàn: Nếu người hoặc súc vật chạm vào thì sẽ gây sưng, nóng, đỏ, đau rát, sau đó phồng rộp lên, chảy nước, ngang với bị bỏng độ 1-2. Bị nặng có thể gây sốt, vã mồ hôi, tim đập nhanh, thở gấp (đặc biệt nếu bị ở mắt có thể gây mù)... Trong trường hợp này nên đưa ngay bệnh nhân tới bác sĩ hoặc bệnh viện để được chữa trị sớm. Nếu phát hiện cây này cần cảnh báo và cẩn thận khi diệt trừ (tránh tiếp xúc trực tiếp, mọi thành phần của cây từ rễ, thân, lá, hoa quả... đều chứa độc tính).
Борщевик Мантегацци — довольно неприхотливое растение. Он охотно растёт как на ярком свету, так и в полутени и может расти на одном и том же месте до 7 лет подряд. Ему подходят любые почвы, богатые питательными веществами.
Размножают его делением корневищ и семенами, высевая их сразу после сбора или поздней осенью.
Используется для одиночных посадок и растительных ансамблей, у водоёмов, во влажных и тенистых местах.
Борщевик Мантегацци не просто злостный сорняк. Это растение также выделяет токсичные фуранокумарины, которые на солнечном свету вызывают сильные ожоги[6]. В связи с этим детей рекомендуется оберегать от зарослей борщевика Мантегацци. В настоящее время во многих странах Западной Европы идёт энергичная борьба с его распространением[7].
Вид Борщевик Мантегацци входит в секцию Pubescentia Manden. рода Борщевик (Heracleum L.), куда, кроме него, относятся также Борщевик Сосновского (Heracleum sosnowskyi Manden.) и Борщевик опушённый (Heracleum pubescens (Hoffm.) Bieb.). Все эти растения довольно высокие, с очень крупными зонтиками; краевые цветки в соцветиях сильно увеличены.
Борщевик Мантегацци — довольно неприхотливое растение. Он охотно растёт как на ярком свету, так и в полутени и может расти на одном и том же месте до 7 лет подряд. Ему подходят любые почвы, богатые питательными веществами.
Размножают его делением корневищ и семенами, высевая их сразу после сбора или поздней осенью.
Используется для одиночных посадок и растительных ансамблей, у водоёмов, во влажных и тенистых местах.
大豕草(学名:Heracleum mantegazzianum),归伞形科独活属。原产于高加索及中亚地区,在19世纪作为一园艺植物被引入英国,之后在欧洲得到擴散,又被引入到美国以及加拿大地区。
大豕草分泌汁液有毒,人体若沾此汁液遇阳光后会起泡、严重会导致灼伤甚至失明[1]。2015年7月,英国一名10岁的小女孩随父亲钓鱼,不慎沾上大豕草汁液,导致三级灼伤[2]。
大豕草(学名:Heracleum mantegazzianum),归伞形科独活属。原产于高加索及中亚地区,在19世纪作为一园艺植物被引入英国,之后在欧洲得到擴散,又被引入到美国以及加拿大地区。
大豕草分泌汁液有毒,人体若沾此汁液遇阳光后会起泡、严重会导致灼伤甚至失明。2015年7月,英国一名10岁的小女孩随父亲钓鱼,不慎沾上大豕草汁液,导致三级灼伤。

ジャイアント・ホグウィード(英語: Giant Hogweed[1][2][3]、学名:Heracleum mantegazzianum)は、セリ科の多年生植物。和名はバイカルハナウド。
ジャイアント・ホグウィードが、他の外来種と共にイギリスへ持ち込まれたのは19世紀のことで、観賞植物として持ち込まれた。そして現在では、イギリスに生息する鳥によって広範囲に広がっており、特に河川の堤防において顕著に広がっている。ジャイアント・ホグウィードが形成する密な群落は、固有の植物を排除し、動物の生息域を削ることとなっている[9]。アメリカ合衆国北西部とカナダ南部においても、ジャイアント・ホグウィードは生息地を広げており、加えてドイツ、フランス、ベルギーでは、外来種のジャイアント・ホグウィードが、在来種のHeracleum sphondyliumを駆逐している[9]。
カナダでは、ジャイアント・ホグウィードがブリティッシュコロンビア州、アルバータ州、サスカチュワン州、オンタリオ州、ケベック州、ニューブランズウィック州、ノバスコシア州、果ては離島であるニューファンドランド島でも確認されている。ケベック州においては1990年代初頭に確認された[10]。その後、南西方面のオンタリオ州へと生息域を広げ、サウスウエスタン・オンタリオ(英語版)、2010年にはカナダ最大の都市圏であるグレータートロントとカナダ首都・オタワ近郊のレンフルー郡で自生していることが確認された[11]。
ジャイアント・ホグウィードは、1917年頃にニューヨークに持ち込まれたとされ、1930年代にはブリティッシュコロンビア州で記録されている。現在では、ブリティッシュコロンビア州西部、ワシントン州、オレゴン州といったアメリカ合衆国北西部のみならず、ニューファンドランド島からアメリカ合衆国北東部、ノバスコシア州から西のオンタリオ州、ウィスコンシン州、南のインディアナ州、メリーランド州、ニュージャージー州へと生息域を広げている[12][13]。更に時折、ミシガン州で自生報告がなされる[14]。現在では、アメリカ合衆国連邦政府によって、多くの州において有害植物として指定されている.[12]。
ジャイアント・ホグウィードの樹液には光毒性の物質が含まれており、樹液が皮膚に付着したまま太陽光か紫外線を浴びると、深刻な植物性光線皮膚炎を引き起こす。まず、皮膚が赤く腫れ上がり、痒みを引き起こす。そして48時間以内に水疱を生じさせる。それらは最後には、黒から紫色の傷として数年間もの間、肌に残り続ける。そのため、入院が必要とされている[9] 。更に、僅かな量でも眼に樹液が入ってしまうと、一時的、もしくは恒久的な失明の原因となる[15]。
これらの症状の原因は、ジャイアント・ホグウィードの葉、根、茎、花、種に含まれるフラノクマリン類の有機化合物である。フラノクマリン類の有機化合物は、上皮細胞の細胞核へと侵入し、細胞を死に追いやる。その茶色い色は、フラノクマリン類から生成されたメラニンによるものである。
各国の行政機関は、子供をジャイアント・ホグウィードから遠ざけておくことを勧めており、併せてジャイアント・ホグウィードに触れたり掘り返す際は、防護服と防護眼鏡を着用するように勧めている。そして、もし万が一にでも肌が晒されてしまった場合には、その部分を洗剤と水で入念に洗い、その部分が太陽光に触れないように数日間保護する必要があるとしている[9]。
光毒性と侵略的外来植物であることから、ジャイアント・ホグウィードは、駆除対象となっている。イギリスでは、1981年のWildlife and Countryside Actにおいて、ジャイアント・ホグウィードを植えたり、野生繁殖を引き起こしたりすることは違法とされている[9][16]。1974年のFederal Noxious Weed Actにおいて、アメリカ合衆国連邦政府によってジャイアント・ホグウィードは有害植物として規制され、アメリカ合衆国農務省の許可のない州間の移動やアメリカ合衆国への輸入が禁止された[17]。アメリカ合衆国農務省営林署によると、豚と牛は明白な症状が発生せず、ジャイアント・ホグウィードを食べることが出来ると報告されている[7]。ニューヨーク州環境保全省(英語版)は、2008年からデータベースによる報告を含むジャイアント・ホグウィードの統制プログラムを実施しており、ジャイアント・ホグウィードの駆除や除草剤散布を行っている[18][19]。2011年には、ジャイアント・ホグウィードを「ステロイドのノラニンジン」と呼ぶメイン州の園芸家達がメイン州の異なる21か所でジャイアント・ホグウィードを確認したと報告した。この報告された場所では、1個体から100個体もの群落も含まれていた[20]。
イギリスのプログレッシブ・ロックバンド・ジェネシス (Genesis)の1971年リリースのアルバム『怪奇骨董音楽箱』(Nursery Cryme)には、「ザ・リターン・オブ・ザ・ジャイアント・ホグウィード」(The Return of the Giant Hogweed)と題された楽曲が収録されている。この楽曲の歌詞では、ヴィクトリア朝時代の開拓者によって、最初に「採取され」、イングランドへ持ち込まれたずっと後のジャイアント・ホグウィードの多数の人間への攻撃が歌われている[21]。この楽曲はバンドの初期に録音された楽曲で、劇的で皮肉を含んだユーモアが散りばめられた典型的な楽曲である。1973年にリリースされたライヴアルバム『ライヴ』(Genesis Live)にも収録されている。
1971年のアルバムの楽曲は、イギリスのテレビドラマ「Rosemary & Thyme」の第1シーズンの第1話「And No Birds Sing」において、ホグウィードに囲まれた物語の中心で流された。
큰멧돼지풀(giant hogweed)은 미나리과에 속한 잡초이다. 학명은 헤라클레움 만테가지아눔(Heracleum mantegazzianum)으로, 2 ~ 5.5 미터까지 자라는 키큰 풀이다.[1] 겉보기에 어수리나 안젤리카를 닮았다. 광독성 식물이라 많은 나라에서 병해충에 해당하는 잡초로 분류한다. 큰멧돼지풀의 원산지는 캅카스 산맥의 (흑해에 가까운) 서쪽 지역이며, 19세기쯤에 브리튼 제도로 흘러들어왔다. 현재 유럽, 미국, 캐나다 등지에서도 볼 수 있다. 영어권 국가에서 가장 흔히 쓰이는 이름은 큰멧돼지풀(giant hogweed)[2][3][4] 이 가장 대중적이지만, 그 외에도 수레바퀴꽃(cartwheel-flower), 큰젖소어수리(giant cow parsnip) 등 다른 이름도 함께 쓰인다.
큰멧돼지풀의 즙액은 식물광선피부염을 일으켜 물집, 흉터를 발생시킬 수 있으며, 눈에 들어가면 실명할 수 있다. 이러한 유독 반응은 잎, 뿌리, 줄기, 꽃, 씨에 함유된 푸라노쿠머린 때문이다.
큰멧돼지풀의 억센 줄기는 밝은 녹색이며 검붉은 점이 곳곳에 나 있고, 속은 비어있다. 줄기의 지름은 3 ~ 8 센티미터이고 10 센티미터까지 자라기도 한다. 줄기에 나 있는 검붉은 점에는 커다랗고 뻣뻣한 하얀 털들이 자란다. 갈라지는 형태의 잎은 1 ~ 1.7 미터 크기까지 자란다.
수명은 최대 십수 년 정도지만,[출처 필요] 덩이줄기에서 매년 새로 싹이 난다. 6 ~7월 사이에 작고 새하얀 꽃들이 잔뜩 모여 지름 80 센티미터 정도의 덩어리를 이룬다. 꽃은 대부분 하얀색이지만 드물게 분홍빛 꽃을 피우는 개체도 있다. 길이 1 센티미터의 납작한 달걀꼴의 씨앗을 1,500 ~ 100,000 개 생산한다. 바람에 의해 씨앗이 10 미터 정도 날아갈 수 있으며, 물에 떨어져 물의 흐름을 타고 훨씬 먼 지방으로 퍼질 수도 있다. 큰멧돼지풀은 일임성식물이기에 씨앗을 맺으면 죽는다. 늦가을에서 초겨울 사이에 죽게 되지만, 죽고 나서도 줄기는 겨울 동안에도 그 자리에 남는다.
큰멧돼지풀은 연 강수량이 1,000 ~ 2,000 밀리미터 사이이고 여름이 더운 기후에서 잘 자란다고 보고되었다.
이 식물은 광독성 식물이다. 이 식물의 진액에 접촉한 피부가 햇빛 또는 자외선에 노출되면 식물광선피부염을 일으켜 끔찍한 염증을 발생시킨다. 우선 피부가 붉은색으로 변하고 가려워지기 시작한다. 그리고 물집이 생기고 48시간 동안 불에 타는 듯한 고통이 뒤따른다. 물집은 검은색 또는 보라색 흉터로 변하고 이 흉터는 몇 년 동안 남는다. 치료를 위해서 입원이 권장된다.[5] 진액이 눈에 들어갔을 경우 미량이라도 일시적 또는 영구적 실명을 초래할 수 있다.[6] 이러한 유독 반응은 푸라노쿠머린 유도체가 잎, 뿌리, 줄기, 꽃, 씨앗 등 식물 전체에 잔뜩 들어있기 때문이다. 이 화학물질은 상피세포의 세포핵에 침투해 DNA와 결합하여 그 세포를 죽게 만든다. 갈색 변색은 푸라노쿠머린이 멜라닌을 만들어내기 때문이다.
이런 이유로 여러 나라에서 큰멧돼지풀을 적극적으로 제거하고 있다. 영국에서는 1981년 야생 및 전원지대 조례에서 이 식물을 재배하거나 야생에 심는 것을 불법으로 규정하였다.[5][7] 아일랜드의 소택지에서는 큰멧돼지풀이 흔하다.
미국 정부에서도 1974년 유해 잡초 연방조례를 통해 큰멧돼지풀을 규제하며, 미국 영토 내로 수입하거나 농무성의 허가 없이 다른 주(州)로 이동시키는 것은 불법이다.[8] 농무성 산하 산림청에서는 돼지나 소가 큰멧돼지풀을 먹을 수 있다고 발표했다.[9]
뉴욕주 환경보호국은 2008년 이래로 보고, 데이터베이스 유지, 제초 등 다양한 방식으로 큰멧돼지풀을 방제하려고 노력하고 있다.[10][11]
2011년, 메인 주의 원예학자들이 큰멧돼지풀이 메인 주의 21개 장소에서 발견되었으며, 그 모종의 수는 1개에서 백여 개에 이른다고 보고했다.[12]
영국, 프랑스 등 서부 유럽에 많이 서식하고 국내에는 서식하지 않는 것으로 알려졌다. 국내에는 야산에서 흔히 볼 수 있는 자이언트 하귀드와 같은 '속'에 해당하는 어수리(Common Hogweed)가 있지만, 같은 '종'이 아니고 특정 지역에서는 나물로도 먹을 만큼 안전하다고 한다.[13]
큰멧돼지풀(giant hogweed)은 미나리과에 속한 잡초이다. 학명은 헤라클레움 만테가지아눔(Heracleum mantegazzianum)으로, 2 ~ 5.5 미터까지 자라는 키큰 풀이다. 겉보기에 어수리나 안젤리카를 닮았다. 광독성 식물이라 많은 나라에서 병해충에 해당하는 잡초로 분류한다. 큰멧돼지풀의 원산지는 캅카스 산맥의 (흑해에 가까운) 서쪽 지역이며, 19세기쯤에 브리튼 제도로 흘러들어왔다. 현재 유럽, 미국, 캐나다 등지에서도 볼 수 있다. 영어권 국가에서 가장 흔히 쓰이는 이름은 큰멧돼지풀(giant hogweed) 이 가장 대중적이지만, 그 외에도 수레바퀴꽃(cartwheel-flower), 큰젖소어수리(giant cow parsnip) 등 다른 이름도 함께 쓰인다.
큰멧돼지풀의 즙액은 식물광선피부염을 일으켜 물집, 흉터를 발생시킬 수 있으며, 눈에 들어가면 실명할 수 있다. 이러한 유독 반응은 잎, 뿌리, 줄기, 꽃, 씨에 함유된 푸라노쿠머린 때문이다.